



还剩18页未读,
继续阅读
成套系列资料,整套一键下载
- 【同步课件】2.2 .1+氯气的性质+高一化学同步备课(人教版2019必修第一册) 课件 6 次下载
- 【分层练习】2.2 .1 氯气的性质高一化学同步备课(人教版2019必修第一册)(原卷版+解析版) 试卷 3 次下载
- 【分层练习】2.2 .2 氯气的实验室制法和氯离子的检验高一化学同步备课(人教版2019必修第一册)(原卷版+解析版) 试卷 3 次下载
- 【同步课件】2.2 .4物质的量在化学方程式计算中的应用高一化学同步备课(人教版2019必修第一册) 课件 7 次下载
- 【分层练习】2.2 .4物质的量在化学方程式计算中的应用高一化学同步备课(人教版2019必修第一册)(原卷版+解析版) 试卷 4 次下载
【同步课件】2.2 .2 氯气的实验室制法和氯离子的检验 高一化学同步备课(人教版2019必修第一册)
展开
这是一份第二章第二节 第二课时 氯气的实验室制法和氯离子的检验 (同步课件)-2024-2025学年高一化学同步备课(人教版2019必修第一册),共26页。
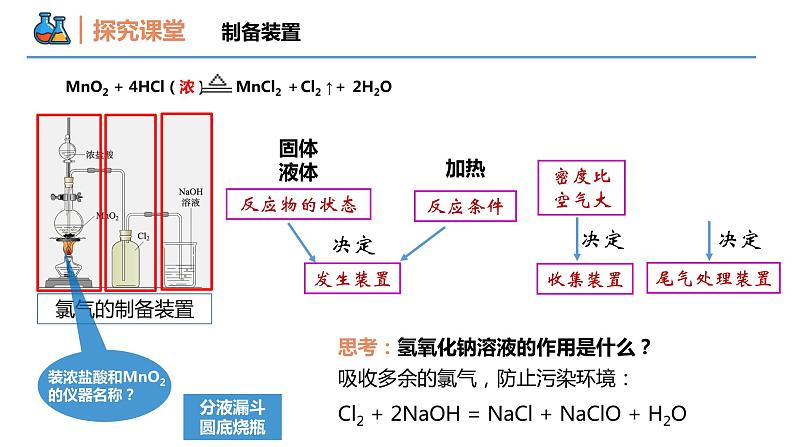
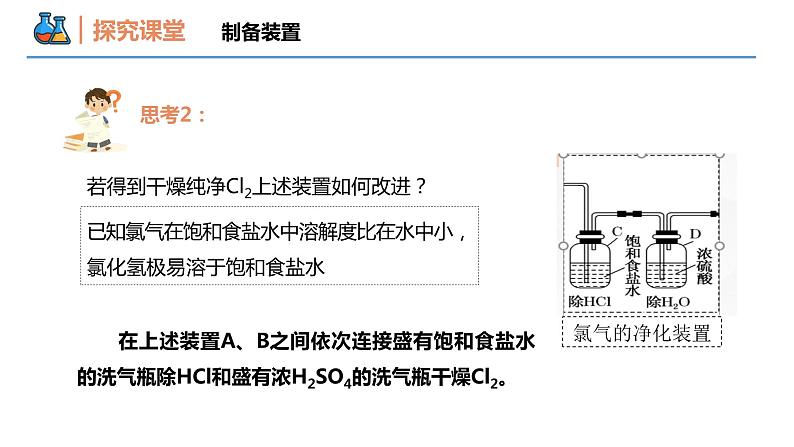
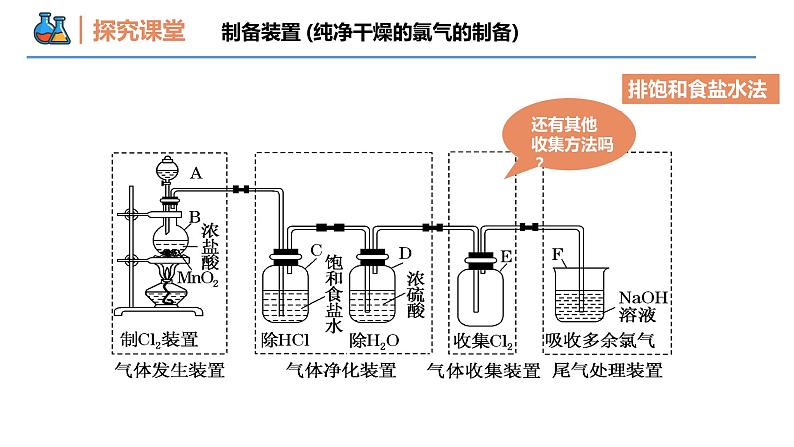
课时2 氯气的实验室制法和氯离子的检验 第二节 氯及其化合物 第二章 海水中的重要元素——钠和氯 壹贰氯气的实验室制法氯离子的检验本节重难点MnO2 + 4HCl(浓) MnCl2 +Cl2 ↑+ 2H2O舍勒是怎样在实验室制取氯气的?知识回顾:氧化剂还原剂 思考:参与反应的氧化剂与还原剂的物质的量之比? 1:2酸性舍勒将软锰矿(主要成分MnO2 )与浓盐酸混合并加热时,产生了一种黄绿色的气体(氯气)。书写此反应的化学方程式并单线桥分析。制备原理制备装置固体 液体 发生装置反应物的状态反应条件决定密度比空气大收集装置决定思考:氢氧化钠溶液的作用是什么?吸收多余的氯气,防止污染环境:Cl2 + 2NaOH = NaCl + NaClO + H2O尾气处理装置决定加热分液漏斗圆底烧瓶 思考1:利用右侧装置收集的Cl2纯净吗?有什么杂质?装置收集的Cl2不纯,有HCl和H2O(g)。制备装置制备装置已知氯气在饱和食盐水中溶解度比在水中小,氯化氢极易溶于饱和食盐水 在上述装置A、B之间依次连接盛有饱和食盐水的洗气瓶除HCl和盛有浓H2SO4的洗气瓶干燥Cl2。 思考2:若得到干燥纯净Cl2上述装置如何改进?制备装置(纯净干燥的氯气的制备)排饱和食盐水法 思考3:总结检验氯气的方法和原理?1、用湿润淀粉碘化钾试纸靠近瓶口,白色试纸变蓝色Cl2+2KI=I2+2KCl I2遇淀粉变蓝制备装置2、黄绿色充满集气瓶 氯气是黄绿色方法引导:实验室中制取气体装置的设计反应物状态反应条件气体及所含杂质的性质气体的密度、气体在水中溶解性、是否与水反应等发生装置收集装置除杂装置尾气处理装置制备氯气的其他方法2KMnO4+16HCl(浓) = 2KCl+2MnCl2+5Cl2↑+8H2O可用KMnO4代替MnO2与浓盐酸反应【例1】(1) 实验室制取氯气时,下列操作不正确的是___________(填字母)。A. 装置Ⅰ可用于制取少量氯气B. 用装置Ⅱ除去氯气中的少量氯化氢C. 用装置Ⅲ制取氯气D. 用装置Ⅳ干燥氯气ABCD【例1】(2)实验室制取干燥、纯净的氯气,除了二氧化锰、浓盐酸外还需要的试剂有:_________________、_________________、_________________。饱和食盐水浓硫酸NaOH溶液(3)已知高锰酸钾与浓盐酸在常温下反应能产生氯气。 若用下图所示的实验装置来制备纯净、干燥的氯气,并试验其与金属的反应。每个虚线框表示一个单元装置,其中有错误的是_________________(填字母)BD【变式1】下列制取Cl2、探究其漂白性,收集并进行尾气处理的原理和装置合理的是( )BA. 制取氯气 D. 尾气吸收B. 探究漂白性C. 收集氯气 拓展:实验装置的选择1、气体发生装置固体加热——KMnO4、KClO3(MnO2)制备氧气固液混合不需要加热——HCl + CaCO3固液混合需要加热——HCl(浓) + MnO2拓展:实验装置的选择收集难溶或微溶于水(或其他液体)的气体向下排空气法(收集密度比空气小的气体)向上排空气法(收集密度比空气大的气体)排空气法排水法2、气体收集装置拓展:实验装置的选择液体干燥剂:浓硫酸固体干燥剂:五氧化二磷、无水CaCl2、碱石灰、硅胶等液体除杂试剂固体除杂试剂3、除杂装置难吸收易燃的可以点燃处理,选用C;难吸收的少量尾气可以先收集,选用D。练习:请选出Cl2 、HCl 、CO、NO尾气处理的装置说明:其他在液体中溶解度不大的气体用装置A; 溶解度极大的气体易倒吸,选用B可防倒吸。A B C D拓展:实验装置的选择4、尾气处理装置Cl-的检验HClNaClNa2CO3AgNO3溶液AgNO3溶液AgNO3溶液HNO3溶液HNO3溶液HNO3溶液Cl- + Ag+ = AgCl↓CO32- + 2Ag+ = Ag2CO3↓Ag2CO3 + 2H+ = 2Ag+ + CO2↑ + H2O都产生白色沉淀沉淀不溶解沉淀溶解都产生白色沉淀取少量待检液于一洁净试管中,向试管中加入稀硝酸酸化,再滴入AgNO3溶液,若产生白色沉淀,则被检液中含有Cl-。结论:氯离子检验方法1、取样2、加试剂3、现象水质检验员在检验水质应 用?【例2】有一包白色固体,它可能是KCl、K2CO3、KNO3中的一种或几种,进行下列实验: ① 溶于水,得无色溶液; ② 在所得溶液中滴入AgNO3溶液,生成白色沉淀; ③ 再滴加稀硝酸,沉淀量减少但不完全消失,同时有气泡生成。 根据上述现象判断: (1)白色固体一定含有的成分是___________________,可能含有的成分是___________________ (2)请写出上述实验中有关反应的离子方程式:___________________________________________________________________________________________________________KCl、K2CO3KNO3Cl- + Ag+ = AgCl↓CO32- + 2Ag+ = Ag2CO3↓Ag2CO3 + 2H+ = 2Ag+ + CO2↑ + H2O【变式2】检验某溶液中是否含有Cl-,正确的操作是( )A.取样,滴加AgNO3溶液,看是否有白色沉淀生成B.取样,先加盐酸酸化,再加入AgNO3溶液,看是否有白色沉淀生成C.取样,先加稀硫酸酸化,再加入AgNO3溶液,看是否有白色沉淀生成D.取样,先加入Ba(NO3)2溶液,取上层清液,再加入少量AgNO3溶液,有白色沉淀;再加稀硝酸,看白色沉淀是否消失D谢谢观看THANKS
课时2 氯气的实验室制法和氯离子的检验 第二节 氯及其化合物 第二章 海水中的重要元素——钠和氯 壹贰氯气的实验室制法氯离子的检验本节重难点MnO2 + 4HCl(浓) MnCl2 +Cl2 ↑+ 2H2O舍勒是怎样在实验室制取氯气的?知识回顾:氧化剂还原剂 思考:参与反应的氧化剂与还原剂的物质的量之比? 1:2酸性舍勒将软锰矿(主要成分MnO2 )与浓盐酸混合并加热时,产生了一种黄绿色的气体(氯气)。书写此反应的化学方程式并单线桥分析。制备原理制备装置固体 液体 发生装置反应物的状态反应条件决定密度比空气大收集装置决定思考:氢氧化钠溶液的作用是什么?吸收多余的氯气,防止污染环境:Cl2 + 2NaOH = NaCl + NaClO + H2O尾气处理装置决定加热分液漏斗圆底烧瓶 思考1:利用右侧装置收集的Cl2纯净吗?有什么杂质?装置收集的Cl2不纯,有HCl和H2O(g)。制备装置制备装置已知氯气在饱和食盐水中溶解度比在水中小,氯化氢极易溶于饱和食盐水 在上述装置A、B之间依次连接盛有饱和食盐水的洗气瓶除HCl和盛有浓H2SO4的洗气瓶干燥Cl2。 思考2:若得到干燥纯净Cl2上述装置如何改进?制备装置(纯净干燥的氯气的制备)排饱和食盐水法 思考3:总结检验氯气的方法和原理?1、用湿润淀粉碘化钾试纸靠近瓶口,白色试纸变蓝色Cl2+2KI=I2+2KCl I2遇淀粉变蓝制备装置2、黄绿色充满集气瓶 氯气是黄绿色方法引导:实验室中制取气体装置的设计反应物状态反应条件气体及所含杂质的性质气体的密度、气体在水中溶解性、是否与水反应等发生装置收集装置除杂装置尾气处理装置制备氯气的其他方法2KMnO4+16HCl(浓) = 2KCl+2MnCl2+5Cl2↑+8H2O可用KMnO4代替MnO2与浓盐酸反应【例1】(1) 实验室制取氯气时,下列操作不正确的是___________(填字母)。A. 装置Ⅰ可用于制取少量氯气B. 用装置Ⅱ除去氯气中的少量氯化氢C. 用装置Ⅲ制取氯气D. 用装置Ⅳ干燥氯气ABCD【例1】(2)实验室制取干燥、纯净的氯气,除了二氧化锰、浓盐酸外还需要的试剂有:_________________、_________________、_________________。饱和食盐水浓硫酸NaOH溶液(3)已知高锰酸钾与浓盐酸在常温下反应能产生氯气。 若用下图所示的实验装置来制备纯净、干燥的氯气,并试验其与金属的反应。每个虚线框表示一个单元装置,其中有错误的是_________________(填字母)BD【变式1】下列制取Cl2、探究其漂白性,收集并进行尾气处理的原理和装置合理的是( )BA. 制取氯气 D. 尾气吸收B. 探究漂白性C. 收集氯气 拓展:实验装置的选择1、气体发生装置固体加热——KMnO4、KClO3(MnO2)制备氧气固液混合不需要加热——HCl + CaCO3固液混合需要加热——HCl(浓) + MnO2拓展:实验装置的选择收集难溶或微溶于水(或其他液体)的气体向下排空气法(收集密度比空气小的气体)向上排空气法(收集密度比空气大的气体)排空气法排水法2、气体收集装置拓展:实验装置的选择液体干燥剂:浓硫酸固体干燥剂:五氧化二磷、无水CaCl2、碱石灰、硅胶等液体除杂试剂固体除杂试剂3、除杂装置难吸收易燃的可以点燃处理,选用C;难吸收的少量尾气可以先收集,选用D。练习:请选出Cl2 、HCl 、CO、NO尾气处理的装置说明:其他在液体中溶解度不大的气体用装置A; 溶解度极大的气体易倒吸,选用B可防倒吸。A B C D拓展:实验装置的选择4、尾气处理装置Cl-的检验HClNaClNa2CO3AgNO3溶液AgNO3溶液AgNO3溶液HNO3溶液HNO3溶液HNO3溶液Cl- + Ag+ = AgCl↓CO32- + 2Ag+ = Ag2CO3↓Ag2CO3 + 2H+ = 2Ag+ + CO2↑ + H2O都产生白色沉淀沉淀不溶解沉淀溶解都产生白色沉淀取少量待检液于一洁净试管中,向试管中加入稀硝酸酸化,再滴入AgNO3溶液,若产生白色沉淀,则被检液中含有Cl-。结论:氯离子检验方法1、取样2、加试剂3、现象水质检验员在检验水质应 用?【例2】有一包白色固体,它可能是KCl、K2CO3、KNO3中的一种或几种,进行下列实验: ① 溶于水,得无色溶液; ② 在所得溶液中滴入AgNO3溶液,生成白色沉淀; ③ 再滴加稀硝酸,沉淀量减少但不完全消失,同时有气泡生成。 根据上述现象判断: (1)白色固体一定含有的成分是___________________,可能含有的成分是___________________ (2)请写出上述实验中有关反应的离子方程式:___________________________________________________________________________________________________________KCl、K2CO3KNO3Cl- + Ag+ = AgCl↓CO32- + 2Ag+ = Ag2CO3↓Ag2CO3 + 2H+ = 2Ag+ + CO2↑ + H2O【变式2】检验某溶液中是否含有Cl-,正确的操作是( )A.取样,滴加AgNO3溶液,看是否有白色沉淀生成B.取样,先加盐酸酸化,再加入AgNO3溶液,看是否有白色沉淀生成C.取样,先加稀硫酸酸化,再加入AgNO3溶液,看是否有白色沉淀生成D.取样,先加入Ba(NO3)2溶液,取上层清液,再加入少量AgNO3溶液,有白色沉淀;再加稀硝酸,看白色沉淀是否消失D谢谢观看THANKS
相关资料
更多










