资料中包含下列文件,点击文件名可预览资料内容


























































还剩50页未读,
继续阅读
所属成套资源:新人教版化学必修第一册PPT课件整册
成套系列资料,整套一键下载
人教版高中化学必修第一册第二章海水中的重要元素——钠和氯导学案+课件
展开
这是一份人教版高中化学必修第一册第二章海水中的重要元素——钠和氯导学案+课件,文件包含233pptx、221pptx、222pptx、213pptx、211pptx、212pptx、231pptx、232pptx、221docx、222DOCX、233docx、213docx、211docx、212docx、231docx、232docx等16份课件配套教学资源,其中PPT共366页, 欢迎下载使用。
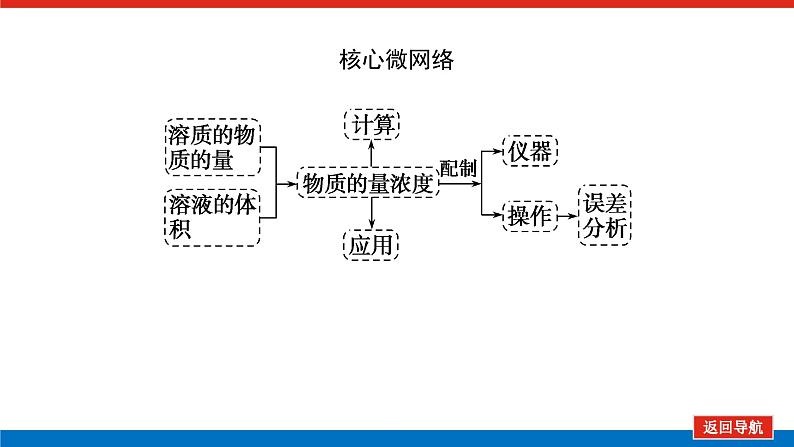
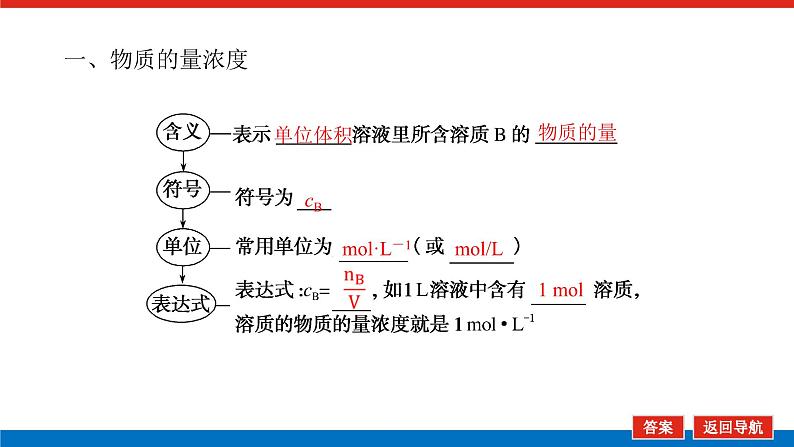
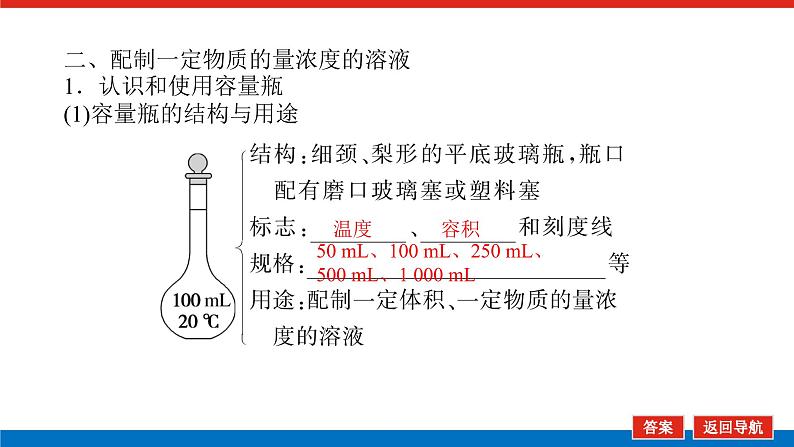
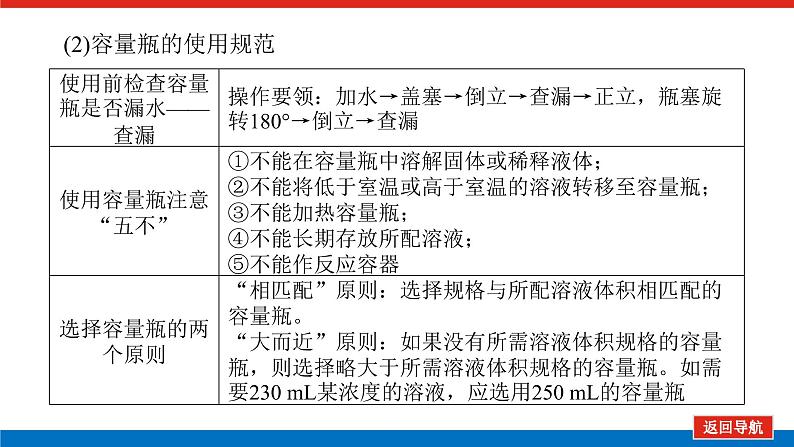
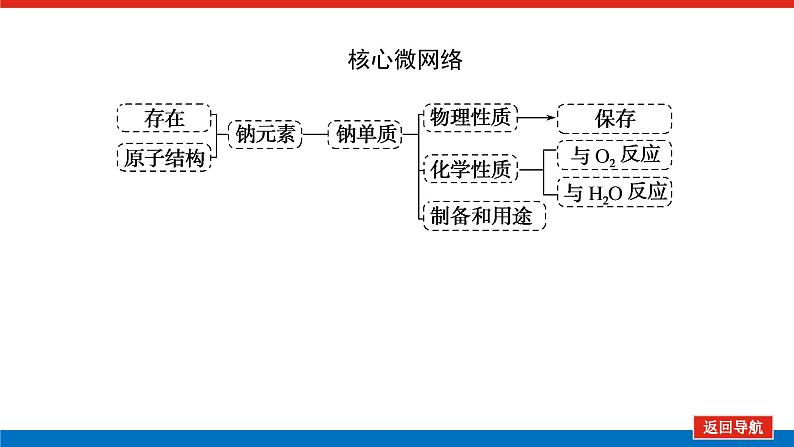
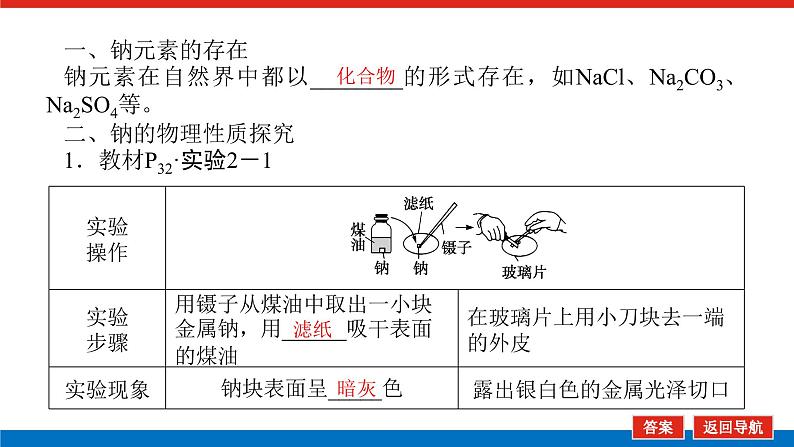
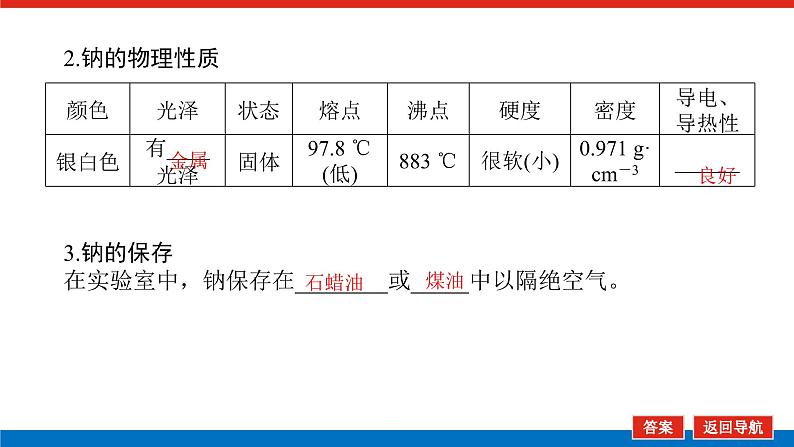
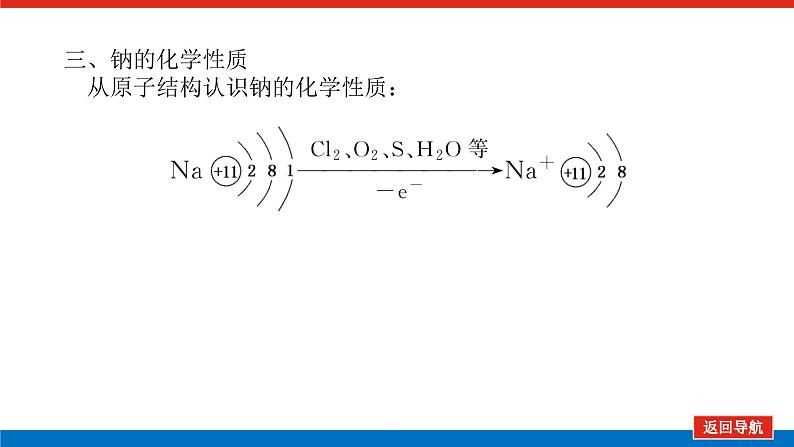
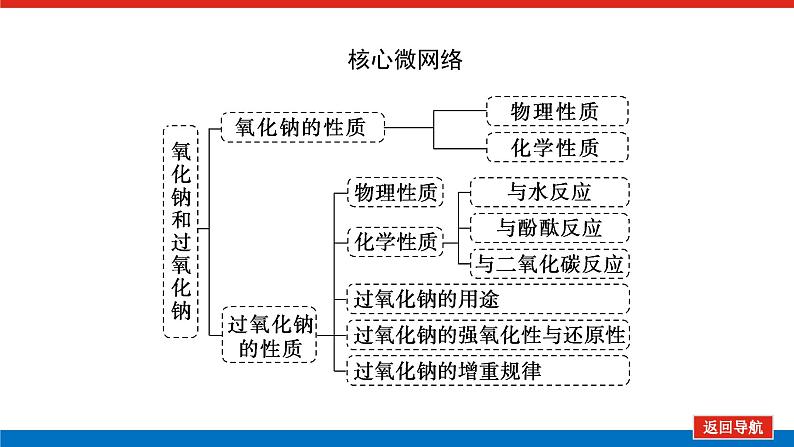
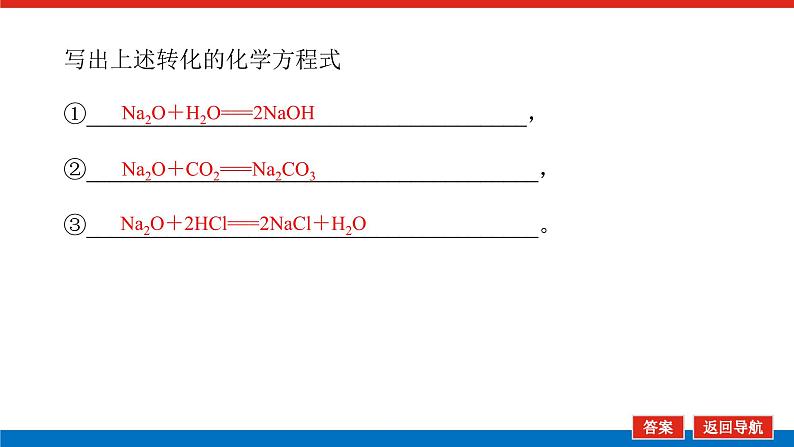
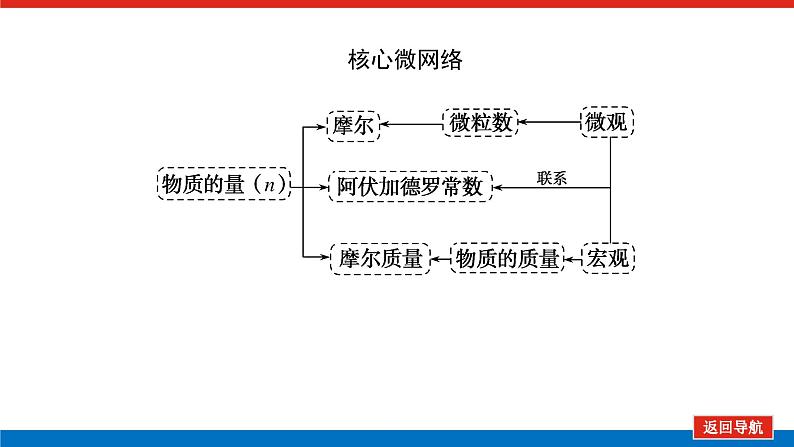
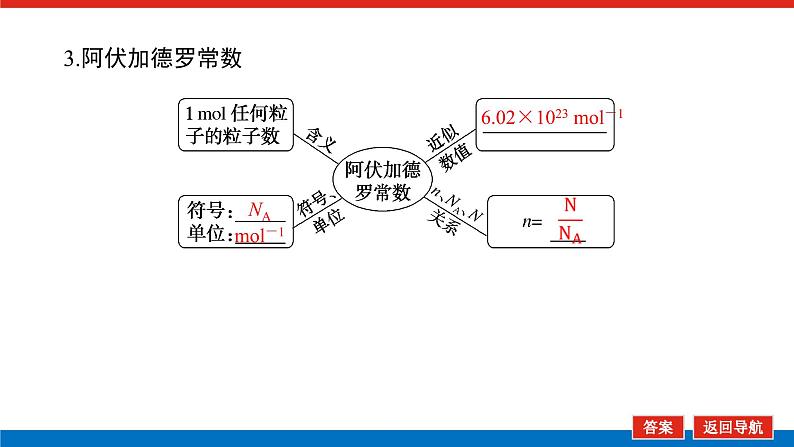
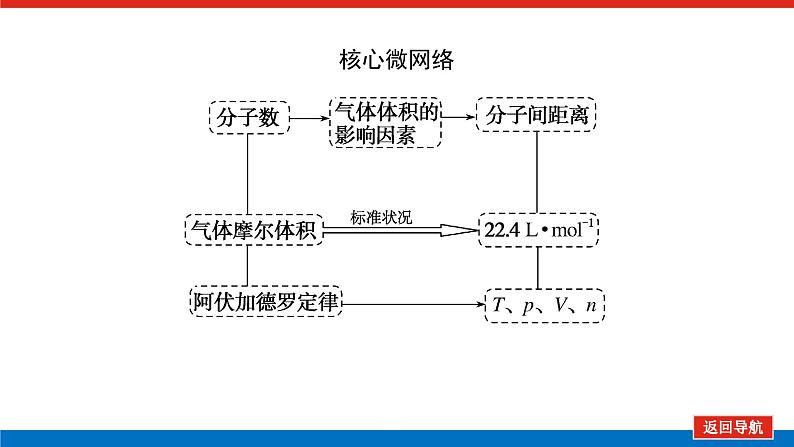
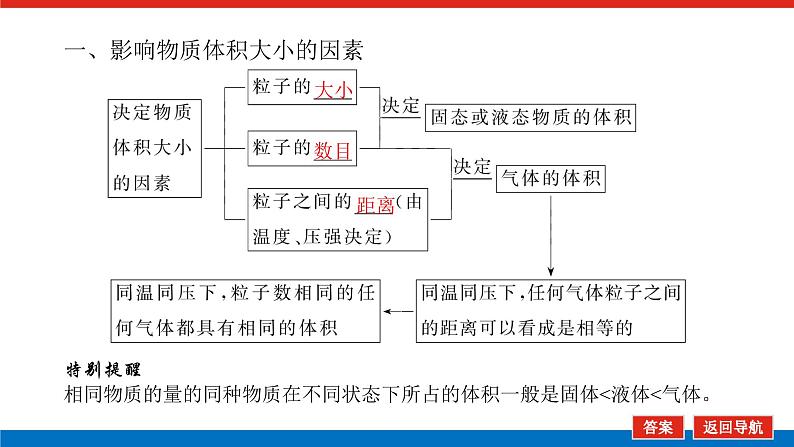
第1课时 物质的量的单位——摩尔核心微网络素养新要求1. 认识物质的量及其单位——摩尔的含义。2.理解阿伏加德罗常数的含义及应用。3.了解摩尔质量并能进行简单计算。学业基础一、物质的量及其单位1.物质的量(1)表示含有____________的集合体,符号为____,是国际单位制中规定的7个基本物理量之一。(2)物质的量可将宏观可称量的物质与微观粒子(如原子、离子或分子等)联系起来。 特别提醒 (1)粒子集合体中的“粒子”指微观粒子,包括分子、原子、离子、原子团、电子、质子、中子等,不指宏观物体。(2)某粒子的物质的量,用“n(粒子符号)”表示。例如n(O2)、n(H2O)、n(Na+)等。一定数目粒子n2.物质的量的单位——摩尔(mol)(1)摩尔是物质的量的单位,简称____,符号为_____,是国际单位制中7个基本单位之一,类似于长度的基本单位——米、质量的基本单位——千克等。(2)适用对象______作为物质的量的单位,只适用于微观粒子。(3)摩尔的规定国际上规定,1 mol粒子集合体所含的粒子数约为____________。摩mol摩尔6.02×1023特别提醒 “三化”理解物质的量的含义3.阿伏加德罗常数6.02×1023 mol-1NAmol-1 单位物质的量的物质所具有的质量Mg/mol(或g·mol-1)相对原子质量或相对分子质量[即学即练]1.判断正误,正确的打“√”,错误的打“×”(1)物质的量可以理解为物质的数量。( )(2)物质的量描述的对象是分子、原子等微观粒子。( )(3)摩尔是国际单位制中七个基本物理量之一。( )(4)1 mol氧气中约含有6.02×1023个原子。( )(5)1 mol任何粒子所含有的粒子数相等。( )(6)阿伏加德罗常数就是6.02×1023。( )(7)在使用摩尔表示物质的量的单位时,应用化学式指明粒子的种类。( )××××√√√2.“物质的量”是指( )A.物质的质量B.物质的微观粒子数C.物质的质量与微观粒子数D.把物质的质量同微观粒子数联系起来的一个基本物理量答案:D3.[2022·厦门高一检测]下列说法正确的是( )A.摩尔质量就是物质的相对分子质量或相对原子质量的6.02×1023倍B.摩尔质量就等于物质的相对分子质量或相对原子质量C.HNO3的摩尔质量是63 gD.H2SO4和H3PO4的摩尔质量相等答案:D4.[2022·济南高一检测]下列有关物质的量的说法正确的是( )A.CO的摩尔质量为28 gB.摩尔是国际单位制中的七个基本物理量之一C.物质的量适用于分子、离子、原子等微观粒子D.10 g H2O的摩尔质量比1 g H2O的摩尔质量大答案:C 答案:C6.2022年2月4日,第二十四届冬奥会在北京盛大开幕,在本届北京冬奥会中,中国仍会以“零容忍”的态度全力实现赛会期间兴奋剂问题“零出现”的目标。苯丙胺是一种常见的兴奋剂。 苯丙胺分子式:C9H13N(1)“苯丙胺”的摩尔质量为____________。(2)0.5 mol苯丙胺中约含有__________个氢原子。(3)270 g苯丙胺的物质的量是_______,其中含有碳元素的质量是______。(4)苯丙胺中碳、氢、氮原子的物质的量之比为________,质量之比为___________。135 g·mol-13.913×10242 mol216 g9∶13∶1108∶13∶14核心素养目标1 “物质的量”的有关概念例1 下列关于“物质的量”“摩尔”和“摩尔质量”的叙述中正确的是( )A.物质的摩尔质量等于其相对分子(原子)质量B.“物质的量”是国际单位制中的一个基本单位C.1 mol任何粒子的粒子数为NAD.1 mol任何物质都含有约6.02×1023个原子答案:C解析:当物质的摩尔质量以g·mol-1为单位时,其数值是等于其相对分子(原子)质量,A错误;“物质的量”是国际单位制中的一个基本物理量,不是单位,摩尔才是基本单位,B错误;1 mol任何粒子的粒子数叫阿伏加德罗常数,符号为NA,C正确;1 mol任何物质都含有约6.02×1023个相应的微粒,但原子数不一定为6.02×1023,如1 mol O2含有的原子数约为2×6.02×1023个,D错误。状元随笔 1 mol不同物质的“同”与“不同”“同”是粒子数相同,如1 mol H2O和1 mol Al所含的粒子数都约是6.02×1023(或1NA)。“不同”是不同粒子质量不同而导致1 mol物质质量不同,如1 mol H2O的质量是18 g,1 mol Al的质量是27 g。 [提升1] 下列有关阿伏加德罗常数(NA)的说法错误的是( )A.32 g O2所含的原子数目为NAB.0.5 mol H2O含有的原子数目为1.5NAC.1 mol H2O含有的H2O分子数目为NAD.0.5NA个氯气分子的物质的量是0.5 mol答案:A解析:32 g O2为1 mol,氧原子数为2NA,A错误;0.5 mol H2O中原子数为0.5×3×NA,B正确;1 mol H2O中含有H2O分子数为NA,C正确;0.5NA个Cl2分子的物质的量为0.5 mol,D正确。状元随笔 (1)表述微观粒子的物质的量时,必须指明微观粒子的种类,例如:1 mol H、1 mol H2或1 mol H+都正确;但1 mol氢因为未指明微观粒子种类而错误。(2)物质的量只能用来表示微观粒子的多少,不能用来表示宏观物质的多少。关键能力物质的摩尔质量、1 mol物质的质量、相对分子(或原子)质量的比较目标2 “n、m、N”之间的计算例2 下列说法正确的是( )A.16 g O2所含的分子数为6.02×1023个B.0.5 mol H2SO4含有的原子数为3.5NAC.18 g H2O中质子的物质的量为1 molD.22 g物质A中含有的分子数为3.01×1023,则A的摩尔质量为44 g带单位计算是解题的规范要求。答案:B [提升2] 147 g H2SO4的物质的量是________;0.5 mol H2SO4的质量是_____g,其中含有_____mol H,含有____mol O;2 mol H2SO4中含有H2SO4分子数为___________个,含氢原子数为___________个。1.5 mol49121.204×10242.408×1024 关键能力物质的量、物质的质量、粒子数目之间的计算关系通过计算,准确理解“阿伏加德罗常数”把微观物理量和宏观物理量联系起来的“桥梁”作用。学考评价1.[2022·郑州高一检测]摩尔起源于希腊文mole,原意为“堆量”,是在1971年10月,由41个国家参加的第14届国际计量大会上决定增加的国际单位制(SI)的第七个基本单位。下列关于“摩尔”的理解正确的是( )A.摩尔是国际科学界建议采用的一种物理量B.摩尔是物质的量的单位,简称摩,符号为molC.我们把含有6.02×1023个粒子的任何粒子的集合体计量为1摩尔D.1 mol氧含6.02×1023个O2答案:B解析:摩尔只是物质的量这一物理量的单位,不是一种物理量;含6.02×1023个粒子的集合体不一定计量为1摩尔,如含6.02×1023个氧原子的O2的物质的量是0.5 mol;1 mol氧含义不明确,应说1 mol O2含6.02×1023个氧分子。2.下列说法中正确的是( )A.摩尔是国际单位制中的七个基本物理量之一B.0.5 mol H2O中含有的原子数目为1.5 NAC.64 g氧相当于2 mol氧D.1 mol任何物质都约含有6.02×1023个原子答案:B解析:A项:物质的量是国际单位制中的七个基本物理量之一,摩尔是物质的量的单位;C项:使用物质的量或摩尔时必须用化学式指明确定的粒子,“2 mol氧”这种说法中的氧未指明是氧原子、氧分子还是氧离子;D项:构成物质的粒子除了原子外,还有分子、离子等。3.下列说法中,正确的是( )A.1 mol氢约含有阿伏加德罗常数个氢B.1 mol CaCl2含有1 mol Cl-C.1 mol电子约含有6.02×1023个电子D.1 mol H2O含有1 mol H2和1 mol O答案:C解析:A项错误,未注明微粒的种类,氢是氢分子、氢原子还是氢离子不明确;B项错误,1 mol CaCl2应含有2 mol Cl-;D项错误,由初中化学可知H2O中无H2,正确的表述为1 mol H2O含有2 mol H和1 mol O。4.NA代表阿伏加德罗常数,下列说法正确的是( )A.含NA个H的H2的物质的量为1 molB.NA个CO和1 mol N2所含分子数相等C.NA个H2SO4与1 mol H3PO4所含氢原子的个数比为1∶1D.0.1 mol C含1.2NA个质子答案:B5.下列说法正确的是( )A.1 mol氢约含有6.02×1023个微粒B.H2的摩尔质量是2 gC.1 mol O2的质量是32 g,含有的氧原子数为2NAD.2NA个H2SO4的摩尔质量为196 g·mol-1答案:C解析:A项未指出1 mol氢具体是什么微粒,无法确定其个数,如1 mol H2含1 mol氢气分子,含 2 mol氢原子;B项摩尔质量的单位为g·mol-1;D项2NA个H2SO4的质量为196 g,但其摩尔质量仍然为98 g·mol-1。 表示SO2的物质的量2 mol表示一个SO2分子的质量1.06×10-22 g 表示SO2的物质的量2 mol表示一个SO2分子的质量1.06×10-22 g表示SO2的相对分子质量647.计算填空:(1)0.5 mol的Fe含________个铁原子(用6.02×1023表示阿伏加德罗常数的值),质量是____ g。(2)2 mol CO2中含____ mol碳原子,_____个氧原子(用NA表示阿伏加德罗常数的值),_____个质子(用NA表示阿伏加德罗常数的值),质量是____ g。(3)已知0.4 mol的CO和CO2的混合气体共14.4 g,则①CO的质量为______;②混合气体的平均摩尔质量为________。3.01×10232824NA44NA885.6 g36 g·mol-1 练后感悟 (1)物质的量是物质的质量和微粒数目之间计算的桥梁,已知物质的质量求其微粒数目或已知物质的微粒数目求其质量都是先转换成物质的量,再计算微粒数或质量。特别要注意微粒数目可能是分子,也可能是所含的原子、离子、电子等。解题时要审清题意。(2)高中化学计算主要是以物质的量为中心的计算,学习时要养成把“其他物理量转化为物质的量”这一思维模式。如已知物质的质量求其粒子数,首先根据摩尔质量求出其物质的量,然后根据阿伏加德罗常数转化为粒子数。
第1课时 物质的量的单位——摩尔核心微网络素养新要求1. 认识物质的量及其单位——摩尔的含义。2.理解阿伏加德罗常数的含义及应用。3.了解摩尔质量并能进行简单计算。学业基础一、物质的量及其单位1.物质的量(1)表示含有____________的集合体,符号为____,是国际单位制中规定的7个基本物理量之一。(2)物质的量可将宏观可称量的物质与微观粒子(如原子、离子或分子等)联系起来。 特别提醒 (1)粒子集合体中的“粒子”指微观粒子,包括分子、原子、离子、原子团、电子、质子、中子等,不指宏观物体。(2)某粒子的物质的量,用“n(粒子符号)”表示。例如n(O2)、n(H2O)、n(Na+)等。一定数目粒子n2.物质的量的单位——摩尔(mol)(1)摩尔是物质的量的单位,简称____,符号为_____,是国际单位制中7个基本单位之一,类似于长度的基本单位——米、质量的基本单位——千克等。(2)适用对象______作为物质的量的单位,只适用于微观粒子。(3)摩尔的规定国际上规定,1 mol粒子集合体所含的粒子数约为____________。摩mol摩尔6.02×1023特别提醒 “三化”理解物质的量的含义3.阿伏加德罗常数6.02×1023 mol-1NAmol-1 单位物质的量的物质所具有的质量Mg/mol(或g·mol-1)相对原子质量或相对分子质量[即学即练]1.判断正误,正确的打“√”,错误的打“×”(1)物质的量可以理解为物质的数量。( )(2)物质的量描述的对象是分子、原子等微观粒子。( )(3)摩尔是国际单位制中七个基本物理量之一。( )(4)1 mol氧气中约含有6.02×1023个原子。( )(5)1 mol任何粒子所含有的粒子数相等。( )(6)阿伏加德罗常数就是6.02×1023。( )(7)在使用摩尔表示物质的量的单位时,应用化学式指明粒子的种类。( )××××√√√2.“物质的量”是指( )A.物质的质量B.物质的微观粒子数C.物质的质量与微观粒子数D.把物质的质量同微观粒子数联系起来的一个基本物理量答案:D3.[2022·厦门高一检测]下列说法正确的是( )A.摩尔质量就是物质的相对分子质量或相对原子质量的6.02×1023倍B.摩尔质量就等于物质的相对分子质量或相对原子质量C.HNO3的摩尔质量是63 gD.H2SO4和H3PO4的摩尔质量相等答案:D4.[2022·济南高一检测]下列有关物质的量的说法正确的是( )A.CO的摩尔质量为28 gB.摩尔是国际单位制中的七个基本物理量之一C.物质的量适用于分子、离子、原子等微观粒子D.10 g H2O的摩尔质量比1 g H2O的摩尔质量大答案:C 答案:C6.2022年2月4日,第二十四届冬奥会在北京盛大开幕,在本届北京冬奥会中,中国仍会以“零容忍”的态度全力实现赛会期间兴奋剂问题“零出现”的目标。苯丙胺是一种常见的兴奋剂。 苯丙胺分子式:C9H13N(1)“苯丙胺”的摩尔质量为____________。(2)0.5 mol苯丙胺中约含有__________个氢原子。(3)270 g苯丙胺的物质的量是_______,其中含有碳元素的质量是______。(4)苯丙胺中碳、氢、氮原子的物质的量之比为________,质量之比为___________。135 g·mol-13.913×10242 mol216 g9∶13∶1108∶13∶14核心素养目标1 “物质的量”的有关概念例1 下列关于“物质的量”“摩尔”和“摩尔质量”的叙述中正确的是( )A.物质的摩尔质量等于其相对分子(原子)质量B.“物质的量”是国际单位制中的一个基本单位C.1 mol任何粒子的粒子数为NAD.1 mol任何物质都含有约6.02×1023个原子答案:C解析:当物质的摩尔质量以g·mol-1为单位时,其数值是等于其相对分子(原子)质量,A错误;“物质的量”是国际单位制中的一个基本物理量,不是单位,摩尔才是基本单位,B错误;1 mol任何粒子的粒子数叫阿伏加德罗常数,符号为NA,C正确;1 mol任何物质都含有约6.02×1023个相应的微粒,但原子数不一定为6.02×1023,如1 mol O2含有的原子数约为2×6.02×1023个,D错误。状元随笔 1 mol不同物质的“同”与“不同”“同”是粒子数相同,如1 mol H2O和1 mol Al所含的粒子数都约是6.02×1023(或1NA)。“不同”是不同粒子质量不同而导致1 mol物质质量不同,如1 mol H2O的质量是18 g,1 mol Al的质量是27 g。 [提升1] 下列有关阿伏加德罗常数(NA)的说法错误的是( )A.32 g O2所含的原子数目为NAB.0.5 mol H2O含有的原子数目为1.5NAC.1 mol H2O含有的H2O分子数目为NAD.0.5NA个氯气分子的物质的量是0.5 mol答案:A解析:32 g O2为1 mol,氧原子数为2NA,A错误;0.5 mol H2O中原子数为0.5×3×NA,B正确;1 mol H2O中含有H2O分子数为NA,C正确;0.5NA个Cl2分子的物质的量为0.5 mol,D正确。状元随笔 (1)表述微观粒子的物质的量时,必须指明微观粒子的种类,例如:1 mol H、1 mol H2或1 mol H+都正确;但1 mol氢因为未指明微观粒子种类而错误。(2)物质的量只能用来表示微观粒子的多少,不能用来表示宏观物质的多少。关键能力物质的摩尔质量、1 mol物质的质量、相对分子(或原子)质量的比较目标2 “n、m、N”之间的计算例2 下列说法正确的是( )A.16 g O2所含的分子数为6.02×1023个B.0.5 mol H2SO4含有的原子数为3.5NAC.18 g H2O中质子的物质的量为1 molD.22 g物质A中含有的分子数为3.01×1023,则A的摩尔质量为44 g带单位计算是解题的规范要求。答案:B [提升2] 147 g H2SO4的物质的量是________;0.5 mol H2SO4的质量是_____g,其中含有_____mol H,含有____mol O;2 mol H2SO4中含有H2SO4分子数为___________个,含氢原子数为___________个。1.5 mol49121.204×10242.408×1024 关键能力物质的量、物质的质量、粒子数目之间的计算关系通过计算,准确理解“阿伏加德罗常数”把微观物理量和宏观物理量联系起来的“桥梁”作用。学考评价1.[2022·郑州高一检测]摩尔起源于希腊文mole,原意为“堆量”,是在1971年10月,由41个国家参加的第14届国际计量大会上决定增加的国际单位制(SI)的第七个基本单位。下列关于“摩尔”的理解正确的是( )A.摩尔是国际科学界建议采用的一种物理量B.摩尔是物质的量的单位,简称摩,符号为molC.我们把含有6.02×1023个粒子的任何粒子的集合体计量为1摩尔D.1 mol氧含6.02×1023个O2答案:B解析:摩尔只是物质的量这一物理量的单位,不是一种物理量;含6.02×1023个粒子的集合体不一定计量为1摩尔,如含6.02×1023个氧原子的O2的物质的量是0.5 mol;1 mol氧含义不明确,应说1 mol O2含6.02×1023个氧分子。2.下列说法中正确的是( )A.摩尔是国际单位制中的七个基本物理量之一B.0.5 mol H2O中含有的原子数目为1.5 NAC.64 g氧相当于2 mol氧D.1 mol任何物质都约含有6.02×1023个原子答案:B解析:A项:物质的量是国际单位制中的七个基本物理量之一,摩尔是物质的量的单位;C项:使用物质的量或摩尔时必须用化学式指明确定的粒子,“2 mol氧”这种说法中的氧未指明是氧原子、氧分子还是氧离子;D项:构成物质的粒子除了原子外,还有分子、离子等。3.下列说法中,正确的是( )A.1 mol氢约含有阿伏加德罗常数个氢B.1 mol CaCl2含有1 mol Cl-C.1 mol电子约含有6.02×1023个电子D.1 mol H2O含有1 mol H2和1 mol O答案:C解析:A项错误,未注明微粒的种类,氢是氢分子、氢原子还是氢离子不明确;B项错误,1 mol CaCl2应含有2 mol Cl-;D项错误,由初中化学可知H2O中无H2,正确的表述为1 mol H2O含有2 mol H和1 mol O。4.NA代表阿伏加德罗常数,下列说法正确的是( )A.含NA个H的H2的物质的量为1 molB.NA个CO和1 mol N2所含分子数相等C.NA个H2SO4与1 mol H3PO4所含氢原子的个数比为1∶1D.0.1 mol C含1.2NA个质子答案:B5.下列说法正确的是( )A.1 mol氢约含有6.02×1023个微粒B.H2的摩尔质量是2 gC.1 mol O2的质量是32 g,含有的氧原子数为2NAD.2NA个H2SO4的摩尔质量为196 g·mol-1答案:C解析:A项未指出1 mol氢具体是什么微粒,无法确定其个数,如1 mol H2含1 mol氢气分子,含 2 mol氢原子;B项摩尔质量的单位为g·mol-1;D项2NA个H2SO4的质量为196 g,但其摩尔质量仍然为98 g·mol-1。 表示SO2的物质的量2 mol表示一个SO2分子的质量1.06×10-22 g 表示SO2的物质的量2 mol表示一个SO2分子的质量1.06×10-22 g表示SO2的相对分子质量647.计算填空:(1)0.5 mol的Fe含________个铁原子(用6.02×1023表示阿伏加德罗常数的值),质量是____ g。(2)2 mol CO2中含____ mol碳原子,_____个氧原子(用NA表示阿伏加德罗常数的值),_____个质子(用NA表示阿伏加德罗常数的值),质量是____ g。(3)已知0.4 mol的CO和CO2的混合气体共14.4 g,则①CO的质量为______;②混合气体的平均摩尔质量为________。3.01×10232824NA44NA885.6 g36 g·mol-1 练后感悟 (1)物质的量是物质的质量和微粒数目之间计算的桥梁,已知物质的质量求其微粒数目或已知物质的微粒数目求其质量都是先转换成物质的量,再计算微粒数或质量。特别要注意微粒数目可能是分子,也可能是所含的原子、离子、电子等。解题时要审清题意。(2)高中化学计算主要是以物质的量为中心的计算,学习时要养成把“其他物理量转化为物质的量”这一思维模式。如已知物质的质量求其粒子数,首先根据摩尔质量求出其物质的量,然后根据阿伏加德罗常数转化为粒子数。
相关资料
更多









