

所属成套资源:人教版2019选择性必修1高二化学同步学习高效学讲练(原卷版+解析)
- 人教版2019选择性必修1高二化学同步学习高效学讲练2.1.1化学反应速率(精准练习)(原卷版+解析) 试卷 0 次下载
- 人教版2019选择性必修1高二化学同步学习高效学讲练2.1.2影响化学反应速率的因素活化能(精准练习)(原卷版+解析) 试卷 0 次下载
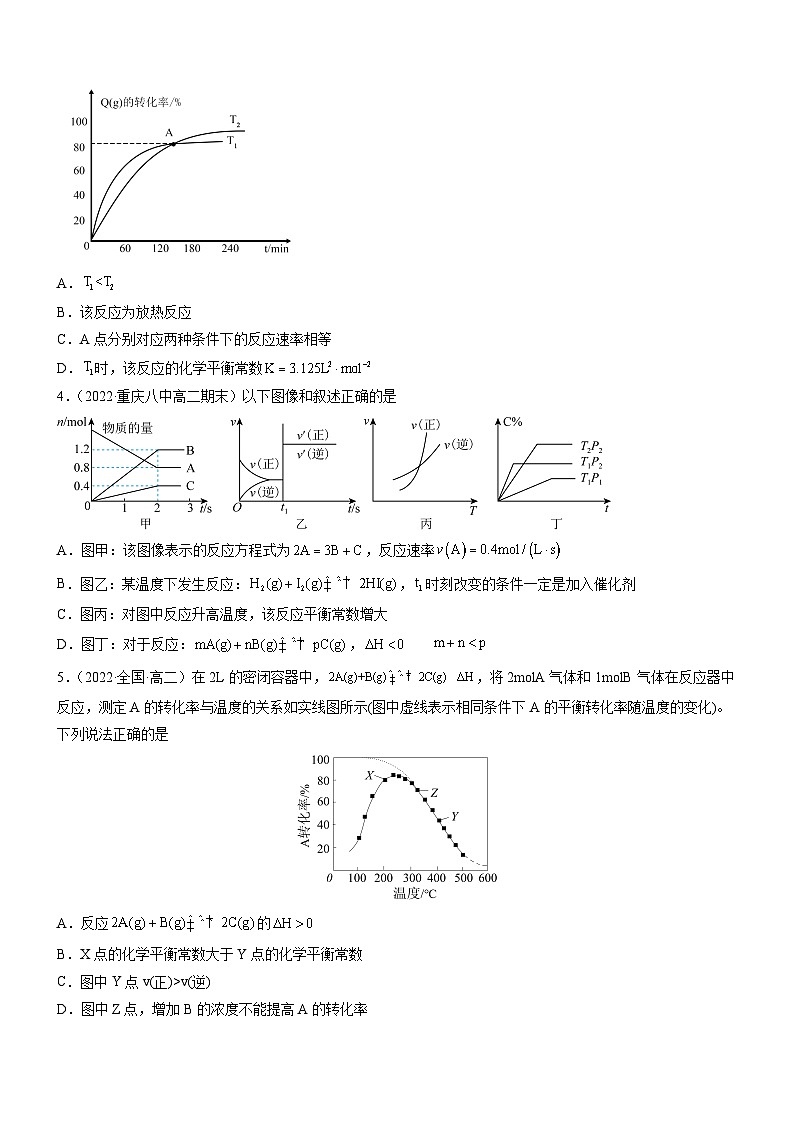
- 人教版2019选择性必修1高二化学同步学习高效学讲练2.2.1化学平衡状态化学平衡常数(精准练习)(原卷版+解析) 试卷 0 次下载
- 人教版2019选择性必修1高二化学同步学习高效学讲练2.2.2影响化学平衡的因素(精准练习)(原卷版+解析) 试卷 0 次下载
- 人教版2019选择性必修1高二化学同步学习高效学讲练2.3化学反应的方向(精准练习)(原卷版+解析) 试卷 0 次下载
高中第二章 化学反应速率与化学平衡第一节 化学反应速率同步测试题
展开
这是一份高中第二章 化学反应速率与化学平衡第一节 化学反应速率同步测试题,共30页。试卷主要包含了在容积不变的密闭容器中存在,常温下,A、B初始浓度为2 ,以下图像和叙述正确的是,根据图示所得出的结论正确的是等内容,欢迎下载使用。
第二节 化学平衡
第3课时 化学反应速率与平衡图像专题
1.(2021·福建·福州黎明中学高二期中)在容积不变的密闭容器中存在: 3H2(g) +3CO(g) =CH3OCH3(g) +CO2(g) ΔHv(逆)
D.图中Z点,增加B的浓度不能提高A的转化率
6.(2022·江西·横峰中学高二期末)根据图示所得出的结论正确的是
A.图1若表示的是可逆反应 的化学反应速率(v)与时间(t)的关系,则时改变的条件可能是升高了温度或增大了压强。
B.图2表示相同pH的盐酸和醋酸加水稀释过程中pH的变化,则曲线a代表醋酸
C.图3是某温度时,在水中的沉淀溶解平衡曲线,则升温可使溶液由b点变为d点
D.图4是对于可逆反应的速率与温度变化的关系,则该反应的
7.(2022·河南新乡·高二期末)向一恒温恒容密闭容器中充入1mlA和3mlB发生反应 ,正反应速率随时间的变化如图所示。下列说法错误的是
A.当时,表明反应已达到平衡状态
B.A的平衡转化率:
C.时改变的条件是向容器中加入C
D.若在后充入氦气,化学平衡不移动
8.(2022·云南昆明·高二期末)已知 ,向一恒容密闭容器中充入2 ml A发生反应,t1时达到平衡状态Ⅰ,在t2时改变某一条件t3时重新达到平衡状态Ⅱ,逆反应速率随时间的变化如图所示。下列说法正确的是
A.容器内气体密度不再变化,表明反应达到平衡
B.加入催化剂,可提高A的平衡转化率
C.t2时改变的条件是增大A的物质的量浓度
D.平衡常数K:Ⅰ0
B.在T2时SO2的平衡转化率为80%
C.加入适当的催化剂,目的是加快反应速率,提高SO3的产率
D.T1时的化学平衡常数K1大于T2时的平衡常数K2
13.(2022·安徽·歙县教研室高二期末)T℃时,在2L刚性密闭容器中使X(g)与Y(g)发生反应生成Z(g)。反应过程中X、Y、Z的浓度变化如图1所示;若保持其他条件不变,温度分别为T1和T2时,Y的体积百分含量与时间的关系如图2所示。则下列结论错误的是
A.容器中发生的反应可表示为3X(g)+Y(g)2Z(g)
B.保持其他条件不变,升高温度,X的转化率增大
C.反应进行的前3min内,用X表示的反应速率v(X)=0.2ml·L-1·min-1
D.若改变反应条件,使反应进程如图3所示,则改变的条件是使用催化剂
14.(2021·广东·珠海市第一中学高二期中)现有下列四个图象:
下列反应中符合上述全部图象的是
A.
B.
C.
D.
15.(2021·安徽·合肥市第六中学高二期中)(g)+ (g)(g)+HCl(g)是制备酯类物质的重要有机反应,下列对相关图像做出的判断正确的是
16.(2021·辽宁·东北育才学校高二期中)已知:,向一恒温恒容的密闭容器中充入和发生反应,时达到平衡状态1,在时改变某一条件,时重新达到平衡状态Ⅱ,正反应速率随时间的变化如图所示。下列说法正确的是
A.容器内压强不变,表明反应达到平衡
B.时改变的条件:向容器中加入A
C.平衡时A的体积分数:
D.平衡常数:
17.(2021·内蒙古·阿拉善盟第一中学高二阶段练习)一定条件下,在密闭容器中发生反应4NH3(g)+6NO(g)5N2(g)+6H2O(g) △H<0,并建立平衡,在t1和t3时分别改变一个条件,在t2和t4时反应达到新的平衡状态。图1是正反应速率随时间变化的图像,图2是NO的浓度随时间变化的图像,下列说法错误的是
A.t1时改变的条件是减小生成物浓度
B.t3时正、逆反应速率均增大
C.t3时改变的条件可能是加压或者升温
D.t4时的平衡常数小于t1时的平衡常数
18.(2021·云南·丽江第一高级中学高二期中)合成氨反应:N2(g)+3H2(g)2NH3(g) ΔH=-92.4 kJ·ml-1,在反应过程中,正反应速率的变化如图所示,下列说法正确的是
A.t1增大压强B.t2时升高温度
C.t3时降低了温度D.t4时减小了压强
19.(2021·江西·高二阶段练习)Ⅰ.在一定温度下将2 ml A和2 ml B两种气体混合于2 L密闭容器中,发生如下反应:3A(g)+B(g)2C(g)+2D(g),2分钟末反应达到平衡状态,生成了0.8 ml D,请填写下列空白。
(1)用B表示的平均反应速率为_______,A的转化率为_______。
(2)若向原平衡体系再投入1 mlA和1 ml B,B的转化率_______(填“增大、减少或不变”)。
Ⅱ.氢气是合成氨的重要原料,合成氨反应的热化方程式如下:N2(g)+3H2(g)2NH3(g);ΔH=-92.4 kJ/ml。
(3)当合成氨反应达到平衡后,改变某一外界条件(不改变N2、H2和NH3的量),反应速率与时间的关系如下图所示。图中t1时引起平衡移动的条件可能是_______,图中t3时引起平衡移动的条件可能是_______。
(4)温度为T ℃时,将2 a ml H2和a ml N2放入0.5 L密闭容器中,充分反应后测得N2的转化率为50%。则反应的平衡常数为_______。
20.(2022·广西南宁·高二期末)甲醇是一种重要的化工原料,具有开发和应用的广阔前景。工业上使用水煤气(CO与H2的混合气体)转化成甲醇,反应为CO(g)+2H2(g)⇌CH3OH(g)。
(1)CO的平衡转化率与温度、压强的关系如图所示。
①p1、p2的大小关系是p1_______p2(填“>”“α(II),B项错误;
C.由图可知,t1时达到平衡状态Ⅰ,在t2时改变某一条件,瞬间正反应速率不变,然后增大,可知改变的条件是加入生成物,则t2时改变的条件是向容器中加入C,C项正确;
D.若在t3min后充入氦气,各物质的浓度不变,化学平衡不移动,D项正确;
答案选B。
8.(2022·云南昆明·高二期末)已知 ,向一恒容密闭容器中充入2 ml A发生反应,t1时达到平衡状态Ⅰ,在t2时改变某一条件t3时重新达到平衡状态Ⅱ,逆反应速率随时间的变化如图所示。下列说法正确的是
A.容器内气体密度不再变化,表明反应达到平衡
B.加入催化剂,可提高A的平衡转化率
C.t2时改变的条件是增大A的物质的量浓度
D.平衡常数K:Ⅰ0
B.在T2时SO2的平衡转化率为80%
C.加入适当的催化剂,目的是加快反应速率,提高SO3的产率
D.T1时的化学平衡常数K1大于T2时的平衡常数K2
【答案】D
【详解】A.由图可知,T2先达到平衡,T1<T2,且温度高对应SO3的体积分数小,可知升高温度平衡逆向移动,则正反应为放热反应,反应的ΔH<0,故A错误;
B.设转化的SO2为xml,则根据方程式可知,解得x=,SO2的平衡转化率为×100%≈85.7%,故B错误;
C.催化剂可加快反应速率,不影响平衡移动,则入适当的催化剂,目的是加快反应速率,但SO3的产率不变,故C错误;
D.K与温度有关,且升高温度平衡逆向移动,则T1时的化学平衡常数K1大于T2时的平衡常数K2,故D正确;
故选D。
13.(2022·安徽·歙县教研室高二期末)T℃时,在2L刚性密闭容器中使X(g)与Y(g)发生反应生成Z(g)。反应过程中X、Y、Z的浓度变化如图1所示;若保持其他条件不变,温度分别为T1和T2时,Y的体积百分含量与时间的关系如图2所示。则下列结论错误的是
A.容器中发生的反应可表示为3X(g)+Y(g)2Z(g)
B.保持其他条件不变,升高温度,X的转化率增大
C.反应进行的前3min内,用X表示的反应速率v(X)=0.2ml·L-1·min-1
D.若改变反应条件,使反应进程如图3所示,则改变的条件是使用催化剂
【答案】C
【详解】A.3min达平衡时,X、Y、Z的物质的量的变化量分别为0.6ml、0.2ml、0.4ml,则化学计量数之比为3:1:2,3min后各物质的量不变,则反应达平衡状态,所以容器中发生的反应可表示为3X(g)+Y(g)2Z(g),A正确;
B.由图2知,T2先达平衡,则T2>T1,温度升高,Y的百分含量减小,则平衡右移,正反应为吸热反应,保持其他条件不变,升高温度,X的转化率增大,B正确;
C.反应进行的前3min内,用X表示的反应速率v(X)==0.1ml·L-1·min-1,C错误;
D.从图3可以看出,X、Y、Z的物质的量变化量与图1相同,只是达平衡的时间短,则表明反应速率快,但平衡不发生移动,所以改变的条件是使用催化剂,D正确;
故选C。
14.(2021·广东·珠海市第一中学高二期中)现有下列四个图象:
下列反应中符合上述全部图象的是
A.
B.
C.
D.
【答案】B
【详解】A.反应中化学计量数1+3>2,ΔH4+5,但ΔH>0,该反应为吸热反应,但是由图可知,该反应为放热反应,与图不符,C错误;
D.反应中化学计量数1+1>1,加压后平衡正向移动,但是由图可知加压后逆向移动,与图不符,D错误;
故选B。
15.(2021·安徽·合肥市第六中学高二期中)(g)+ (g)(g)+HCl(g)是制备酯类物质的重要有机反应,下列对相关图像做出的判断正确的是
【答案】D
【详解】A.由图可知,正反应为放热反应,升高温度平衡逆向移动,A错误;
B.增大反应物浓度,瞬间正反应速率增大、逆反应速率不变,而图中t1时正逆反应速率均增大,B错误;
C.速率之比等于化学计量数之比,则0~5min内,的平均反速率为=0.3ml·L-1·min-1,C错误;
D.由A可知,正反应为放热反应,升温平衡逆向移动,平衡常数与温度有关,升温K值会减小,符合图像,D正确;
故选 D。
16.(2021·辽宁·东北育才学校高二期中)已知:,向一恒温恒容的密闭容器中充入和发生反应,时达到平衡状态1,在时改变某一条件,时重新达到平衡状态Ⅱ,正反应速率随时间的变化如图所示。下列说法正确的是
A.容器内压强不变,表明反应达到平衡
B.时改变的条件:向容器中加入A
C.平衡时A的体积分数:
D.平衡常数:
【答案】C
【详解】A.根据反应可知,该反应前后气体的物质的量保持不变,恒容密闭容器气体压强始终保持不变,故容器内压强不变,不能说明反应达到平衡,A错误;
B.由图像可知,时改变的条件后正反应速率没有发生突然增大,而是逐渐增大,故改变的条件是增大了生成物的浓度,故不是向容器中加入A而是C,B错误;
C.由B项分析可知,t2时刻改变的条件是增大生成物浓度,化学平衡逆向移动,故平衡时A的体积分数:,C正确;
D.化学平衡常数仅仅是温度的函数,且t2时刻并未改变温度,故平衡常数:,D错误;
故答案为:C。
17.(2021·内蒙古·阿拉善盟第一中学高二阶段练习)一定条件下,在密闭容器中发生反应4NH3(g)+6NO(g)5N2(g)+6H2O(g) △H<0,并建立平衡,在t1和t3时分别改变一个条件,在t2和t4时反应达到新的平衡状态。图1是正反应速率随时间变化的图像,图2是NO的浓度随时间变化的图像,下列说法错误的是
A.t1时改变的条件是减小生成物浓度
B.t3时正、逆反应速率均增大
C.t3时改变的条件可能是加压或者升温
D.t4时的平衡常数小于t1时的平衡常数
【答案】C
【详解】A.由图1可知,t1改变条件时,正反应速率在原来基础上逐渐减小;由图2可知,t1改变条件时,NO的浓度在原来基础上逐渐减小,说明改变条件后平衡正向移动,只有减小生成物浓度才能与两个图像的变化情况吻合,A正确;
B.由图1可知,t3改变条件时,正反应速率在原来基础上突增,由图2可知,NO的浓度在原来基础上逐渐增大,即化学平衡逆向移动,说明t3改变条件时,逆反应速率大于正反应速率,即逆反应速率在原来基础上也是突增的,B正确;
C.由上分析可知,t3改变条件时正、逆反应速率均突增,但由图2可知,NO的浓度在原来基础上是逐渐增大的,因此所改变的条件只能是升温而不是加压,C错误;
D.由上述分析可知,t4时的温度高于t3时的,t3时的温度等于t1时的,因此t4时的温度高于t1时的温度,升温平衡逆向移动,平衡常数减小,D正确;
故合理选项是C。
18.(2021·云南·丽江第一高级中学高二期中)合成氨反应:N2(g)+3H2(g)2NH3(g) ΔH=-92.4 kJ·ml-1,在反应过程中,正反应速率的变化如图所示,下列说法正确的是
A.t1增大压强B.t2时升高温度
C.t3时降低了温度D.t4时减小了压强
【答案】A
【分析】由合成氨反应可知,该反应为气体分子数减小的放热反应,根据反应特点结合影响化学反应速率的因素分析图像,作出判断。
【详解】A.t1时正先增大后逐渐减小,说明平衡向正向移动,根据正反应为气体分子数减小的反应可知,增大压强平衡正向移动,故t1时可能是增大压强,故A正确;
B.t2时正、逆反应速率同等程度增大,可能是使用了催化剂,若是升高温度,正、逆反应速率都增大,但逆反应速率增大的倍数更大,平衡逆向移动,故B错误;
C.t3时正先减小后逐渐增大,说明平衡向逆向移动,根据ΔH ”“
相关试卷
这是一份人教版 (2019)选择性必修1第一节 化学反应速率同步测试题,共24页。试卷主要包含了决定化学反应速率的最主要因素是,下列说法正确的是,密闭容器中发生反应等内容,欢迎下载使用。
这是一份化学选择性必修1第一节 化学反应速率同步达标检测题,共19页。
这是一份人教版 (2019)选择性必修1第一节 反应热精练,共19页。试卷主要包含了下列反应属于吸热反应的是,下列有关反应热的说法不正确的是,下列说法不正确的是,下列说法正确的是等内容,欢迎下载使用。










