




备战2025届新高考化学一轮总复习第2章物质的量第7讲物质的量浓度及溶液配制课件
展开1.了解物质的量浓度的含义,运用物质的量浓度进行简单计算。2.认识容量瓶,初步学会配制一定物质的量浓度溶液的方法和技能。3.通过对一定物质的量浓度溶液的配制实验细节的分析,发展定量研究的意识。
考点一 物质的量浓度及计算
考点二 一定物质的量浓度溶液的配制及误差分析
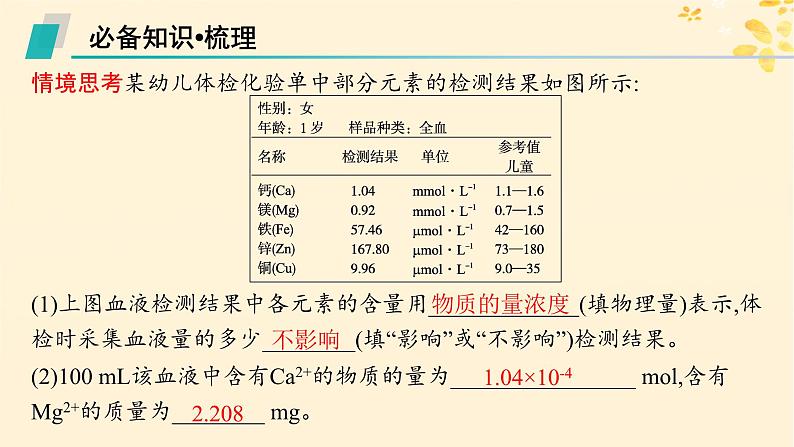
情境思考某幼儿体检化验单中部分元素的检测结果如图所示:
(1)上图血液检测结果中各元素的含量用_____________(填物理量)表示,体检时采集血液量的多少________(填“影响”或“不影响”)检测结果。 (2)100 mL该血液中含有Ca2+的物质的量为________________ ml,含有Mg2+的质量为________ mg。
1.物质的量浓度(cB)(从微观角度认识溶液的组成)
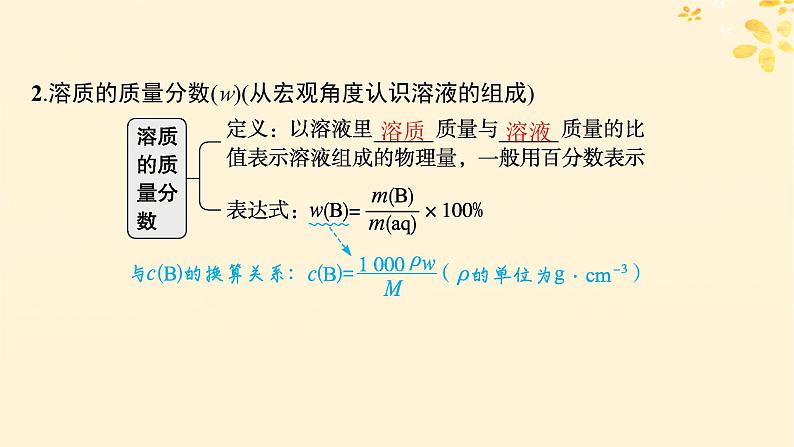
2.溶质的质量分数(w)(从宏观角度认识溶液的组成)
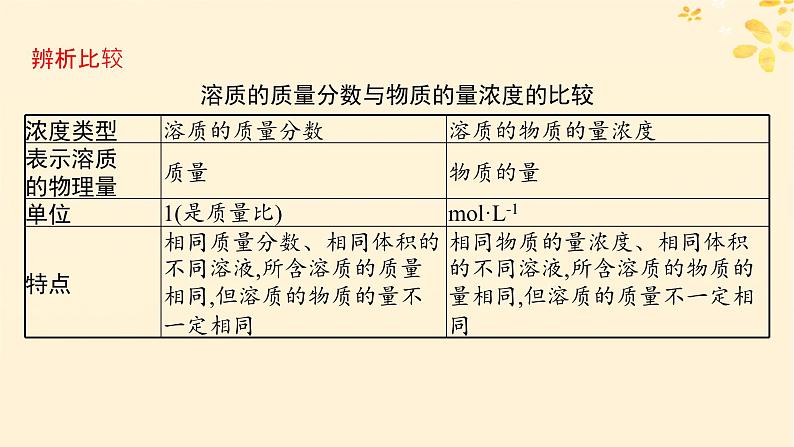
辨析比较溶质的质量分数与物质的量浓度的比较
[对点训练1] 现有V mL硫酸钠溶液,其密度为ρ g·mL-1,其中钠离子的质量分数为2a%,有关该溶液的说法不正确的是( )
考向2 溶液的稀释与混合例2在0.1 L由NaCl、MgCl2、BaCl2组成的混合溶液中,部分离子浓度大小如图所示,下列对该溶液成分说法不正确的是( )
A.该混合溶液中NaCl的物质的量为0.1 mlB.该混合溶液中MgCl2的质量为4.75 gC.若将该溶液与0.1 L 0.5 ml·L-1 AlCl3溶液混合,所得混合溶液中c(Cl-)= 2.25 ml·L-1(忽略混合时溶液体积的变化)D.将该混合溶液加水稀释至体积为1 L,稀释后溶液中Na+的物质的量浓度为0.5 ml·L-1
[对点训练2] 现有两种硫酸溶液,其中一种物质的量浓度为c1 ml·L-1、密度为ρ1 g·cm-3,另一种物质的量浓度为c2 ml·L-1、密度为ρ2 g·cm-3,当它们等体积混合后,溶液的密度为ρ3 g·cm-3,则混合溶液的物质的量浓度(单位: ml·L-1)为( )
1.容量瓶的构造及使用(1)构造及用途
2.配制一定物质的量浓度的溶液(以配制1 000 mL 1.0 ml·L-1 NaCl溶液为例)(1)主要仪器天平、药匙、量筒、烧杯、__________________、玻璃棒、___________等。 (2)配制过程
1 000 mL容量瓶
3.一定物质的量浓度溶液配制的误差分析误差分析中变量是m和V,一般情况要固定其一,分析另一物理量的变化对溶液浓度的影响:
【应用示例】配制一定物质的量浓度的溶液是一个重要的定量实验,判断下列说法的正误。(1)容量瓶用蒸馏水洗净后,可直接用于配制溶液。( )(2)配制一定物质的量浓度的稀硫酸时,用量筒量取9.82 mL浓硫酸。( )(3)定容时,俯视容量瓶中液体的凹液面,所配溶液的浓度偏大。( )(4)定容时,加水超过了刻度线,立刻用胶头滴管吸去多余的水,所配溶液的浓度不变。( )
考向1 配制一定物质的量浓度溶液的规范操作例1下图是某同学用500 mL容量瓶配制0.10 ml·L-1 NaOH溶液的过程:
下列关于该实验的叙述正确的是( )A.如图所示,用托盘直接称量2.0 g烧碱B.配制的正确顺序为①④③②⑤⑥C.②中定容时仰视刻度线会导致溶液浓度偏小D.能用容量瓶贮存配制好的溶液
解析 氢氧化钠固体易潮解,且有腐蚀性,一般放在烧杯中称取氢氧化钠,而不能直接用托盘称量,A错误;配制一定物质的量浓度的溶液的步骤为:计算、称量、溶解、冷却、转移、洗涤、定容、摇匀、装瓶,故配制的正确顺序为①④③⑤②⑥,B错误;定容时仰视刻度线会导致溶液的体积偏大,所配溶液浓度偏小,C正确;容量瓶只能用于配制溶液,不能用于贮存配制好的溶液,D错误。
[对点训练1] 实验室用氢氧化钠固体配制1.00 ml·L-1的NaOH溶液480 mL,以下配制步骤及分析正确的是( )A.用烧杯在托盘天平上称取19.2 g NaOH固体,加蒸馏水溶解B.待溶液冷却后,将烧杯中的溶液沿玻璃棒转移到容量瓶中,并洗涤烧杯和玻璃棒2~3次,将洗涤液移至容量瓶中C.定容时仰视刻度线D.定容后塞上瓶塞、振荡、摇匀、静置后,液面低于刻度线,再加水至刻度线
解析 实验室无480 mL的容量瓶,应选择500 mL的容量瓶,配制500 mL溶液所需氢氧化钠的质量为1.00 ml·L-1×0.5 L×40 g·ml-1=20.0 g,A错误;氢氧化钠固体溶于水放热,因此应冷却至室温,移液时应用玻璃棒引流,否则溶液溅出会导致浓度偏低,并洗涤烧杯及玻璃棒2~3次,将洗涤液全部转移至容量瓶中,避免溶质损失,B正确;定容时,应平视刻度线,C错误;定容后塞上瓶塞反复摇匀,静置后,液面低于刻度线是正常的,再加水至刻度线,会导致溶液浓度偏低,D错误。
考向2 一定物质的量浓度溶液配制的误差分析例2下列有关配制溶液的操作及其误差分析,不正确的是( )A.定容时仰视容量瓶瓶颈刻度线,使所配溶液浓度偏小B.定容时液面超过刻度线,用胶头滴管吸出部分液体,使所配溶液浓度偏大C.将烧杯内的溶液转移至容量瓶时,未洗涤烧杯,使所配溶液浓度偏小D.容量瓶使用前瓶底有少量水,未干燥就开始配制溶液,对所配溶液浓度没有影响
解析 定容时仰视容量瓶瓶颈刻度线,使所得溶液体积偏大,则使所配溶液浓度偏小,A正确;定容时液面超过刻度线,用胶头滴管吸出部分液体,溶质减少,所以使所配溶液浓度偏小,B错误;将烧杯内的溶液转移至容量瓶时,未洗涤烧杯,使得溶液中的溶质的物质的量偏小,则所配溶液浓度偏小,C正确;容量瓶使用前瓶底有少量水,未干燥就开始配制溶液,对所配溶液浓度没有影响,D正确。
[对点训练2] 欲配制100 mL 1.0 ml·L-1 Na2SO4溶液,下列操作会使配制的溶液浓度偏小的是( )A.容量瓶中原有少量蒸馏水B.定容时,俯视容量瓶上的刻度线C.称量Na2SO4固体时,药品和砝码的位置放反了(1 g以下用游码)D.将32.2 g Na2SO4·10H2O溶于少量水中,再配制成100 mL溶液
进阶1 练易错·避陷阱1.质量分数和物质的量浓度是表示溶液组成的两个常用的物理量,下列说法正确的是( )A.质量分数为98%的浓硫酸和等质量的水混合后,硫酸的质量分数大于49%B.配制250 mL 1.0 ml·L-1 H2SO4溶液,需要量取18 ml·L-1 H2SO4溶液的体积为13.9 mLC.从1 L 0.15 ml·L-1 Na2SO4溶液中取出100 mL,取出溶液中Na2SO4的物质的量浓度为0.015 ml·L-1D.50 mL 0.1 ml·L-1 NaCl溶液和25 mL 0.1 ml·L-1 MgCl2溶液中的Cl-浓度相同
2.实验室用已经称量好的NaClO固体配制500 mL 4 ml·L-1 NaClO消毒液,下列说法正确的是( )
A.如图所示的仪器中,有5种是不需要的B.容量瓶用蒸馏水洗净后,应烘干后才能用于配制溶液C.用放置时间较长的NaClO来配制溶液,可能导致所配溶液浓度偏大D.定容时,仰视容量瓶刻度线,会导致所配溶液浓度偏大
解析 用已经称量好的NaClO固体配制500 mL 4 ml·L-1 NaClO消毒液,不需要的仪器有圆底烧瓶、酸式滴定管、碱式滴定管、分液漏斗、托盘天平共5种,A正确;容量瓶不需要烘干就能用于配制溶液,B错误;NaClO易吸收空气中的H2O、CO2而变质,NaClO可能部分变质导致NaClO减少,故溶液的浓度偏小,C错误;定容时,仰视容量瓶刻度线,会导致溶液体积偏大,从而导致所配溶液浓度偏小,D错误。
4.某实验室需要1.0 ml·L-1的碳酸钠溶液450 mL,利用碳酸钠晶体(Na2CO3·10H2O)来配制该溶液。下列说法正确的是( )A.应该用托盘天平称取该碳酸钠晶体128.7 gB.容量瓶用蒸馏水洗净后,可不经干燥直接用于配制溶液C.应该用托盘天平称取该碳酸钠晶体143.00 gD.定容、摇匀、静置后发现液面低于刻度线,应再补加少量水至刻度线
解析 需用500 mL容量瓶配制该溶液,则需要碳酸钠晶体的质量为1.0 ml·L-1×0.5 L×286 g·ml-1=143.0 g,A错误;容量瓶用蒸馏水洗净后,可不经干燥直接用于配制溶液,B正确;托盘天平的精确度为0.1 g,应用托盘天平称取该碳酸钠晶体143.0 g,C错误;定容、摇匀、静置后发现液面低于刻度线,若补加少量水至刻度线,将导致溶液的体积偏大,溶液浓度偏小,D错误。
进阶3 研真题·明考向5.(2023·全国甲卷)实验室将粗盐提纯并配制0.100 0 ml·L-1的NaCl溶液。下列仪器中,本实验必须用到的有( )①天平 ②温度计 ③坩埚 ④分液漏斗 ⑤容量瓶 ⑥烧杯 ⑦滴定管 ⑧酒精灯A.①②④⑥B.①④⑤⑥C.②③⑦⑧D.①⑤⑥⑧
解析 粗盐提纯过程中涉及的实验操作包括溶解、过滤、蒸发和结晶,题给仪器中所用到的有⑥⑧;由固体NaCl配制0.100 0 ml·L-1的NaCl溶液,题给仪器中所用到的有①⑤⑥。
6.(2022·广东卷,17节选)食醋是烹饪美食的调味品,有效成分主要为醋酸(用HAc表示)。HAc的应用与其电离平衡密切相关。(1)配制250 mL 0.1 ml·L-1的HAc溶液,需5 ml·L-1 HAc溶液的体积为_______________ mL。 (2)下列关于250 mL容量瓶的操作,正确的是_______________。
新教材适用2024版高考化学一轮总复习第2章物质的量及其应用第5讲物质的量浓度及其溶液的配制课件: 这是一份新教材适用2024版高考化学一轮总复习第2章物质的量及其应用第5讲物质的量浓度及其溶液的配制课件,共60页。PPT课件主要包含了考点一,考点二,必备知识·梳理夯实,物质的量,mol·L-1,2溶质的质量分数,18mol,归纳拓展,②查漏操作,胶头滴管等内容,欢迎下载使用。
新教材高考化学总复习专题一化学计量第2讲物质的量浓度及一定物质的量浓度溶液的配制课件: 这是一份新教材高考化学总复习专题一化学计量第2讲物质的量浓度及一定物质的量浓度溶液的配制课件,共56页。
新高考高考化学总复习专题一化学计量第2讲物质的量浓度及其溶液配制课件: 这是一份新高考高考化学总复习专题一化学计量第2讲物质的量浓度及其溶液配制课件,共60页。












