





- 第1讲 物质的量 气体摩尔体积课件PPT 课件 0 次下载
- 第1讲 物质的量 气体摩尔体积学案 学案 0 次下载
- 第2讲 物质的量浓度及一定物质的量浓度溶液的配制学案 学案 0 次下载
- 微专题1 阿伏加德罗常数的判断学案 学案 0 次下载
- 第2讲 离子反应课件PPT 课件 0 次下载
第2讲 物质的量浓度及一定物质的量浓度溶液的配制课件PPT
展开一、溶液组成的两种表示方法
思考1 从一瓶500 mL 0.4 ml·L-1的NaCl溶液中取出10 mL溶液,其浓度是多 少?其中含有NaCl的物质的量为多少?
提示 0.4 ml·L-1,0.004 ml
2.溶质的质量分数(1)概念:用溶质的质量与溶液质量的比值来表示溶液组成的物理量,符号为ω, 一般用百分数表示。(2)表达式:ω= ×100%。(3)饱和溶液中溶质的质量分数用溶解度S表示:ω= ×100%。
思考2 将80 g SO3溶于120 mL水中所得溶液的溶质质量分数为多少?
提示 49%。80 g SO3溶于水,与水反应生成98 g硫酸,溶液质量为200 g,所以 得到的硫酸溶液的溶质质量分数为49%。
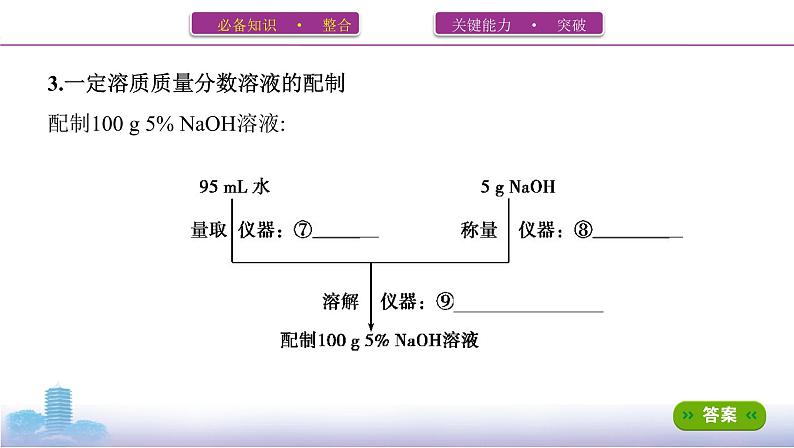
3.一定溶质质量分数溶液的配制配制100 g 5% NaOH溶液:
二、一定物质的量浓度溶液的配制
1.主要仪器(1)托盘天平称量前先调零,称量时药品放在⑩ 左盘 ,砝码放在 右盘 ,读数精确到 0.1 g。(2)容量瓶a.构造及用途:
(3)其他仪器:量筒、烧杯、玻璃棒、 胶头滴管 等。
思考3 在50 mL量筒中可以配制0.100 0 ml·L-1碳酸钠溶液吗?为什么?
提示 不可以。量筒只能用来量取液体,不能用来进行溶液的配制。
2.配制过程以配制500 mL 1.00 ml·L-1NaOH溶液为例。(1)配制步骤
思考4 在溶液的配制过程中,有3次用到玻璃棒,作用分别是什么?
提示 第1次是溶解氢氧化钠,搅拌,加速溶解;第2次是向容量瓶中移液,引流; 第3次是将洗涤液转入容量瓶,玻璃棒的作用也是引流。
1.易错易混辨析(正确的画“√”,错误的画“✕”)(1)从100 mL 5 ml·L-1H2SO4溶液中取出了20 mL,所得硫酸的物质的量浓度为 1 ml·L-1 ( )(2)将62 g Na2O溶于水中,配成1 L溶液,所得溶质的物质的量浓度为1 ml·L-1 ( )(3)将10 g CaCO3粉末加入水中配成100 mL溶液,所得溶液的浓度为1 ml·L-1 ( )(4)将0.5 ml·L-1的NaCl溶液100 mL蒸发掉50 g水,所得溶液的浓度为1 ml·L-1 ( )
(5)将20 mL 2 ml·L-1NaCl溶液与20 mL水混合,所得的溶液浓度为1 ml·L-1 ( )(6)NaOH固体放入小烧杯中,然后加入蒸馏水,为防止氢氧化钠溶液与空气中 的CO2反应,溶解后应立即转移到容量瓶中 ( )(7)配制2 ml·L-1Na2CO3溶液950 mL时,应选1 000 mL容量瓶,称取Na2CO3·10H2O 572.0 g ( )(8)配制0.100 0 ml·L-1氯化钠溶液时,两次用玻璃棒的作用相同 ( )(9)用容量瓶配制溶液,定容时俯视刻度线,所配溶液浓度偏小 ( )(10)用量筒量取20 mL 0.500 0 ml·L-1H2SO4溶液于烧杯中,加水80 mL,配制成0.100 0 ml·L-1 H2SO4溶液 ( )
2.用固体样品配制一定物质的量浓度的溶液,需经过称量、溶解、转移、定 容等操作。下列图示对应的操作规范的是 ( )
3.下列关于2 ml·L-1 Ba(NO3)2溶液的说法正确的是 ( )A.100 mL溶液中N 的浓度是0.4 ml·L-1B.500 mL溶液中N 的物质的量是4 mlC.500 mL溶液中含有Ba2+的质量是137 gD.100 mL溶液中所含Ba2+、N 总数为0.4NA
解析 硝酸根离子的浓度是硝酸钡的2倍,则100 mL溶液中N 的浓度是4 ml·L-1,A错误;500 mL溶液中N 的物质的量是0.5 L×4 ml·L-1=2 ml,B错误;500 mL溶液中含有Ba2+的质量是0.5 L×2 ml·L-1×137 g·ml-1=137 g,C正确; 100 mL溶液中所含硝酸钡的物质的量是0.2 ml,因此Ba2+、N 总数为0.6NA,D错误。
4.将24.4 g NaOH固体溶于水配成100 mL溶液,其密度为1.219 g·mL-1。(1)该溶液中NaOH的物质的量浓度为 6.1 ml·L-1 。(2)该溶液中NaOH的质量分数为 20% 。(3)从该溶液中取出10 mL,含NaOH的质量为 2.44 g ,含NaOH的物质的量 为 0.061 ml 。(4)将取出的10 mL溶液加水稀释到100 mL,稀释后溶液中NaOH的物质的量 浓度为 0.61 ml·L-1 。
解析 24.4 g NaOH的物质的量为 =0.61 ml,溶液质量为100 mL×1.219 g·mL-1=121.9 g。(1)该溶液中NaOH的物质的量浓度为 =6.1 ml·L-1。(2)该溶液中NaOH的质量分数为 ×100%≈20%。(3)溶液是均匀的,取出10 mL,溶液中氢氧化钠的质量、物质的量为原溶液的 ,分别为2.44g、0.061 ml。(4)取出的10 mL溶液加水稀释到100 mL,稀释后溶液中 NaOH的物质的量浓度为 =0.61 ml·L-1。
考点一 溶液的浓度及相关计算
1.计算方法(1)利用公式直接计算:c= 。(2)利用溶质的质量分数计算。c为溶质的物质的量浓度,单位:ml·L-1,ρ为溶液密度,单位:g·cm-3,ω为溶质的质 量分数,M为溶质的摩尔质量,单位:g·ml-1,则c= = = = 。(3)电荷守恒:一般用于离子浓度的计算,如Na2SO4溶液中存在c(Na+)=2c(S )。
2.有关物质的量浓度计算的常见类型(1)标准状况下气体溶质溶于水所得溶液浓度的计算 c= (2)溶液稀释、同种溶质的溶液混合的计算
例1 标准状况下V L氨气溶解在1 L水中(水的密度近似为1 g·mL-1),所得溶液 的密度为ρ g·mL-1,质量分数为ω,物质的量浓度为c ml·L-1,则下列关系中不正 确的是 ( )A.ρ= B.ω= C.ω= D.c=
解析 由c= 可推出B项正确。m(NH3)= ml×17 g·ml-1= g,m(溶液)=m(NH3)+m(水)=( +1 000)g,ω= = ÷( +1 000)= ,C项正确。把C项代入c= ,得c= ,D项正确。A项中,把式子变形得ρ= ,显然,是把溶液的体积按(1+V)L来计算的,所以错误。
易错提醒 物质的量浓度中的体积是指溶液的体积,而不是指溶剂的体积,不 能用水的体积代替,若两溶液混合,溶液的体积也不是两溶液体积之和。
例2 (1)在100 g物质的量浓度为c ml·L-1,密度为ρ g·cm-3的硫酸中加入一定 量的水稀释成 ml·L-1的硫酸,则加入水的体积 < (填“=”“>”或“<”,下同)100 mL。(2)若把(1)中的硫酸改成氨水,应加入水的体积 > 100 mL。 (3)若把(1)(2)中的物质的量浓度均改为溶质的质量分数,则加入水的体积 = 100 mL。
解析 (1)设加入水的体积为V mL,则 c= · ,由于ρ'<ρ,所以V<100。(2)由于ρ'>ρ,所以V>100。(3)根据溶质质量分数= ×100%知,溶质的量不变,溶质的质量分数减半,则溶液质量加倍,所以均应加入100 mL水。
规律方法溶质相同、质量分数不同的两溶液的混合规律同一溶质、质量分数分别为a%、b%的两溶液混合。(1)等质量混合两溶液等质量混合时(无论ρ>1 g·cm-3还是ρ<1 g·cm-3),混合后溶液中溶质的质量分数ω= (a%+b%)。(2)等体积混合溶液等体积混合,混合溶液的浓度必然偏向质量大的一方,即密度大的一方。
①当溶液密度大于1 g·cm-3时,必然是溶液浓度越大,密度越大,多数溶液(如H2SO4溶液、HNO3溶液、HCl溶液、NaOH溶液等)等体积混合后,溶质质量分 数ω> (a%+b%)。②当溶液密度小于1 g·cm-3时,必然是溶液浓度越大,密度越小,如酒精溶液、 氨水等体积混合后,溶质质量分数ω< (a%+b%)。
1.(2021甘肃武威第六中学开学考试)下列说法中正确的是 ( )A.1 L水中溶解了58.5 g NaCl,该溶液中溶质的物质的量浓度为1 ml·L-1B.配制500 mL 0.5 ml·L-1的CuSO4溶液,需62.5 g胆矾C.从1 L 2 ml·L-1的H2SO4溶液中取出0.5 L,该溶液的浓度为1 ml·L-1D.中和100 mL 1 ml·L-1的H2SO4溶液,需NaOH 4 g
解析 1 L水中溶解了58.5 g NaCl,溶液的体积不是1 L,溶液的物质的量 浓度无法求出,A项错误;根据化学式可知硫酸铜的物质的量等于硫酸铜晶体 的物质的量,所以需要胆矾的质量为0.5 L×0.5 ml·L-1×250 g·ml-1=62.5 g,B项 正确;从1 L 2 ml·L-1的H2SO4溶液中取出0.5 L,该溶液的浓度为2 ml·L-1,C项 错误;由关系式H2SO4~2NaOH可知,n(NaOH)=2n(H2SO4)=2×0.1 L×1 ml·L-1=0.2 ml,m(NaOH)=0.2 ml×40 g·ml-1=8 g,D项错误。
2.300 mL硫酸铝溶液中,含Al3+ 1.62 g,在该溶液中加入0.1 ml/L氢氧化钡溶 液300 mL,反应后溶液中硫酸根离子的物质的量浓度为(忽略溶液混合体积 后的变化) ( )
A.0.4 ml/L B.0.3 ml/L C.0.2 ml/L D.0.1 ml/L
解析 溶液中Al3+为1.62 g,物质的量为 =0.06 ml,根据电荷守恒可知,溶液中n(S )= n(Al3+)= ×0.06 ml=0.09 ml,加入的氢氧化钡的物质的量为0.1 ml/L×0.3 L=0.03 ml,溶液中S 与Ba2+反应生成BaSO4,消耗硫酸根离子的物质的量为0.03 ml,剩余硫酸根离子的物质的量为0.09 ml-0.03 ml=0.06 ml。所以反应后溶液中S 的物质的量浓度为 =0.1 ml/L。
3.病人输液用的葡萄糖注射液是葡萄糖(化学式为C6H12O6)的水溶液,其标签 上的部分内容如图所示。利用标签所提供的信息,回答下列问题:
(1)该注射液中葡萄糖的质量分数为 5% 。(2)该注射液中葡萄糖的物质的量浓度为 0.28 ml/L (保留两位小数)。(3)检测人的血液中葡萄糖(简称血糖,相对分子质量为180)的含量,参考指标 常以两种计量单位表示,即“mml/L”和“mg/dL”(1 L=10 dL)。以“mml/L”表示时,人的血糖正常值在3.61~6.11 mml/L之间。如果以“mg/dL”表 示,血糖正常值范围是 64.98~109.98 。
解析 (1)由标签所提供的信息可知该注射液中葡萄糖的质量分数为5%;(2) 溶质的质量为25 g,n= ≈0.139 ml,则c= =0.28 ml/L;(3)以“mml/L”表示时人的血糖正常值在3.61~6.11 mml/L之间,则以“mg/ dL”表示的血糖正常值范围为 ~ mg/dL,即为64.98~109.98 mg/dL。
考点二 一定物质的量浓度溶液的配制
题组一 溶液配制的操作
1.(2021海南定安中学月考)实验室里需要配制480 mL 0.1 ml/L的硫酸铜溶 液,下列实验用品及实验操作都正确的是( )
解析 实验室没有规格是480 mL的容量瓶,根据选择仪器的大而近的原 则,应该选择500 mL容量瓶配制溶液,选项A、B错误;500 mL容量瓶配制的溶 液体积是500 mL,500 mL水溶解溶质后溶液的体积不是500 mL,选项C错误; 配制500 mL 0.1 ml/L的CuSO4溶液,溶质的物质的量n(CuSO4)=0.1 ml/L×0.5L=0.05 ml,用胆矾配制溶液,根据原子守恒可知需称量胆矾的质量m(CuSO4· 5H2O)=0.05 ml×250 g/ml=12.5 g,故应该称量胆矾12.5 g,配制成500 mL溶 液,选项D正确。
2.用98%的浓硫酸(密度为1.84 g/cm3)配制100 mL 1 ml/L的稀硫酸。现给出 下列仪器(配制过程中可能用到):①100 mL量筒、②10 mL量筒、③50 mL烧 杯、④托盘天平、⑤100 mL容量瓶、⑥胶头滴管、⑦玻璃棒,按使用仪器的 先后顺序排列正确的是 ( )A.④③⑦⑤⑥ B.②⑤⑦⑥ C.①③⑤⑥⑦ D.②⑥③⑦⑤⑥
解析 浓硫酸的浓度为 =18.4 ml/L,根据溶液稀释过程中溶质的量是不变的可知,V×18.4 ml/L=0.1 L×1 ml/L,V≈0.005 4 L=5.4 mL,因此应该选择10 mL量筒。用10 mL量筒量取5.4 mL的浓硫酸,在烧杯 中稀释后,转移到100 mL容量瓶中,洗涤烧杯、玻璃棒并把洗涤液移入容量 瓶,加水定容,振荡摇匀,按使用仪器的先后顺序排列为②10 mL量筒、⑥胶头 滴管、③50 mL烧杯、⑦玻璃棒、⑤100 mL容量瓶、⑥胶头滴管,故选D。
题组二 溶液配制的误差分析
3.(2021福建泉州永春第一中学月考)下列对实验操作分析错误的是 ( )A.配制0.1 ml/L NaCl溶液时,若没有洗涤烧杯和玻璃棒,则所得溶液物质的 量浓度偏低B.NH4NO3溶解吸热,若配制0.5 ml/L NH4NO3溶液时直接将溶解后的溶液转 移到容量瓶中,则所得溶液的物质的量浓度偏高C.配制一定物质的量浓度溶液时,若所用砝码已经生锈,则所得溶液的物质的 量浓度偏高D.配制一定物质的量浓度溶液时,若定容时不小心加水超过刻度线,立刻将超 出的水吸出,则所得溶液的物质的量浓度偏低
解析 没有洗涤烧杯和玻璃棒,溶质的物质的量减小,溶液物质的量浓度 偏低,故A正确;NH4NO3溶解吸热,直接将溶解后的溶液转移到容量瓶中加水 体积偏大,浓度偏低,故B错误;所用砝码已经生锈,溶质的物质的量偏大,溶液 的物质的量浓度偏高,故C正确;加水超过刻度线,立刻将超出的水吸出,有部 分溶质也会被吸出,溶液的物质的量浓度偏低,故D正确。
4.用沉淀滴定法快速测定NaI等碘化物溶液中c(I-),实验过程包括准备标准溶 液和滴定待测溶液。准备标准溶液a.准确称取AgNO3基准物4.246 8 g(0.025 0 ml)后,配制成250 mL标准溶液,放 在棕色试剂瓶中避光保存,备用。b.配制并标定100 mL 0.100 0 ml·L-1NH4SCN标准溶液,备用。(1)将称得的AgNO3配制成标准溶液,所使用的仪器除烧杯和玻璃棒外还有 250 mL(棕色)容量瓶、胶头滴管 。
(2)AgNO3标准溶液放在棕色试剂瓶中避光保存的原因是 避免AgNO3见光分解 。(3)若在配制AgNO3标准溶液时,烧杯中的溶液有少量溅出,则配制的溶液中 AgNO3的浓度 偏低 (填“偏高”“偏低”或“无影响”,下同),则对c(I-) 测定结果的影响是 偏高 。
解析 (1)配制硝酸银标准溶液时,所使用的仪器除烧杯和玻璃棒外,还有250 mL(棕色)容量瓶和胶头滴管。(2)硝酸银标准溶液放在棕色试剂瓶中避光保存是因为硝酸银见光易分解。(3)若在配制硝酸银标准溶液时,烧杯中的溶液有少量溅出,会导致溶质的物质的量减小,浓度偏低。浓度偏低,消耗的硝酸银溶液的体积增大,则会造成测定的碘离子浓度偏高。
1.误差分析思维导图
方法指导2.配制100 mL 1.00 ml·L-1氯化钠溶液常出现的误差
1.(2021陕西延安第一中学第二次质检)现实验室需要用质量分数:98%、密 度:1.84 g/cm3的浓硫酸配制240 mL 4.6 ml/L的稀硫酸,下列说法中正确的是 ( )A.该浓硫酸的物质的量浓度为18.4 ml/LB.需要该浓硫酸的体积为60 mLC.配制稀硫酸时,将量好的浓硫酸注入容量瓶中,并加入适量的水D.该同学实际配制得到的浓度为4.8 ml/L,可能的原因是量筒量取浓硫酸时 俯视刻度线
解析 密度为1.84 g/cm3,溶质的质量分数为98%的浓硫酸物质的量浓度c= =18.4 ml/L,故A正确;需要240 mL 4.6 ml/L的硫酸,应选择250 mL容量瓶,实际配制250 mL溶液,依据稀释过程中溶质的物质的量 不变得18.4 ml/L×V=0.25 L×4.6 ml/L,解得V=0.062 5 L,故B错误;配制稀硫 酸时,将量好的浓硫酸注入烧杯中,容量瓶不能用于稀释溶液,故C错误;量筒 量取浓硫酸时俯视刻度线,会使所取溶质的物质的量偏小,根据c= ,所配溶液的浓度会偏小,故D错误。
2.(2020黑龙江部分学校5月联考)海冰是海水冻结而成的咸水冰,海水冻结时,部分来不及流走的盐分(设以NaCl为主)以卤汁的形式被包裹在冰晶之间,形成“盐泡”,其大致结构如图所示,若海冰的冰龄达到1年以上,则融化后的水为淡水。下列叙述正确的是 ( )
A.海冰内层“盐泡”越少,密度越大B.海冰冰龄越短,内层的“盐泡”越少C.每含1 ml H2O的海冰内就有2×10-5NA个NaCl分子(NA为阿伏加德罗常数的值)D.海冰内层NaCl的浓度约为10-3 ml/L(设海冰的密度为0.9 g·cm-3)
解析 “盐泡”内含有NaCl等盐类,“盐泡”越多,质量越大,海冰密度越 大,故A错误;若海冰的冰龄达到1年以上,融化后的水为淡水,即冰龄越长,内层 的“盐泡”越少,故B错误;NaCl是离子化合物,不存在NaCl分子,故C错误;假 设有1 L海冰,质量为900 g,水的物质的量约为50 ml,“盐泡”与H2O的个数 比约为2×10-5∶1,则氯化钠的物质的量约为1×10-3 ml,所以海冰内层NaCl的 浓度约为10-3 ml/L,故D正确。
3.(2020山东枣庄第二中学第一次阶段性检测)“84消毒液”是一种以NaClO 为有效成分的高效消毒剂,被广泛用于宾馆、旅游、医院、食品加工行业、 家庭等的卫生消毒,某“84消毒液”瓶体部分标签如图1所示,该“84消毒 液”通常稀释至100倍(体积之比)后使用,请回答下列问题:
(1)此“84消毒液”的物质的量浓度约为 3.8 ml/L(计算结果保留一位小数)。(2)某同学量取此“84消毒液”,按说明要求稀释后用于消毒,则稀释后的溶液中c(Na+)= 0.038 ml/L。
(3)该同学参阅该“84消毒液”的配方,欲用NaClO固体配制480 mL NaClO质 量分数为24%的消毒液。①如图2所示的仪器中,配制溶液需要使用的是 CDE (填仪器序号),还缺 少的玻璃仪器是 玻璃棒和胶头滴管 。②下列操作中,容量瓶不具备的功能是 bcde (填字母)。a.配制一定体积准确浓度的标准溶液b.贮存溶液c.测量容量瓶规格以下的任意体积的溶液d.准确稀释某一浓度的溶液e.用来加热溶解固体溶质
③请计算该同学配制此溶液需称取NaClO固体的质量为 141.6 g。(4)若实验遇下列情况,导致所配溶液的物质的量浓度偏高的是 AC (填字母)。A.定容时俯视刻度线B.转移前,容量瓶内有蒸馏水C.未冷却至室温就转移定容D.定容时水加多,用胶头滴管吸出
解析 (1)c(NaClO)= = ml/L≈3.8 ml/L。(2)溶液在稀释前后溶质的物质的量不变,则稀释后c(NaClO)= ×3.8 ml/L=0.038 ml/L,故c(Na+)=c(NaClO)=0.038 ml/L。(3)①由于实验室无480 mL容量瓶,故应 选用500 mL容量瓶,根据配制一定物质的量浓度的溶液的步骤是计算、称 量、溶解、冷却、移液、洗涤、定容、摇匀和装瓶可知所需的仪器有托盘 天平、烧杯、玻璃棒、500 mL容量瓶和胶头滴管,故需使用仪器序号是 CDE,还需要的是玻璃棒、胶头滴管。②容量瓶只能用于配制一定体积准确 浓度的标准溶液,a不符合题意;容量瓶不能贮存溶液,只能用于配制,配制完成 后要尽快装瓶,b符合题意;容量瓶只有一条刻度线,不能测量容量瓶规格以下
化学必修 第一册第三节 物质的量优秀课件ppt: 这是一份化学必修 第一册第三节 物质的量优秀课件ppt,文件包含第18讲+一定物质的量浓度溶液的配制pptx、第18讲一定物质的量浓度溶液的配制教师版docx、第18讲一定物质的量浓度溶液的配制学生版docx等3份课件配套教学资源,其中PPT共22页, 欢迎下载使用。
人教版 (2019)必修 第一册实验活动1 配制一定物质的量浓度的溶液精品课件ppt: 这是一份人教版 (2019)必修 第一册实验活动1 配制一定物质的量浓度的溶液精品课件ppt,共36页。PPT课件主要包含了看谁做得既准又快,学习目标,你将准备如何配制,问题探究,物质的量浓度溶液配制,溶液的配制,计算→称量→溶解,烧杯或量筒或其他仪器,评一评,哪种量筒精确度高等内容,欢迎下载使用。
必修 第一册第三节 物质的量优质课件ppt: 这是一份必修 第一册第三节 物质的量优质课件ppt,共21页。PPT课件主要包含了刻度线,玻璃棒,mL容量瓶,胶头滴管,凹液面最低处,无影响等内容,欢迎下载使用。












