






人教版 (2019)选择性必修1第一节 电离平衡图文ppt课件
展开引课视频:为什么不能湿手触摸开关
生活常识告诉我们,给电气设备通电时,湿手操作易发生触电事故。这是为什么呢?
1、通过实验、假设、推理等过程,以探究的方式建构电离模型,并以此认识电解质。 2、了解酸碱盐在水溶液中的电离及导电条件。 3、能用电离方程式表示酸碱盐的电离过程。
下面哪些物质能导电?为什么能导电 ?盐酸、NaOH 溶液 、NaCl固体、石墨、蔗糖溶液、乙醇、NaCl溶液、Cu
小结:(1)石墨、铜能导电,因为其中有自由移动的电子。(2)盐酸、NaOH 溶液、NaCl溶液能导电因为它们的溶液中有自由移动的离子存在。(3) NaCl固体、蔗糖溶液、酒精不能导电因为它们没有自由移动的离子存在。
视频:熔融盐的导电性实验
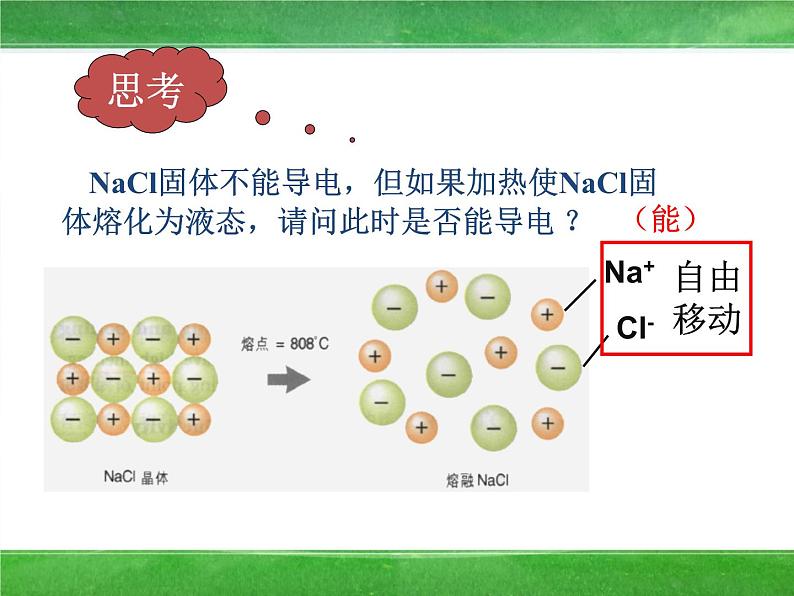
NaCl固体不能导电,但如果加热使NaCl固体熔化为液态,请问此时是否能导电 ?
1.电解质:在水溶液里或熔融状态下自身能导电的 化合物。如:酸、碱、盐,金属氧化物,水等。
2.非电解质:在水溶液里或熔融状态下都不导电的 化合物。如:蔗糖、酒精(大多数有机物),大多数非金属氧化物,氨气等。
注意:1、电解质与非电解质都属于化合物,故混合物或单质既不属于电解质,也不属于非电解质。 2、电解质导电是有条件的,是在水溶液中或熔融状态下能导电。比如,HCl在液态时不导电;但其水溶液盐酸是可以导电的,所以HCl是电解质。
1.像CO2、SO2、SO3、NH3这些物质,它们溶于水可以导电,那它们是电解质吗?
结论:电解质导电的实质是自身溶于水或熔融状态下能直接产生自由移动的离子。
2.BaSO4、CaCO3、AgCl等难溶盐,它们几乎不溶于水,那它们是电解质吗?
结论:物质是否属于电解质与该物质的溶解性无关
3.BaO、Na2O等金属氧化物,是因为它们溶于水可以导电,所以它们是电解质吗?
下列物质哪些是电解质?哪些是非电解质?哪些能导电?
⑴ 金属铜 ⑵ 固态NaCl ⑶ O2 ⑷ H2SO4 ⑸ 碳棒 ⑹ 酒精水溶液 ⑺ KOH水溶液 ⑻ 熔融状态的KNO3 ⑼ 葡萄糖 ⑽ CO2 ⑾ BaSO4 ⑿ 稀H2SO4 (13)液氯 (14)Na2O
电解质: ⑵ ⑷ ⑻ ⑾(14)
能导电: ⑴ ⑸ ⑺ ⑻ ⑿
固体氯化钠不导电,而氯化钠溶液和熔融态的氯化钠都有导电能力是什么原因?
1、电离:物质溶于水后或受热熔化时,解离成能够自由移动的离子的过程。
课堂练习3:判断下列物质在相应条件下能否电离,并说明理由。①液态HCl:____,______________________________________。②熔融的NaCl:_____,___________________。③熔融的单质铁________,____________。④固体KOH:________,_____________________。
HCl是酸,液态时不电离,只在水溶液中电离
能电离出Na+和Cl-
固体氯化钠不导电,而氯化钠溶液和熔融态的氯化钠都有导电原因和离子移动的方向
2、导电条件:有自由移动的离子。阳离子向与电源负极相连的电极移动,阴离子向与电源正极相连的电极移动
(1). 分析电离方程式
NaCl ==== Na+ + Cl-
离子符号(代表水合离子)
(2).书写步骤: a:阴阳离子部分拆开写,但原子团不能拆,例如NO3-、SO42-、OH-、NH4+、CO32-等不能拆。 b:构成物质的原子或原子团的个数在书写成离子时为系数。C:原子个数守恒,电荷守恒
Al2 (SO4)3=2Al3+ +3SO42-
3、电离方程式:电解质的电离可以用电离方程式表示(为简便起见,一般仍用离子符号表示水合离子)。
NaCl =Na+ + Cl-
H2SO4 =2H+ + SO42-
NaOH =Na+ + OH-
课堂练习4: 写出HCl、H2SO4、HNO3 、NaOH、KOH、Ba(OH)2、NaCl、K2SO4和NH4NO3的电离方程式:
电离时生成的阳离子全部是氢离子(H+)的化合物叫做酸。
HCl+H2O=H3O++Cl-能表示盐酸的电离方程式吗?
课本P15注标:①氢原子失去电子后。剩余1个质子构成的核,即氨离子。氢离子是“裸露”的质子,半轻很小,易与水分子结合成水合氢离子,通常用H3O+表示。为了简便,也常把H3O+”写作H+ 。
电离时生成的阴离子全部是氢氧根离子(OH-)的化合物叫做碱。
【思考与讨论】请参考酸的本质,尝试从电离的角度概括出碱的本质。
电离时能生成金属阳离子(或者NH4+)和酸根阴离子 的化合物叫做盐。
课堂练习5: 已知,水溶液中,强酸的酸式根能完全解离, 而弱酸的酸式根不能完全解离。书写以下物质的电离方程式。 NaHCO3 NaHSO4
NaHSO4 = Na+ +H+ + SO42-
NaHCO3 = Na+ +HCO3-
思考:NaHSO4溶于水时能电离出H+,NaHSO4属于酸吗?
不是。电离时生成的阳离子不全部是氢离子(H+)、还有Na+
强电解质:在水溶液中能完全电离的电解质。
弱电解质:在水溶液中部分电离的电解质。
【拓展】 电解质有强弱之分
强酸:(六大强酸)HCl、HNO3、H2SO4、HClO4 、HBr、HI
强碱:(四大强碱)NaOH、KOH、Ca(OH)2、Ba(OH)2
大多数的盐:NaCl、AgCl、BaSO4……
金属氧化物也是强电解质,熔融状态下都能完全电离
弱酸:CH3COOH、HF、HClO、H2S 、H2CO3、H2SO3、H3PO4(中强酸)
弱碱:所有难溶性碱、 NH3•H2O
个别盐: (CH3COO)2Pb等
= H+ + NO3-
= Ca2+ + CO32-
= Mg2++ 2Cl-
= 2Al 3++ 3SO42-
1、强电解质在水中或熔融下完全电离,书写用 “=” 等号:
2、弱电解质在水中只有部分电离
①先判断强、弱电解质,决定符号,强电解质一步电离
③多元弱碱的电离,以一步电离表示。
②多元弱酸分步电离,电离能力逐渐降低,以一级电离为主。
④Al(OH)3有酸式和碱式电离。
⑤弱酸的酸式盐的电离是分步电离,先完全电离成金属离子和酸式酸根,酸式酸根再部分电离。
⑥强酸的酸式盐在水溶液中完全电离,在稀溶液中不存在酸式酸根;而在熔融状态,则电离成金属离子和酸式酸根离子
强等号、弱可逆、多元弱酸分步写,多元弱碱一步完
3.强电解质与弱电解质的比较
强酸、强碱、多数盐、活泼金属氧化物
在水溶液中或熔化状态下都能电离。
1.下列电离方程式书写完全正确的是 ( )A.H2SO4===H++SO42-B.Ca(OH)2===Ca2++(OH)22-C.NaCl===Na++Cl-D.Al2(SO4)3===Al23++3SO42-
水溶液里或熔融状态下能导电
从电离的角度认识酸碱盐
多数有机物、非金属氧化物(CO2、SO2等)、NH3等
酸、碱、盐、H2O、活泼金属氧化物等
高中化学人教版 (2019)选择性必修1第一节 电离平衡精品课件ppt: 这是一份高中化学人教版 (2019)选择性必修1第一节 电离平衡精品课件ppt,文件包含311强电解质和弱电解质弱电解质的电离平衡练习解析版docx、311强电解质和弱电解质弱电解质的电离平衡练习原卷版docx等2份课件配套教学资源,其中PPT共0页, 欢迎下载使用。
人教版 (2019)第一节 电离平衡评优课课件ppt: 这是一份人教版 (2019)第一节 电离平衡评优课课件ppt,文件包含人教版高中化学选择性必修一311《强电解质和弱电解质弱电解质的电离平衡》课件pptx、人教版高中化学选择性必修一311《强电解质和弱电解质弱电解质的电离平衡》学案docx等2份课件配套教学资源,其中PPT共32页, 欢迎下载使用。
人教版 (2019)选择性必修1第一节 电离平衡教课内容ppt课件: 这是一份人教版 (2019)选择性必修1第一节 电离平衡教课内容ppt课件,共37页。PPT课件主要包含了目录索引等内容,欢迎下载使用。













