





高中化学人教版 (2019)选择性必修1第一节 电离平衡作业课件ppt
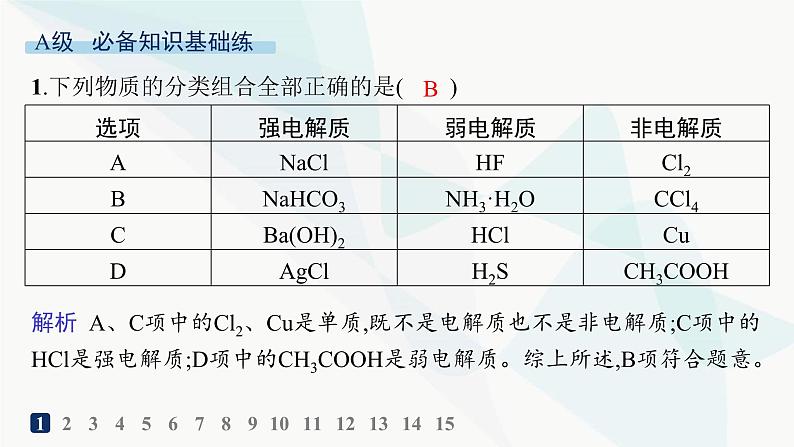
展开1.下列物质的分类组合全部正确的是( )
解析 A、C项中的Cl2、Cu是单质,既不是电解质也不是非电解质;C项中的HCl是强电解质;D项中的CH3COOH是弱电解质。综上所述,B项符合题意。
2.下列溶液中导电性最强的是( )A.1 L 0.2 ml·L-1醋酸B.0.1 L 0.1 ml·L-1 H2SO4溶液C.0.5 L 0.1 ml·L-1盐酸D.2 L 0.1 ml·L-1 H2SO3溶液
解析 电解质溶液的导电能力取决于溶液中自由移动的离子浓度及离子所带的电荷数,CH3COOH、H2SO3为弱酸,部分电离;盐酸和硫酸为强酸,完全电离;故0.1 ml·L-1 H2SO4溶液中离子浓度最大,导电能力最强,B正确。
3.下列事实可以证明NH3·H2O是弱碱的是( )A.氨水能与CuCl2溶液反应生成Cu(OH)2沉淀B.铵盐受热易分解,放出氨气C.0.1 ml·L-1的氨水可以使酚酞溶液变红D.0.1 ml·L-1的氨水中,c(OH-)约为0.001 ml·L-1
解析 0.1 ml·L-1的氨水中,c(OH-)约为0.001 ml·L-1,说明NH3·H2O只有部分发生了电离,可证明NH3·H2O是弱碱。
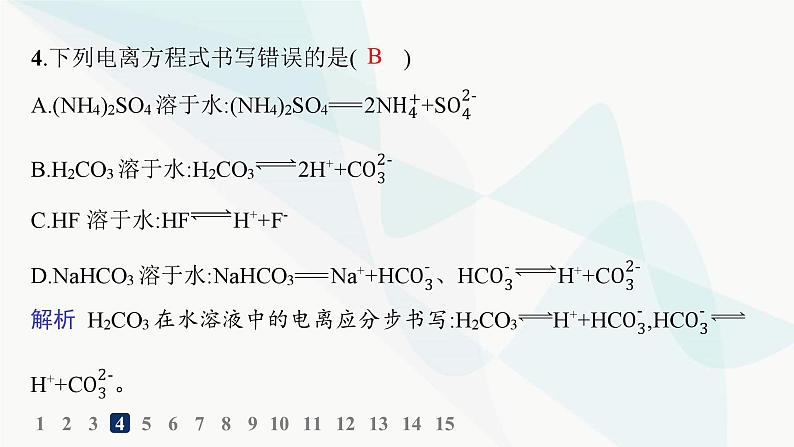
4.下列电离方程式书写错误的是( )
5.下列关于电解质的叙述正确的是( )A.强酸、强碱及大部分盐类属于强电解质,弱酸、弱碱属于弱电解质B.所有的离子化合物都是强电解质,所有的共价化合物都是弱电解质C.强电解质溶液的导电能力一定比弱电解质溶液的导电能力强D.AgCl、BaSO4在水溶液中都难溶,它们都为弱电解质
解析 强酸、强碱及大部分盐类在水溶液中或熔融时能完全电离,是强电解质;弱酸、弱碱在水溶液中部分电离,是弱电解质,A正确。部分共价化合物如CO、NO属于非电解质,B错误。溶液的导电能力取决于溶液中自由移动离子的浓度及离子所带的电荷数,与电解质的强弱无直接关系,C错误。AgCl、BaSO4在溶液中溶解的部分完全电离,它们都属于强电解质,D错误。
6.下列说法正确的是( )A.NaHSO4在熔融状态下的电离方程式:NaHSO4=== Na++H++B.Fe(OH)3在水溶液中的电离方程式:Fe(OH)3=== Fe3++3OH-C.明矾的化学式:KAl(SO4)2·12H2OD.SO2的水溶液能导电,故SO2属于电解质
解析 NaHSO4在熔融状态下电离产生Na+和 ,电离方程式为NaHSO4===Na++ ,A错误;Fe(OH)3为弱碱,在水溶液中的电离方程式用可逆号,B错误;明矾的化学式为KAl(SO4)2·12H2O,C正确;SO2溶于水后与水反应生成弱电解质亚硫酸,SO2不能电离,则SO2属于非电解质,故D错误。
7.已知硫化氢是一种二元弱酸。(1)H2S溶于水的电离方程式为 。 (2)向H2S溶液中加入少量CuSO4固体时,电离平衡向 移动,c(H+) ,c(S2-) 。 (3)向H2S溶液中加入NaOH固体时,电离平衡向 移动,c(H+) ,c(S2-) 。 (4)若要增大H2S溶液中的c(S2-),且使电离平衡正向移动,可以加入 。
H2S H++HS-,HS- H++S2-
(2)当加入少量CuSO4固体时,因发生反应Cu2++S2-===CuS↓,平衡右移,导致c(H+)增大,但c(S2-)减小。(3)当加入NaOH固体时,因发生反应H++OH-===H2O,平衡右移,导致c(H+)减小,但c(S2-)增大。(4)要增大c(S2-),且使电离平衡正向移动,可以加入强碱如NaOH固体等。
8.醋酸中发生如下电离CH3COOH CH3COO-+H+,下列条件能使电离程度增大的有( )①加水稀释 ②加NaOH固体 ③加CH3COONa固体 ④通入HCl气体 ⑤升温 ⑥加入冰醋酸A.①②⑤B.①②⑤⑥C.①②③⑤⑥D.①②③④⑤⑥
解析 CH3COOH是弱酸,在溶液中存在电离平衡CH3COOH CH3COO-+H+。①加水稀释后,可促进醋酸电离,符合题意;②加氢氧化钠固体可消耗H+,电离平衡正向移动,电离程度增大,符合题意;③加CH3COONa固体,溶液中CH3COO-的浓度增大,平衡逆向移动,不符合题意;④通入HCl气体,增大了H+浓度,平衡逆向移动,不符合题意;⑤弱电解质的电离过程是吸热的,升温使平衡正向移动,促进电离,符合题意;⑥加入冰醋酸,CH3COOH的浓度增大,电离平衡正向移动,但是电离程度减小,不符合题意;故选①②⑤。
9.下列说法正确的是( )A.Ca(OH)2微溶于水,所以是弱电解质B.在水中能电离出离子的化合物一定是离子化合物C.CO2分子中含有极性键,且溶于水能导电,所以CO2是电解质D.NH3·H2O在水中只能部分电离,所以是弱电解质
解析 区别强、弱电解质的依据是看其溶于水后能否完全电离,和其溶解度大小无必然联系。Ca(OH)2虽然微溶于水,但溶于水的部分能完全电离,所以是强电解质,A项错误;某些共价化合物在水中也能电离出离子,如H2SO4等,B项错误;CO2溶于水能导电是由于CO2和水发生反应生成了H2CO3,液态CO2不能导电,所以CO2是非电解质,C项错误;NH3·H2O在水溶液中部分电离,属于弱电解质,D项正确。
10.醋酸铅因有甜味而被称为“铅糖”,它有毒但能入药,又知(CH3COO)2Pb可溶于水,硝酸铅与醋酸钠溶液反应的离子方程式为Pb2++2CH3COO-=== (CH3COO)2Pb。下列有关说法中不正确的是( )A.0.1 ml·L-1的“铅糖”溶液中c(Pb2+)<0.1 ml·L-1B.“铅糖”是强电解质C.“铅糖”是共价化合物D.“铅糖”的溶液可能导电性很弱
解析 由离子方程式可知,(CH3COO)2Pb是弱电解质,A项正确,B项错误;因为离子化合物均是强电解质,故“铅糖”只能是共价化合物,C项正确;若“铅糖”溶液的浓度很小,则其溶液导电性很弱,D项正确。
11.下列有关电解质溶液的说法正确的是( )A.向0.1 ml·L-1 CH3COOH溶液中加入少量Na,CH3COOH的电离平衡正向移动,H+浓度增大B.室温下,稀释0.1 ml·L-1 CH3COOH溶液,溶液的导电能力增强C.如图表示弱电解质在水中建立电离平衡的过程
D.CH3COOH与Na2CO3反应生成CO2,能证明CH3COOH是弱酸
解析 向0.1 ml·L-1 CH3COOH溶液中加入少量Na,Na与溶液中的H+反应,CH3COOH的电离平衡正向移动,溶液中H+浓度减小,故A错误;室温下,稀释0.1 ml·L-1 CH3COOH溶液,溶液中离子浓度减小,溶液的导电能力减弱,故B错误;电离过程中,弱电解质分子电离为离子的速率逐渐减小,离子结合成弱电解质分子的速率逐渐增大,直到二者相等,电离过程达到了平衡,故C正确;CH3COOH与Na2CO3反应生成CO2,说明CH3COOH的酸性比碳酸强,不能说明CH3COOH是弱酸,故D错误。
12.用如图所示装置分别进行下列各组物质的导电性实验,小灯泡的亮度比反应前明显减弱的是( )
A.向亚硫酸钠溶液中通入氯气B.向硝酸银溶液中通入少量氯化氢C.向氢碘酸饱和溶液中通入少量氧气D.向氢氧化钠溶液中通入少量氯气
解析 A项中发生的反应为Na2SO3+Cl2+H2O===Na2SO4+2HCl,生成了两种强电解质,溶液的导电能力增强,故灯泡变亮;B项中发生的反应为AgNO3+HCl===AgCl↓+HNO3,溶液的导电能力没有明显变化,灯泡的亮度没有明显变化;C项中发生的反应为4HI+O2===2H2O+2I2,溶液的导电能力下降,灯泡变暗;D项中发生的反应为2NaOH+Cl2===NaCl+NaClO+H2O,溶液的导电能力没有明显变化,灯泡的亮度没有明显变化。
13.一元弱酸HA在溶液中存在电离平衡:HA A-+H+。将1.0 ml HA加入水中制得1.0 L溶液,下列图示中,表示溶液中HA、H+、A-的物质的量浓度随时间变化的曲线正确的是( )
解析 根据弱酸HA的电离平衡可知,溶液中HA的浓度由大到小,D项错误;溶液中A-、H+的浓度由0逐渐增大,A、B项错误;平衡时,HA浓度的减少量等于A-浓度的增加量,C项正确。
14.(1)在如图所示的串联装置中,发现灯泡不亮,但若向其中一个烧杯中加水,则灯泡会亮起来。
请问:①向哪个烧杯中加水灯泡会亮起来?为什么?②哪两个烧杯中液体混合后导电能力会减弱?为什么?
(2)在一定温度下,向电解质溶液中加入新物质时溶液的导电能力可能发生变化,实验过程中电流(I)随所加新物质的质量(m)变化的曲线如图所示。
下列各项中与A图变化趋势一致的是 (填字母,下同),与B图变化趋势一致的是 ,与C图变化趋势一致的是 。 a.向Ba(OH)2溶液中滴入H2SO4溶液至过量b.向CH3COOH溶液中滴入氨水至过量c.向澄清石灰水中通入CO2至过量d.向NH4Cl溶液中逐渐加入适量NaOH固体
答案 (1)①在盛有纯醋酸的C烧杯中加水,灯泡就会亮起来;原因是纯醋酸中没有自由移动的离子,所以不导电,向醋酸加水后就会发生电离,从而产生自由移动的离子,所以能够导电。②A和D;因为两者混合发生反应:H2SO4+Ba(OH)2===BaSO4↓+2H2O,离子浓度降低。(2)b ac d
溶液中离子浓度先减小,当Ba(OH)2和H2SO4恰好完全反应时,体系中只有BaSO4沉淀和水,导电能力接近于0,继续滴加H2SO4溶液,溶液中离子浓度增大,溶液的导电能力又逐渐增强,与B图变化趋势一致;b中发生反应的离
溶液中离子浓度逐渐增大,溶液的导电能力逐渐增强,当CH3COOH和NH3·H2O恰好完全反应时,再滴加氨水,离子的数量没有明显增加,但溶液的体积增大,则离子浓度减小,溶液的导电能力减弱,与A图变化趋势一致;c中刚通入CO2时发生反应的离子方程式为Ca2++2OH-+CO2===CaCO3↓+H2O,CO2过量后发生的反应为
15.H2O2和H2O都是极弱电解质,但H2O2溶液显弱酸性。(1)若把H2O2看成是二元弱酸,请写出其在水中的电离方程式: 。 (2)鉴于H2O2显弱酸性,它能同强碱作用形成正盐,在一定条件下也可形成酸式盐。请写出H2O2与Ba(OH)2作用形成盐的化学方程式: 。 (3)水电离生成H3O+和OH-叫做水的自偶电离。同水一样,H2O2也有极微弱的自偶电离,请写出H2O2自偶电离的方程式: 。
H2O2+Ba(OH)2===BaO2+2H2O
人教版 (2019)选择性必修1第一节 电离平衡图文ppt课件: 这是一份人教版 (2019)选择性必修1<a href="/hx/tb_c4002426_t3/?tag_id=26" target="_blank">第一节 电离平衡图文ppt课件</a>,共25页。PPT课件主要包含了电解质和非电解质,想一想,课堂小结等内容,欢迎下载使用。
高中化学人教版 (2019)选择性必修1第一节 电离平衡精品课件ppt: 这是一份高中化学人教版 (2019)选择性必修1第一节 电离平衡精品课件ppt,文件包含311强电解质和弱电解质弱电解质的电离平衡练习解析版docx、311强电解质和弱电解质弱电解质的电离平衡练习原卷版docx等2份课件配套教学资源,其中PPT共0页, 欢迎下载使用。
人教版 (2019)第一节 电离平衡评优课课件ppt: 这是一份人教版 (2019)第一节 电离平衡评优课课件ppt,文件包含人教版高中化学选择性必修一311《强电解质和弱电解质弱电解质的电离平衡》课件pptx、人教版高中化学选择性必修一311《强电解质和弱电解质弱电解质的电离平衡》学案docx等2份课件配套教学资源,其中PPT共32页, 欢迎下载使用。













