






中职高教版(2021)学生实验一 一定物质的量浓度溶液的配制优质课件ppt
展开一定物质的量浓度溶液的配制
专题三 · 溶液与水溶液中的离子反应
1. 完成100 mL 1.00 ml/L NaCl溶液的配制。2. 正确使用容量瓶。
1. 加深对物质的量浓度的认识与理解。 2. 学会一定物质的量浓度溶液的配制方法。 3. 通过配制一定物质的量浓度的溶液,掌握溶解、转移、洗涤、定容等基本实验操作技能。养成规范、严谨、精益求精的实验习惯
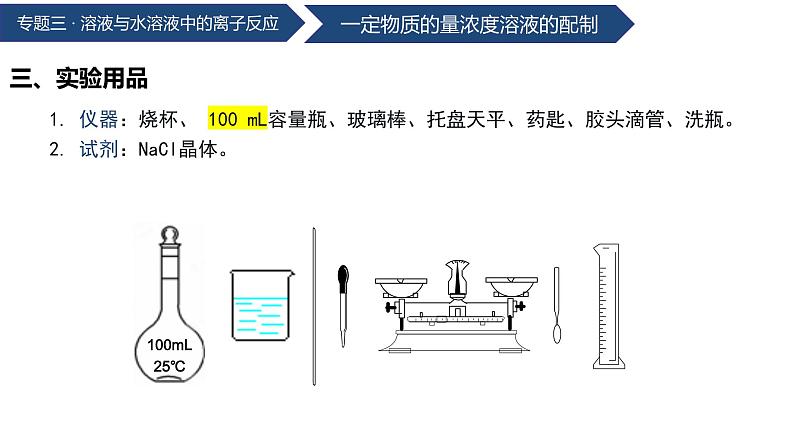
1. 仪器:烧杯、 100 mL容量瓶、玻璃棒、托盘天平、药匙、胶头滴管、洗瓶。 2. 试剂:NaCl晶体。
构造:细颈、梨形、平底的玻璃瓶, 配有磨口玻璃塞或塑料塞
3.使用:当溶液的凹液面与刻度线相切时,容量瓶中 溶液的体积即为容量瓶上所标识的体积。
2.特点:①容量瓶上标有温度和容积 ②容量瓶瓶颈上有一道刻度线
4. 使用范围:用来配制一定体积、浓度准确的溶液
容量瓶的常用规格:50mL、100 mL、250mL、500mL、1000mL 等(选取原则:大而近)
容量瓶上标有:温度、规格、刻度线,容量瓶只能用来配制规格体积的溶液
使用容量瓶的注意事项:
①使用前要检查是否漏水
②溶解不能在容量瓶中进行
③溶液恢复至室温后才能转移入容量瓶
④转移溶液时要用玻棒进行引流
检验程序:加水→塞瓶塞→倒立→查漏→正立→瓶塞旋转180°→倒立→查漏。
注意事项:(1)使用前要调零(2)两个托盘上各放一张大小相同的称量纸(3)称量时遵循左物右码的原则(4)用镊子夹取砝码应按照从大到小的顺序(5)称量完毕应将砝码放回盒中,游码归零
注意事项: 在烧杯中溶解,不能在容量瓶中溶解。因为在容量瓶上标有温度和体积,这说明容量瓶的体积受温度影响。而物质的溶解往往伴随着一定的热效应,如果用容量瓶进行此项操作,会因热胀冷缩使它的体积不准确,严重时还可能导致容量瓶炸裂。
提问:除了烧杯还需要哪些仪器?使用中应注意什么?
还需要玻璃棒。搅拌时沿着一定的方向,玻璃棒不要碰烧杯底和烧杯壁,不要把玻璃棒放在实验台上,以免弄脏。
注意事项:由于容量瓶瓶颈较细,为避免液体洒在外面,应用玻璃棒引流。
提问:将烧杯中的氯化钠溶液转移到 容量瓶中,此时溶质是否完全 被转移到容量瓶中?如何处理?
还有残留在烧杯壁和玻璃棒上的氯化钠未被转移。因此要用蒸馏水洗涤用过的烧杯和玻璃棒。
注意事项:用少量蒸馏水洗涤2~3次,洗涤液要全部转移到容量瓶中。
提问:如果用量筒量取液体药品,量筒要洗涤吗?
如果用量筒量取液体药品,量筒不必洗涤。因为这是量筒的“自然残留液”,若洗涤后转移到容量瓶中会导致所配溶液浓度偏高。但是使用量筒时应注意选择的量筒与量取液体的体积相匹配。
注意事项:向容量瓶中加入蒸馏水,在距离刻度2~3cm时,改用胶头滴管滴加蒸馏水至刻度线。
提问:若定容时不小心液面超过了刻度线,怎么办? 能用胶头滴管把多余的液体取出吗?
将容量瓶盖好塞子,如图示,把容量瓶倒转和摇动多次,使得溶液混合均匀。
提问:摇匀后发现液面低于刻线,能否补充水?
不能。因为是部分溶液在润湿容量瓶瓶口磨砂处有所损失所致。
容量瓶不能存放溶液,因此要把配制好的溶液转移到试剂瓶中,贴好标签,注明溶液的名称和浓度。
配制一定物质的量浓度溶液
1. 完成250 mL 0.2 ml/L HCl溶液的配制。2. 将1 ml/L CuSO4溶液稀释为0.02 ml/L CuSO4溶液。
1. 加深对溶液稀释原理 c1·V1 = c2·V2 的理解和掌握。 2. 通过溶液的稀释,进一步掌握转移、洗涤、定容等基本实验操作技能,养成规范操作、细心观察的良好习惯,培养精益求精的工匠精神。 3. 通过实验,进一步形成发现、解释、分析、推理、归纳、总结等实验探究方法及应用能力。
1. 仪器:量筒、烧杯、容量瓶、玻璃棒、滴瓶、胶头滴管、洗瓶。 2. 试剂:浓HCl、1 ml/L CuSO4溶液。
一、配制 250 mL 0.2 ml/L HCl 溶液 1.计算配制250 mL 0.2 ml/L HCl溶液,需浓盐酸(相对密度为1.19、质量分数为37.5%)mL。 2.用量筒量取比上述计算量稍多的浓盐酸(浓盐酸易挥发且具有刺激性,量取和、稀释等操作应在通风橱内进行)。 3.将量取的浓盐酸倒入盛有少量蒸馏水的小烧杯中,用玻璃棒搅匀后,将溶液沿玻璃棒转移至容量瓶中;然后用少量水洗涤烧杯和玻璃棒2 ~ 3次,将洗涤液也转移至容量瓶中;再用蒸馏水稀释,定容至刻度,摇匀。 4.将配制好的溶液转入干净、干燥的试剂瓶中,贴上标签保存。
二、配制 100 mL 0.02 ml/L CuSO4 溶液 1.计算配制100 mL 0.02 ml/L CuSO4溶液,需1 ml/L CuSO4溶液mL。 2.用量筒量取上述计算量的1 ml/L CuSO4溶液。 3.将量取的1 ml/L CuSO4溶液倒烧杯中,然后用量筒量取 mL蒸馏水倒入烧杯中,用玻璃棒搅拌,混匀。 4.将配制好的溶液转入干净、干燥的试剂瓶中,贴上标签保存。
1. 用广范pH试纸测定0.1 ml/L HCl、CH3COOH、NaOH、NH3·H2O溶液以及0.5 ml/L NaCl、 Na2CO3、NH4Cl溶液的pH。 2. 分别用紫色石蕊试液、酚酞试液和甲基橙试液测定0.1 ml/L HCl溶液、0.1 ml/L NaOH溶液和H2O的酸碱性,并确定溶液的pH范围。 3. 用pH计测定0.1 ml/L HCl溶液、0.1 ml/L NaOH溶液和H2O的pH。
1. 学会规范使用酸碱指示剂和pH试纸,测定溶液的酸碱性。 2. 培养学生严谨求实的实验态度,提高学生观察问题、分析问题的能力。 3. 进一步养成规范操作、细心观察、如实记录的实验室工作习惯。
1. 仪器:点滴板。 2. 试剂:0.1 ml/L的下列溶液:HCl、CH3COOH、 NaOH、NH3·H2O;0.5 ml/L的下列溶液:NaCl、Na2CO3、NH4Cl;石蕊试液、酚酞试液、甲基橙试液、广范pH试纸。
广泛pH试纸:其pH范围是1~14(最常用)。精密pH试纸:其pH范围较窄,可判别0.2或0.3的pH差值。
把小片试纸放在表面皿或玻璃片上
用玻璃棒蘸取待测溶液滴在干燥的pH试纸上
试纸变色后,与标准比色卡对比,即确定溶液的pH
(不能用pH试纸测量氯水,次氯酸钠溶液的pH)
该法只能测其酸碱性,即pH的大致范围,不能测出具体数值,常见的酸碱指示剂的颜色范围为:
精确测定溶液的pH时使用pH计(酸度计),测量时可以从pH计上直接读出溶液的pH。可以精确到小数点后两位。
一、用 pH 试纸测定溶液的近似 pH 1. 在白色点滴板的5个凹穴内,分别滴入2滴0.1 ml/L的下列溶液:HCl、CH3COOH、NaOH、NH3·H2O和H2O,用广范pH试纸测定溶液的酸碱性。 2. 在白色点滴板的3个凹穴内,分别滴入2滴0.5 ml/L 的下列溶液:Na2CO3、NH4Cl和NaCl,用广范pH试纸测定溶液的酸碱性。
二、用酸碱指示剂检测溶液的酸碱性 1.在白色点滴板的3个凹穴内,分别滴入2滴待测液:0.1 ml/L HCl溶液、0.1 ml/L NaOH溶液和H2O,再滴入1滴紫色石蕊试液。观察溶液颜色并确定溶液的pH范围。 2.在白色点滴板的3个凹穴内,分别滴入2滴待测液:0.1 ml/L HCl溶液、0.1 ml/L NaOH溶液和H2O,再滴入1滴无色酚酞试液。观察溶液颜色并确定溶液的pH范围。 3.在白色点滴板的3个凹穴内,分别滴入2滴待测液:0.1 ml/L HCl溶液、0.1 ml/L NaOH溶液和H2O,再滴入1滴橙色甲基橙试液。观察溶液颜色并确定溶液的pH范围。
三、用酸度计测定溶液的酸碱性 在三只烧杯里分别加入20 mL 0.1 ml/L HAc溶液、0.1 ml/L NH3·H2O溶液和0.1 ml/L NaCl溶液,用pH计依次测得它们的pH,记录数据并与pH试纸法比较。
高教版(2021)农林牧渔类基础模块主题六 常见生物分子及合成高分子化合物第一节 糖类完整版课件ppt: 这是一份高教版(2021)农林牧渔类基础模块主题六 常见生物分子及合成高分子化合物第一节 糖类完整版课件ppt,共34页。PPT课件主要包含了学习目标与核心素养,蛋白质等,主要内容,糖类的组成和分类,葡萄糖,蔗糖麦芽糖,存在形式,按照所含官能团的不同,分子结构,⑥使高锰酸钾褪色等内容,欢迎下载使用。
中职化学高教版(2021)农林牧渔类学生实验 常见生物分子的性质精品课件ppt: 这是一份中职化学高教版(2021)农林牧渔类学生实验 常见生物分子的性质精品课件ppt,共11页。PPT课件主要包含了学习目标与核心素养等内容,欢迎下载使用。
中职化学高教版(2021)农林牧渔类学生实验 重要有机化合物的性质完美版课件ppt: 这是一份中职化学高教版(2021)农林牧渔类学生实验 重要有机化合物的性质完美版课件ppt,共14页。PPT课件主要包含了主要内容,乙醇与钠反应,乙醇的性质,乙醇的氧化反应,苯酚的弱酸性,苯酚的性质,苯酚与浓溴水反应,苯酚的显色反应,与银氨溶液的反应,乙醛的性质等内容,欢迎下载使用。












