
初中化学人教版九年级下册第十一单元 盐 化肥课题1 生活中常见的盐同步达标检测题
展开一、单选题
1.向含有 AgNO3和 Cu(NO3)2的混合液中加入一定质量的铁粉,反应过程中,测得混合物中溶液的质量与加入铁粉的质量关系如图所示。下列说法正确的是
A.a点,滴加加稀盐酸,无白色沉淀产生
B.b 点,溶液中的溶质为 AgNO3和 Fe(NO3)2
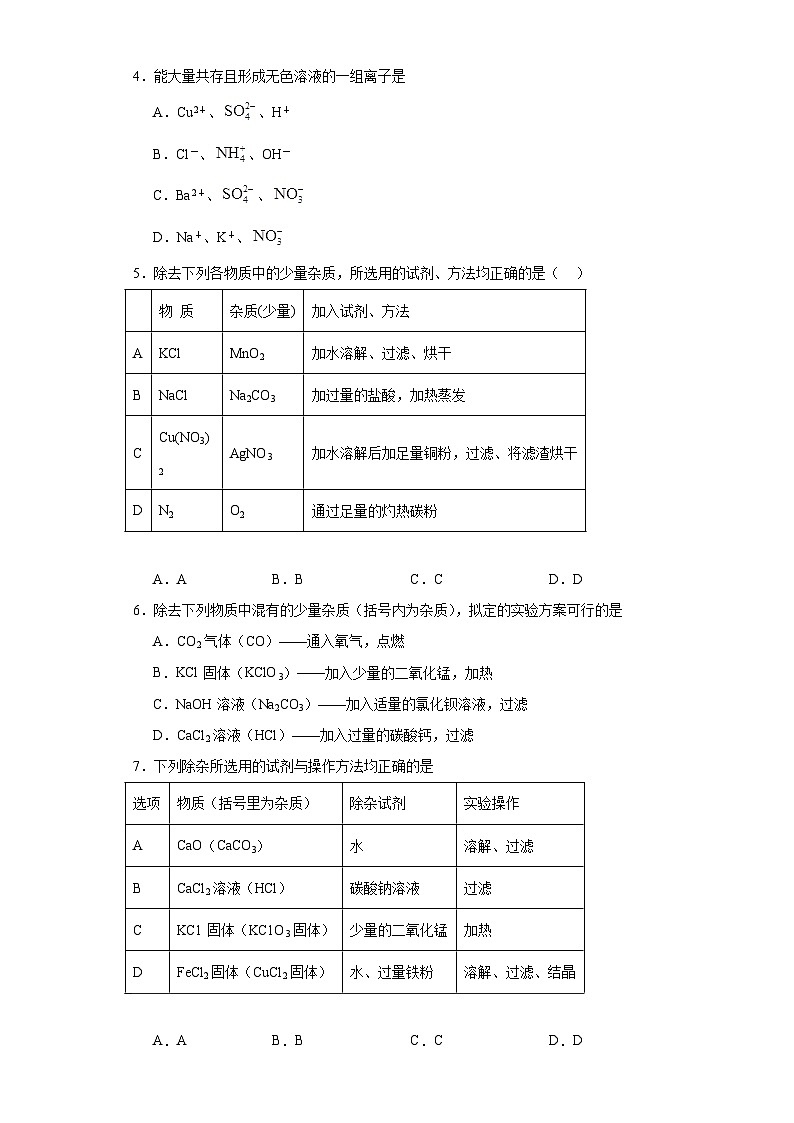
C.c点,过滤后得到的固体有三种
D.e点,向过滤后的固体中加盐酸,有气泡产生
2.下列各组内表示同一种物质的是( )
A.氢氧化钠、烧碱、火碱B.氢氧化钙、消石灰、生石灰
C.盐酸、氯化氢、食盐D.冰、干冰、水
3.除去下列物质中混有的少量杂质(括号内为杂质),所用方法不正确的是
A.AB.BC.CD.D
4.能大量共存且形成无色溶液的一组离子是
A.Cu2+、、H+
B.Cl-、、OH-
C.Ba2+、、
D.Na+、K+、
5.除去下列各物质中的少量杂质,所选用的试剂、方法均正确的是( )
A.AB.BC.CD.D
6.除去下列物质中混有的少量杂质(括号内为杂质),拟定的实验方案可行的是
A.CO2气体(CO)——通入氧气,点燃
B.KCl固体(KClO3)——加入少量的二氧化锰,加热
C.NaOH溶液(Na2CO3)——加入适量的氯化钡溶液,过滤
D.CaCl2溶液(HCl)——加入过量的碳酸钙,过滤
7.下列除杂所选用的试剂与操作方法均正确的是
A.AB.BC.CD.D
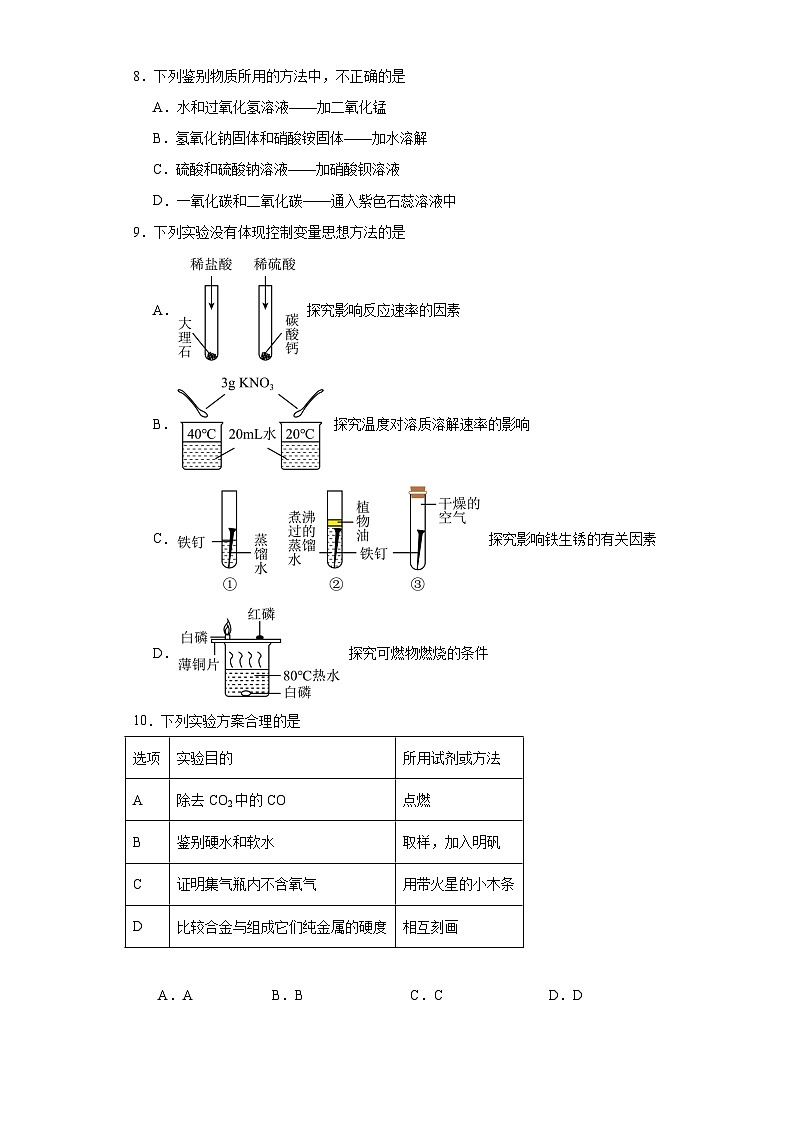
8.下列鉴别物质所用的方法中,不正确的是
A.水和过氧化氢溶液——加二氧化锰
B.氢氧化钠固体和硝酸铵固体——加水溶解
C.硫酸和硫酸钠溶液——加硝酸钡溶液
D.一氧化碳和二氧化碳——通入紫色石蕊溶液中
9.下列实验没有体现控制变量思想方法的是
A. 探究影响反应速率的因素
B. 探究温度对溶质溶解速率的影响
C. 探究影响铁生锈的有关因素
D. 探究可燃物燃烧的条件
10.下列实验方案合理的是
A.AB.BC.CD.D
二、判断题
11.所有复分解反应都是在溶液中进行的( )
12.生锈的铁钉加入适量的稀盐酸后溶液也会变成浅绿色( )
13.在“甲+乙→丙+丁”反应中,若甲是锌、丙是氢气,则乙一定是稀硫酸( )
14.在“甲+乙→丙+丁”反应中,若甲、乙、丙、丁均为化合物,则该反应一定是复分解反应( )
15.纯碱用做炉具清洁剂( )
三、综合应用题
16.酸、碱、盐是初中化学学习的重要内容,它们在生产、生活中有重要的用途。
(1)酸、碱的元素组成中都含有 元素;检验某溶液是否呈酸性,可选用的一种试剂是 。
(2)某实验小组用氢氧化钠溶液和稀盐酸探究中和反应,用pH计和温度传感器测定并绘制的图像如图所示。
①写出该反应的化学方程式 。
②B点对应的溶液中溶质的成分是 ;该反应属于 (填“吸热”或“放热”)反应。
(3)实验室为了除去粗食盐中所含有CaCl2、MgSO4杂质,设计了如下实验步骤:
①将粗盐溶于水;②加入过量的Ba(OH)2溶液;③加入过量的Na2CO3溶液;④过滤;⑤向滤液中加入适量的盐酸;⑥蒸发结晶。加入Ba(OH)2溶液时所发生反应的化学方程式为 ;步骤③是为了除去溶液中的 (写离子符号)。
(4)若取100g溶质质量分数为11.7%的氯化钠溶液,加入足量的硝酸银溶液,充分反应后过滤,可得到氯化银的质量是多少?(写出计算过程,结果精确到0.1g)
17.煤化工废水含有硫酸钠、氯化钠以及少量硝酸钠。为综合利用煤化工废水,需测定其中硫酸钠的含量,取20 g该废水样品,将一定量的氯化钡溶液平司分成五份,依次加入废水样品中,测得数据如下表所示,请回答下列问题。(提示:反应的化学方程式为Na2SO4+BaCl2=BaSO4↓+2NaC1)
(1)实验室通常将氯化钡溶液保存在 (填“广口瓶"或“细口瓶”)中,倾倒氯化钡溶液时,标签应 。
(2)样品中硫酸钠完全反应时,生成沉淀的质量为 g。
(3)计算该废水样品中硫酸钠的质量分数(写出计算过程,精确0.1%)。
18.纯碱是重要的化工原料
(一)制备探究:如图是工业生产纯碱的主要流程示意图。
[查阅资料]
①粗盐水中含有杂质MgCl2、CaCl2;
②常温下,NH3极易溶于水,CO2能溶于水,
③NaHCO3加热易分解,Na2CO3加热不易分解。
(1)写出除去粗盐水中MgCl2的化学方程式: 。
(2)在工业生产纯碱工艺流程中,先“氨化”后“碳酸化”的目的是 ,“碳酸化”时,NaCl、NH3、CO2 和H2O相互作用析出NaHCO3,写出该反应的化学方程式 。
(3)“碳酸化”后过滤获得的NH4Cl可用作氮肥,也可先加热NH4Cl溶液,再加入熟石灰获得循环使用的物质是 ;
(4)煅烧制得纯碱的化学方程式是 。
(二)成分探究
[提出问题]纯碱样品中含有哪些杂质?
[猜想]
猜想一:可能含有NaHCO3; 猜想二:可能含有NaCl;猜想三:NaHCO3和NaCl
[实验探究]确定纯碱中是否含NaHCO3。实验装置和主要实验步骤如下:
①称量D、E装置总质量为200.0g,检查装置的气密性,将10.6 g纯碱试样放入锥形瓶中,按上图组装仪器,进行如下操作 ,后缓缓鼓入一段时间空气;
②按一定要求正确操作后,加入足量稀硫酸,待锥形瓶中不再产生气泡时,再次打开止水夹K1,从导管a处再次缓缓鼓入空气;
③一段时间后再次称量装置D、E的总质量为204.84g。
[实验讨论]
(5)步骤①中“如下操作”是指 ;
(6)装置B中一定发生的化学反应方程式为: ;
(7)装置B中生成CO2的质量为4.84g,通过计算说明纯碱中 含NaHCO3(填字母)。 (写出计算过程)
A.一定 B.一定不 C. 可能 D.无法确定
(8)另取10.6 g样品,加入a g 14.6%的盐酸恰好完全反应,再将所得溶液蒸干后得到固体的质量为W,当W的值满足 条件时,样品中含有NaCl。
四、综合题
19.物质由微粒构成。化学反应过程中某些微粒会发生改变,而有些微粒则不会发生改变。
(1)以下是氢氧化钠和盐酸的反应的微观示意图,发生的化学反应方程式为 ,从微观示意图可知,该反应中发生变化的微粒是 ,它们是该反应的“参与者”;未发生变化的微粒是 ,它们是该反应的“旁观者”。
(2)碳酸钠溶液与过量稀盐酸混合后的化学反应方程式为 ,实际参加反应的微粒是 。
(3)铁与硫酸铜溶液的反应中,溶液中实际参加反应的微粒是 ,溶液中的“旁观者”是 。
20.请从氢氧化钠、氧化镁、氢氧化钡、氢氧化铜、硝酸、碳酸钙中选择合适的物质,将其化学式填在所给的横线上。
(1)可以做干燥剂的物质 (2)一种可溶性碱
(3)加热有气体生成的物质 (4)一种氧化物
(5)一种酸 (6)一种蓝色不溶于水的碱
21.制笔行业中经常用到铂、钌(Ru)等贵金属。现有 5 种含钌元素的物质:Ru、RuO2、Ru2O3、RuCl3、K2RuO4。回答下列问题:
(1)RuO2 读作 。
(2)上述 5 种物质中钌元素的化合价一共有 种。
(3)从物质分类角度来看,K2RuO4 属于 。(填选项)
(4)H2 与 Ru2O3 在加热条件下反应可得到 Ru。写出反应的化学方程式 。
22.(1)现有H、C、O、N四种常见的元素,请选用其中的元素写出符合初中已学物质各一种(用化学式表示):
①电解水正极产生的气体 ;②溶于水后使水温降低的物质 ;
③相对分子质量最小的氧化物 ;④雪碧等汽水中含有的一种酸 。
(2)请写出下列反应的化学方程式。
①加热碱式碳酸铜 ;
②铁丝在纯氧中燃烧 ;
③盐酸除铁锈 ,溶液由无色变为 色。
④将少量二氧化碳通入足量石灰水中 该反应后溶液的质量较反应前 (选填“增加”、“减少” 或“不变”)了。
⑤将少量硫酸铵晶体与熟石灰混合研磨: ;该反应 (填“属于”或“不属于”)复分解反应,生成的气体可用 检验。
23.有下列各种物质:①NaCl、②NaOH、③HCl、④Ba(OH)2、⑤H2SO4、⑥Na2CO3、⑦H2O、⑧Cu(OH)2、⑨H3PO4、⑩CuO,其中属于酸的是 ,属于碱的是 ,属于氧化物的是 。(填序号)
物质
除杂方法
A
N2( O2 )
将气体通过灼热的铜网
B
CaCO3(NaCl)
溶解,过滤
C
CO(CO2)
将气体通过氢氧化钠溶液
D
Na2CO3溶液(NaOH)
滴加稀盐酸至恰好完全反应
物 质
杂质(少量)
加入试剂、方法
A
KCl
MnO2
加水溶解、过滤、烘干
B
NaCl
Na2CO3
加过量的盐酸,加热蒸发
C
Cu(NO3)2
AgNO3
加水溶解后加足量铜粉,过滤、将滤渣烘干
D
N2
O2
通过足量的灼热碳粉
选项
物质(括号里为杂质)
除杂试剂
实验操作
A
CaO(CaCO3)
水
溶解、过滤
B
CaCl2溶液(HCl)
碳酸钠溶液
过滤
C
KC1固体(KC1O3固体)
少量的二氧化锰
加热
D
FeCl2固体(CuCl2固体)
水、过量铁粉
溶解、过滤、结晶
选项
实验目的
所用试剂或方法
A
除去CO2中的CO
点燃
B
鉴别硬水和软水
取样,加入明矾
C
证明集气瓶内不含氧气
用带火星的小木条
D
比较合金与组成它们纯金属的硬度
相互刻画
实验序号
一
二
三
四
五
生成沉淀的总质量/g
0.50
1.00
1.50
2.00
2.33
A.化合物
B.氧化物
C.碱
D.盐
参考答案:
1.D
【分析】向硝酸银和硝酸铜的混合溶液中加入铁粉,铁粉优先和硝酸银反应,然后再和硝酸铜反应,根据图可知只,当加入铁粉质量为,硝酸银完全反应,当加入质量为时,硝酸铜完全反应
【详解】A、a点时,溶液中的硝酸银还有剩余,滴加加稀盐酸后盐酸会和硝酸银反应生成氯化银白色沉淀,A错误;
B、b 点时,硝酸银均已完全反应,但硝酸铜还未反应,故溶液中的溶质有硝酸亚铁和硝酸铜,B错误;
C、c点时,溶液中的硝酸银已经完全反应,但硝酸铜部分参与反应,反应过滤后,得到的固体有银和铜这两种,C错误;
D、e点时,铁已经加入过量,向过滤后的固体中存在铁,加盐酸后铁与盐酸反应生成氢气,故有气泡产生,D正确。
故选D。
2.A
【详解】A、氢氧化钠俗称苛性钠、火碱、烧碱,纯碱是碳酸钠,A选项三者表示同一物质,符合题意;
B、氢氧化钙俗称熟石灰、消石灰,生石灰是氧化钙,B选项三者表示了两种物质,不符合题意;
C、食盐是氯化钠,不是氯化氢,而盐酸是氯化氢的水溶液,C选项三者表示了三种物质,不符合题意;
D、冰是固态的水,干冰是固态的二氧化碳,不是同种物质,D选项三者表示了两种物质,不符合题意。故选A。
【点睛】本题主要考查学生对物质的俗称、名称等的识记,难度不大。 解题的关键是熟练记忆常见物质的名称,俗称和化学式等。
3.D
【详解】A、铜和氧气在加热条件下反应生成氧化铜固体,能达到除杂目的;B溶解时氯化钠成为溶液,碳酸钙不溶,过滤能将难溶性固体与液体分离;C二氧化碳能与氢氧化钠溶液反应生成碳酸钠和水,一氧化碳不与氢氧化钠溶液反应;D碳酸钠和氢氧化钠都与稀盐酸反应,不符合除杂要求;选D
点睛:除杂的原则:只除杂,不引杂。即所加试剂只能与杂质反应,不能与想要的主要成分反应,同时不能引入新的杂质
4.D
【详解】A.含Cu2+的溶液显蓝色;
B.和OH-反应生成NH3和水,不能大量共存;
C.Ba2+和反应生成BaSO4沉淀,不能大量共存;
D.可以大量共存;
故选D。
5.B
【分析】除杂的基本是:不增、不减、简便、易分、复原。基本思路是:先物理方法(如过滤、结晶等),再化学方法(如沉淀法、气化法、转化法、置换法、吸收法等)。
【详解】A、KCl易溶于水,MnO2难溶于水,将二者混合物加水溶解,KCl溶解,MnO2不溶解,过滤将MnO2除去,再对滤液进行蒸发结晶,即可得到纯净的KCl,选项A错误不符合题意;
B、Na2CO3可与盐酸反应生成氯化钠、CO2和水,在混合物中加过量盐酸,Na2CO3发生反应而除去,再将溶液加热蒸发,可除去过量的HCl,得到纯净的NaCl,选项B正确符合题意;
C、将混合物溶解于水后加入足量铜粉,铜和AgNO3反应生成Cu(NO3)2和Ag,过滤将滤渣烘干得到的是铜和银的混合物,将滤液中的溶质结晶,得到的才是我们需要的物质Cu(NO3)2,选项C错误不符合题意;
D、将混合气体通过足量灼热的碳粉,O2与碳发生反应生成CO或CO2,杂质由O2变成CO或CO2,没有达到除杂质的目的,选项D错误不符合题意。
故选:B。
【点睛】在做物质的除杂题时,首先要确定被提纯物质和杂质性质的不同,优先选择物理方法,然后再考虑化学方法。选择的试剂不与被提纯物质反应,反应后不会转成新的杂质,分离操作要简便。
6.D
【详解】A、二氧化碳不燃烧、不支持燃烧,二氧化碳中混有少量一氧化碳,无法被点燃,不符合题意;
B、加入少量的二氧化锰,氯酸钾在二氧化锰的催化下受热分解生成氯化钾和氧气,引入了新的杂质二氧化锰,不符合题意;
C、加入适量的氯化钡,氯化钡和碳酸钠反应生成碳酸钡和氯化钠,虽然除去了杂质,但是引入了新的杂质氯化钠,不符合题意;
D、加入过量的碳酸钙,碳酸钙和稀盐酸反应生成氯化钙、二氧化碳和水,过滤,除去过量的碳酸钙,可得氯化钙溶液,符合题意。
故选D。
7.D
【详解】A、氧化钙能与水反应生成氢氧化钙,碳酸钙不溶于水,溶解、过滤,能将碳酸钙除去,但是也除去了原物质,不符合题意;
B、加入碳酸钠溶液,碳酸钠能与盐酸反应生成氯化钠、二氧化碳和水,氯化钙能与碳酸钠反应生成氯化钠和碳酸钙沉淀,除去了原物质,不符合题意;
C、加入二氧化锰,氯酸钾在二氧化锰的催化下分解为氯化钾和氧气,除去了氯酸钾,但是引入了新的杂质二氧化锰,不符合题意;
D、将混合固体溶解,加入过量铁粉,铁和氯化铜反应生成氯化亚铁和铜,过滤,结晶即可得氯化亚铁固体,符合题意。
故选D。
【点睛】除杂选择试剂的原则是:不增(不引入新的杂质)、不减(不能将原物质反应掉)、不繁(整个过程不繁琐)。
8.C
【详解】A、水中加入二氧化锰无明显现象,过氧化氢在二氧化锰催化作用下生成水和氧气,过氧化氢溶液中加入二氧化锰产生气泡,可以鉴别,故A正确;
B、氢氧化钠固体溶于水放出热量,溶液温度升高,硝酸铵固体溶于水吸收热量,溶液温度降低,可以鉴别,故B正确;
C、硫酸和硝酸钡反应生成硫酸钡和硝酸,硫酸钠和硝酸钡反应生成硫酸钡和硝酸钠,均产生白色沉淀,不能鉴别,故C不正确;
D、一氧化碳通入紫色石蕊溶液中无明显现象,二氧化碳和水反应生成碳酸,显酸性,能使紫色石蕊溶液变红色,则二氧化碳通入紫色石蕊溶液中,溶液变红色,可以鉴别,故D正确。故选C。
9.A
【详解】A. 探究酸的种类对碳酸钙和酸反应速率的影响时,碳酸钙的颗粒大小应该相同; B. 探究温度对溶质溶解速率的影响,溶剂的种类和质量,溶质的种类和质量都相同;C. 探究影响铁生锈的有关因素 ,①②比较可证明铁生锈需要氧气,①③比较可证明铁生锈需要水, D. 铜片上的白磷与铜片上的红磷属于对照实验,都与氧气接触,都属于可燃物,变量是着火点不同,白磷着火点低,红磷着火点高,热水能达到白磷的着火点,达不到红磷的着火点,从而证明可燃物燃烧温度必须达到可燃物的着火点;选C
点睛:实验探究过程中要遵循控制变量原则,即对照的一组实验,只有研究因素不同,其它所有影响因素都要相同。
10.D
【详解】A、除去二氧化碳中的一氧化碳,不能用点燃的方法,应将混合气体通过灼热的氧化铜,从而将一氧化碳转化为二氧化碳,除去一氧化碳,故A选项不合理;
B、鉴别硬水和软水应该用肥皂水,故B选项不合理;
C、当集气瓶中氧气含量较低时,带火星木条也不会复燃,所以不能证明是否有氧气存在,故C选项不合理;
D、合金的硬度比其组分的大,互相刻画时能在纯金属表面留下痕迹,故D选项合理;
故答案选D。
11.正确
【详解】复分解反应实质是发生离子交换,一般要求在溶液中进行,正确。
12.错误
【详解】生锈的铁钉加入适量的稀盐酸后,铁锈中氧化铁和稀盐酸反应生成氯化铁,溶液会变成黄色,错误。
13.错误
【详解】若甲是锌,丙是氢气,则乙可能是盐酸或硫酸,故错误。
14.错误
【详解】在“甲+乙→丙+丁”反应中,若甲、乙、丙、丁均为化合物,则该反应不一定是复分解反应,例如二氧化碳和氢氧化钙反应生成碳酸钙和水;错误;
15.错误
【详解】通常氢氧化钠用作炉具清洁剂,不是纯碱,故错误。
16.(1) 氢/H 紫色石蕊试液(或Zn、Fe等较活泼金属,或Na2CO3、NaHCO3等)(合理即可)
(2) NaOH+HCl=NaCl+H2O NaCl、NaOH 放热
(3) MgSO4+Ba(OH)2=Mg(OH)2↓+BaSO4↓ Ca2+、Ba2+/ Ba2+、Ca2+
(4)解:设生成AaCl的质量为x,
x=28.7g
答:生成氯化银的质量为28.7g。
【详解】(1)阳离子全部为氢离子的化合物是酸,阴离子全部为氢氧根离子的化合物是碱,酸、碱的元素组成中都含有氢元素;检验某溶液是否呈酸性,根据酸的通性可选用的一种试剂是紫色石蕊试液(或Zn、Fe等较活泼金属,或Na2CO3、NaHCO3等)(合理即可),若石蕊变红(或有气泡产生),则溶液显酸性;
(2)①氢氧化钠与盐酸反应生成氯化钠和水,反应的化学方程式NaOH+HCl=NaCl+H2O;
②B点是温度最高的点A,温度逐渐下降所得,此时氢氧化钠过量,对应的溶液中溶质的成分是氯化钠(反应生成的)和NaOH(过量的);,根据右图可知,该反应属于放热反应;
(3)硫酸镁与氢氧化钡反应生成硫酸钡沉淀和氢氧化镁沉淀,氯化钙(氢氧化钡)与碳酸钠反应生成碳酸钙(碳酸钡)沉淀和氯化钠(氢氧化钠),过滤要放在所有的沉淀操作之后,碳酸钠要放在加氢氧化钡之后,可以将钙离子和过量的钡离子沉淀,最后再用盐酸处理溶液中的碳酸根离子和氢氧根离子。加入Ba(OH)2溶液时所发生反应的化学方程式为MgSO4+Ba(OH)2=Mg(OH)2↓+BaSO4↓;步骤③是为了除去溶液中的Ca2+、Ba2+;
(4)详见答案。
17.(1) 细口瓶 朝向手心
(2)2.33
(3)解:设废水样品中硫酸钠的质量为x
废水样品中硫酸钠的质量的质量分数为:
答:废水样品中硫酸钠的质量的质量分数为7.1%。
【详解】(1)氯化钡溶液是液体,应将氯化钡溶液保存在细口瓶中,故填细口瓶;倾倒液体时,为避免残液流下腐蚀标签,倾倒氯化钡溶液时,标签应朝向手心,故填朝向手心;
(2)由图可知,实验一中加入氯化钡溶液生成0.50g沉淀,实验二中加入等量的氯化钡溶液,生成的沉淀的总质量为1.00g,即等量的氯化钡反应后生成沉淀的质量为0.50g,实验五中加入等量的氯化钡溶液,如果氯化钡完全反应,生成沉淀的总质量为2.50g,实际生成沉淀的总质量为2.33g,则氯化钡没有完全反应,而硫酸钠完全反应,所以样品中硫酸钠完全反应时,生成沉淀的质量为2.33g,故填2.33;
(3)见答案。
18.(1)MgCl2+2NaOH =Mg(OH)2↓+2NaCl
(2) 氨气溶解于水显碱性,有利于溶液吸收二氧化碳 NaCl+NH3+CO2+H2O =NaHCO3↓+NH4Cl
(3)氨气/NH3
(4)
(5)打开K1、K2,关闭K3
(6)Na2CO3 +H2SO4=Na2SO4 + H2O+ CO2↑
(7) A 解:设10.6 g纯碱生成二氧化碳的质量为x
设10.6g碳酸氢钠与稀硫酸反应生成二氧化碳的质量是y
因为10.6 g样品生成CO2的质量为4.84g,故样品中一定含有相同质量比碳酸钠生成二氧化碳多的碳酸氢钠。
(8)W>0.234a
【详解】(1)除去氯化镁,是将之转化为沉淀而滤出,除杂的原则之一是不引入新的杂质,故用氢氧化钠溶液,化学方程式为:MgCl2+2NaOH =Mg(OH)2↓+2NaCl;
(2)在酸性或中性环境下二氧化碳溶解能力较低,碱性环境下二氧化碳溶解能力提高,氨气溶解于水显碱性,有利于溶液吸收二氧化碳。
反应物是氯化钠、氨气、二氧化碳、水,生成物是碳酸氢钠和氯化铵,反应的化学方程式是: NaCl+NH3+CO2+H2O =NaHCO3↓+NH4Cl;
(3)氯化铵能与熟石灰氢氧化钙反应生成氯化钙、水和氨气,氨气是反应的原料可循环利用;
(4)碳酸氢钠在加热的条件下反应生成纯净碳酸钠和水、二氧化碳,化学方程式为:;
(5)该实验通过吸收生成二氧化碳的质量计算确定物质的组成,为防止空气中二氧化碳对结果产生影响,则需要将装置内的空气替换为除去二氧化碳后的空气,则操作为打开K1、K2,关闭K3;
(6)样品中含有的碳酸钠与长颈漏斗内的稀硫酸发生反应,故装置B中一定发生的化学反应方程式为:Na2CO3 +H2SO4=Na2SO4 + H2O+ CO2↑;
(7)详见答案。
(8)根据,可知,每36.5份质量的氯化氢对应生成58.5份质量氯化钠。
设生成的氯化钠的质量为M
当W>M,既W>0.234a时,样品中一定含有NaCl。
19. HCl+NaOH═NaCl+H2O 氢离子和氢氧根离子 钠离子和氯离子 Na2CO3+2HCl═2NaCl+H2O+CO2↑ 碳酸根离子和氢离子 铜离子 硫酸根离子
【分析】根据氢氧化钠和盐酸反应生成氯化钠和水;碳酸钠溶液与过量稀盐酸混合,生成氯化钠、水和二氧化碳;铁与硫酸铜溶液反应生成硫酸亚铁溶液和铜,进行分析解答。
【详解】(1)氢氧化钠和盐酸反应生成氯化钠和水,反应的化学方程式为:HCl+NaOH═NaCl+H2O。属于中和反应,由氢氧化钠和盐酸的反应的微观示意图,实质是氢离子和氢氧根离子生成水分子,该反应中发生变化的微粒是氢离子和氢氧根离子;未发生变化的微粒是钠离子和氯离子。故填:HCl+NaOH═NaCl+H2O;氢离子和氢氧根离子;钠离子和氯离子
(2)碳酸钠溶液与过量稀盐酸混合,生成氯化钠、水和二氧化碳,反应的化学方程式为:Na2CO3+2HCl═2NaCl+H2O+CO2↑。实际参加反应的微粒是碳酸根离子和氢离子。故填:Na2CO3+2HCl═2NaCl+H2O+CO2↑;碳酸根离子和氢离子
(3)铁与硫酸铜溶液反应生成硫酸亚铁溶液和铜,反应的化学方程式为:Fe+CuSO4═FeSO4+Cu。溶液中实际参加反应的微粒是铜离子,溶液中的“旁观者”是硫酸根离子。故填:铜离子;硫酸根离子
【点睛】本题难度不大,掌握盐的化学性质、中和反应的原理、明确复分解反应的实质等是正确解答本题的关键。
20. NaOH Ba(OH)2/NaOH CaCO3 MgO HNO3 Cu(OH)2
【详解】(1)氢氧化钠固体具有潮解的性质,能够吸收气体中的水分,可以做干燥剂,其化学式为NaOH,故填NaOH。
(2)可溶性碱是氢氧化钡和氢氧化钠,其化学式分别为Ba(OH)2、NaOH,故填Ba(OH)2或NaOH。
(3)碳酸钙在加热的条件下反应生成氧化钙和二氧化碳,即加热有气体生成的物质是碳酸钙,其化学式为CaCO3,故填CaCO3。
(4)上述物质中,属于氧化物的是氧化铜,其化学式为CuO,故填CuO。
(5)上述物质中,属于酸的是硝酸,其化学式为HNO3,故填HNO3。
(6)上述物质在,一种蓝色不溶于水的碱是氢氧化铜,其化学式为Cu(OH)2,故填Cu(OH)2。
21. 二氧化钌 4 种 AD 3H2 + Ru2O32Ru + 3H2O
【详解】试题分析:
(1)RuO2 的名称类似于二氧化硅(SiO2)、二氧化硫(SO2)等氧化物,故应读作二氧化钌;
(2)在 Ru、RuO2、Ru2O3、RuCl3、K2RuO4 等 5 种物质中钌元素的化合价分别为 0、+4、+3、+3、+6 价,故总共有 4 种;
(3)化合物是由两种或两种以上的元素组成的纯净物;氧化物是由两种元素组成的化合物,其中一种为氧元素;碱是指在水溶液中电离出的阴离子全部都是氢氧根离子的化合物;盐是指一类金属离子或铵根离子(NH4+)与酸根离子结合的化合物。综上所述,K2RuO4 既属于化合物又属于盐,选 AD。
(4)类似于 H2 与氧化铜反应生成铜和水,故 Ru2O3 与 H2 反应生成的物质为 Ru 和 H2O,化学方△
程式为 3H2 + Ru2O3 2Ru + 3H2O。
考点:化学用语;化学方程式的书写
22. O2 NH4NO3 H2O H2CO3 Cu2(OH)2CO32CuO + H2O + CO2↑ 3Fe + 2O2 Fe3O4 Fe2O3+6HCl=2FeCl3+3H2O 黄色 CO2 +Ca(OH)2 =CaCO3↓+ H2O 减少 (NH4)2SO4+ Ca(OH)2= CaSO4+2NH3↑+2H2O 属于 湿润的红色石蕊试纸
【详解】(1) ①电解水正极产生的气体是氧气O2;②溶于水后使水温降低的物质是硝酸铵NH4NO3;③相对分子质量最小的氧化物是水H2O;④雪碧等汽水中含有的一种酸是碳酸H2CO3;
(2)①加热碱式碳酸铜分解为氧化铜、水和二氧化碳,化学方程式为Cu2(OH)2CO32CuO+ H2O + CO2↑;②铁丝在纯氧中燃烧生成四氧化三铁,化学方程式为3Fe + 2O2Fe3O4;③盐酸除铁锈是氯化氢和氧化铁反应生成氯化铁和水,化学方程式为Fe2O3+6HCl=2FeCl3+3H2O,因为溶液中含有三价铁离子,故溶液由无色变为黄色;④二氧化碳和氢氧化钙反应生成碳酸钙和水,化学方程式为CO2 +Ca(OH)2 =CaCO3↓+ H2O,该反应由氢氧化钙变成碳酸钙沉淀,溶液的质量较反应前减小;⑤硫酸铵与氢氧化钙生成硫酸钙、氨气和水,化学方程式为(NH4)2SO4+ Ca(OH)2= CaSO4+2NH3↑+2H2O,一水合氨不稳定,分解为氨气和水,该反应是两种化合物相互交换成分生成另两种物质,属于复分解反应,生成的气体为氨气,氨气可用湿润的红色石蕊试纸变蓝。
23. ③⑤⑨ ②④⑧ ⑦⑩
【分析】在水溶液中电离出的阳离子全部是氢离子的化合物为酸;
在水溶液中电离出的阴离子全部是氢氧根离子的化合物为碱;
金属阳离子或铵根离子和酸根阴离子构成的化合物为盐;
由两种元素组成,其中一种元素为氧元素的化合物为氧化物。
【详解】由分析可知:①NaCl属于盐,②NaOH属于碱,③HCl属于酸,④Ba(OH)2属于碱,⑤H2SO4属于酸,⑥Na2CO3属于盐,⑦H2O属于氧化物,⑧Cu(OH)2属于碱,⑨H3PO4属于酸,⑩CuO属于氧化物;因此③⑤⑨属于酸,②④⑧属于碱,⑦⑩属于氧化物。
初中人教版课题1 生活中常见的盐巩固练习: 这是一份初中人教版<a href="/hx/tb_c9873_t7/?tag_id=28" target="_blank">课题1 生活中常见的盐巩固练习</a>,共15页。试卷主要包含了选择题,判断题,综合应用题,填空与简答等内容,欢迎下载使用。
化学九年级下册课题1 生活中常见的盐随堂练习题: 这是一份化学九年级下册<a href="/hx/tb_c9873_t7/?tag_id=28" target="_blank">课题1 生活中常见的盐随堂练习题</a>,共16页。试卷主要包含了选择题,判断题,综合应用题等内容,欢迎下载使用。
初中化学人教版九年级下册课题1 生活中常见的盐课时作业: 这是一份初中化学人教版九年级下册课题1 生活中常见的盐课时作业,共13页。试卷主要包含了选择题,判断题,综合应用题等内容,欢迎下载使用。













