






所属成套资源:新教材适用2023_2024学年高中化学新人教版必修第一册全册课件(56份)
- 新教材适用2023_2024学年高中化学第2章海水中的重要元素__钠和氯第3节物质的量第3课时物质的量浓度课件新人教版必修第一册 课件 0 次下载
- 新教材适用2023_2024学年高中化学第2章海水中的重要元素__钠和氯第3节物质的量第4课时配制一定物质的量浓度的溶液课件新人教版必修第一册 课件 0 次下载
- 新教材适用2023_2024学年高中化学第2章海水中的重要元素__钠和氯阶段重点突破练4课件新人教版必修第一册 课件 0 次下载
- 新教材适用2023_2024学年高中化学第3章铁金属材料实验活动2铁及其化合物的性质课件新人教版必修第一册 课件 0 次下载
- 新教材适用2023_2024学年高中化学第3章铁金属材料微专题4氢氧化亚铁制备实验的改进课件新人教版必修第一册 课件 0 次下载
新教材适用2023_2024学年高中化学第2章海水中的重要元素__钠和氯阶段重点突破练3课件新人教版必修第一册
展开
这是一份新教材适用2023_2024学年高中化学第2章海水中的重要元素__钠和氯阶段重点突破练3课件新人教版必修第一册,共19页。
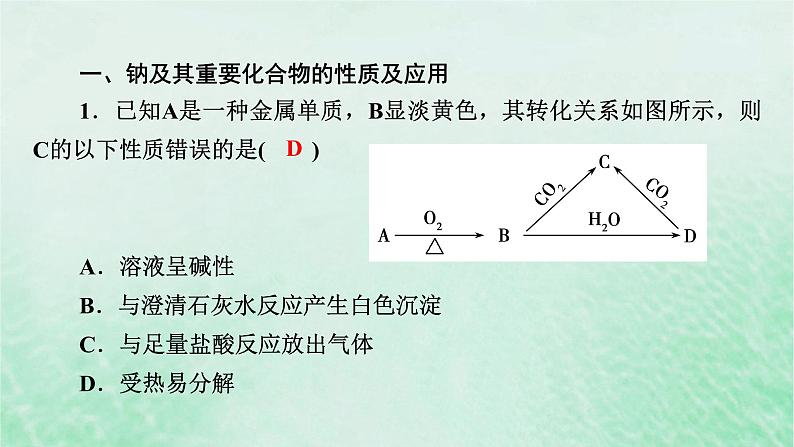
第二章 海水中的重要元素——钠和氯阶段重点突破练(三)一、钠及其重要化合物的性质及应用1.已知A是一种金属单质,B显淡黄色,其转化关系如图所示,则C的以下性质错误的是( )A.溶液呈碱性B.与澄清石灰水反应产生白色沉淀C.与足量盐酸反应放出气体D.受热易分解D解析: C为Na2CO3,Na2CO3水溶液呈碱性,A项正确;Na2CO3与澄清石灰水反应生成白色CaCO3沉淀,B项正确;NaCO3与足量盐酸反应生成CO2气体,C项正确;Na2CO3受热不分解,D项错误。2.我国化工专家侯德榜发明了“联合制碱法”,其生产过程中发生的反应主要是①NH3+CO2+H2O===NH4HCO3②NH4HCO3+NaCl===NaHCO3↓+NH4Cl在上述反应中没有涉及的基本反应类型是( )A.置换反应 B.化合反应C.分解反应 D.复分解反应解析:反应①为化合反应,反应②为复分解反应,反应③为分解反应,故选A。A3.下列关于钠及其化合物的性质说法错误的是( )A.为鉴别K2CO3和NaHCO3两种白色固体,可分别配成溶液,做焰色试验,观察火焰的颜色B.热稳定性、水中的溶解性以及与酸反应的速度都是Na2CO3<NaHCO3C.钠不可以从硫酸铜溶液中置换出铜D.Na2O与Na2O2的阴、阳离子个数比相同B4.某化合物加热时会放出一种气体并生成一种残渣,残渣能与稀盐酸反应放出相同的气体,该化合物可能是( )A.碳酸钠 B.碳酸氢钠C.氯酸钾 D.过氧化钠解析:碳酸钠、氯酸钾、过氧化钠受热均不产生CO2;碳酸氢钠受热分解生成CO2,与盐酸反应也产生CO2,故选B。B5.下列叙述中正确的是( )A.向含有CaCO3沉淀的水中通入CO2至沉淀恰好溶解,再向溶液中加入NaHCO3饱和溶液,又有CaCO3沉淀生成B.向Na2CO3溶液中逐滴加入稀盐酸(Na2CO3与HCl的质量比为106︰36.5),生成的CO2与原Na2CO3的质量比为44︰106C.等质量的NaHCO3和Na2CO3分别与足量盐酸反应,生成的CO2的质量后者多D.向Na2CO3饱和溶液中通入CO2,有NaHCO3结晶析出D6.将适量金属钠投入下列溶液中,有气体放出,但无沉淀生成的是( )A.盐酸 B.饱和氢氧化钠溶液C.FeCl3溶液 D.CuSO4溶液解析: 钠与盐酸反应生成氯化钠和氢气,没有沉淀生成,A正确;钠与饱和氢氧化钠溶液反应生成氢气和氢氧化钠,消耗溶剂水,同时溶质质量增加,溶液是过饱和溶液,有氢氧化钠沉淀析出,B错误;钠与氯化铁溶液反应生成氢氧化铁沉淀、氯化钠和氢气,C错误;钠与硫酸铜溶液反应生成硫酸钠、氢氧化铜沉淀和氢气,D错误。A二、钠及其化合物的相关实验7.把碱面溶化成碱水,放入发起的面团中,中和面团中多余的酸性,以制作各种面点。碱面即碳酸钠,又称苏打、纯碱,生活中还会用到小苏打,即碳酸氢钠。关于Na2CO3和NaHCO3的说法正确的是( )A.向两者的溶液中加入BaCl2均生成白色沉淀B.向两者的溶液中逐滴加入HCl,反应现象完全相同C.Na2CO3和NaHCO3两物质之间可以相互转化D.向饱和的Na2CO3溶液中通入足量的CO2气体,观察不到任何实验现象C8.如图所示的两个实验中,CuSO4溶液和FeCl3溶液较少,Na2O和Na2O2稍微过量。下列关于实验现象或反应原理的描述不正确的是( )A.两支试管中均发生两个化学反应B.两支试管中均产生有颜色的沉淀C.两支试管中均有无色气体生成D.反应后,两支试管过滤后所得溶液均为无色C解析: 两支试管中分别发生Na2O、Na2O2与水的反应,均有NaOH生成,继而发生NaOH与盐的反应,A项正确;两支试管中分别有Cu(OH)2蓝色沉淀和Fe(OH)3红褐色沉淀生成,B项正确;Na2O与水反应只生成NaOH,无气体生成,C项错误;由于FeCl3、CuSO4与NaOH反应时均消耗完,故反应后过滤所得的溶液均呈无色,D项正确。9.检验氯化钠溶液中混有氯化钾,常用焰色试验,下列操作顺序正确的是( )①蘸取待测液 ②置于酒精灯火焰上灼烧 ③透过蓝色钴玻璃观察 ④用稀盐酸洗净铂丝A.①②③④ B.④②①②③C.④①② D.①③②④B10.下列叙述正确的是( )A.NaHCO3受热易分解,因此可用于制胃酸中和剂B.将少量钠加入盛有水和盐酸的烧杯中,可比较水和盐酸中氢的活泼性C.按如图所示装置进行碳酸氢钠受热分解实验D.相同温度下,碳酸钠的溶解度小于碳酸氢钠的溶解度B11.Na2CO3纯度的分析:实验装置如图所示,装置B中盛有10.0 g的Na2CO3样品[假设杂质不参加反应,原容器中CO2含量可忽略不计,各装置内反应完全。实验室可供选择的试剂和药品还有锌粒、稀硫酸、CaCO3(s)、蒸馏水]。(1)装置A锥形瓶内盛有_______,装置A的作用是______________ _______________________________________________________________________________________________________。装置B分液漏斗中装有___________。(2)若无装置C,实验结果将_______(填“偏高”“偏低”或“无影响”)。装置E的作用是__________________________________________ _________________________________________________。(3)若实验后,装置D的质量增加3.96 g,则该Na2CO3样品的纯度为______________。锌粒装置A中生成的H2把装置B中产生的CO2气体都赶到装置D中,使装置B中的CO2气体全部被装置D中的碱石灰吸收稀硫酸偏高防止空气中的水蒸气、CO2等进入装置D中,使装置D中碱石灰的质量增加,对实验造成误差95.4%12.某同学拟用50 mL NaOH溶液吸收CO2气体制备Na2CO3溶液。为了防止通入的CO2气体过量生成NaHCO3,他设计了如下实验步骤:①用25 mL NaOH溶液吸收过量的CO2气体,至CO2气体不再溶解;②小火煮沸溶液1~2 min;③在得到的溶液中加入另一半(25 mL)NaOH溶液,使溶液充分混合。(1)他能否制得较纯净的Na2CO3溶液?_____。理由是____________ __________________________________________________________________________________________________。(2)按他的设计,第①步实验装置如图所示。装置A中使用的试剂是石灰石和盐酸。装置B使用的试剂是_______________________,作用是_______________________________。能用一半体积NaOH溶液反应生成NaHCO3,另一半体积NaOH和NaHCO3以1︰1反应正好生成Na2CO3饱和NaHCO3溶液除去CO2气体中的HCl气体(3)有人认为实验步骤②③的顺序对调,即先混合再煮沸更合理,你认为对吗?_______。为什么?_________________________________。解析:用NaOH溶液与CO2气体制备Na2CO3溶液,不能直接通过吸收CO2气体来制备,因为若CO2气体过量则混有NaHCO3杂质;若CO2气体不足,则有部分NaOH不能转化为Na2CO3。因而应当将一半NaOH与过量CO2气体反应生成NaHCO3,再与另一半NaOH恰好反应,全部生成Na2CO3。不对多余的CO2不除去会有NaHCO3生成






