





化学选择性必修1第三节 盐类的水解评课ppt课件
展开这是一份化学选择性必修1第三节 盐类的水解评课ppt课件,共35页。PPT课件主要包含了一盐的分类,盐的水解等内容,欢迎下载使用。
酸+碱==盐+水(中和反应)
NaCl、 K2SO4
FeCl3、NH4Cl
CH3COONH4、(NH4)2CO3
CH3COONa、K2CO3
根据形成盐的酸、碱的强弱来分,盐可以分成哪几类?
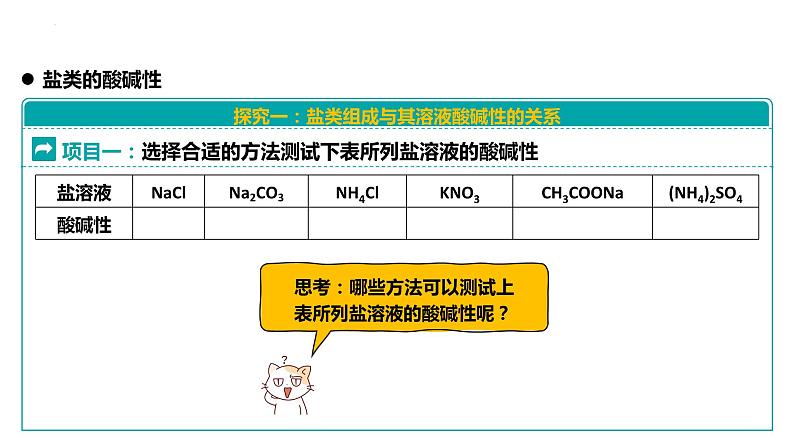
【练习】将下列8种盐:NaCl、FeCl3、K2SO4、(NH4)2SO4、Na2CO3、(NH4)2CO3、CH3COONa、CH3COONH4 ,按生成盐的酸、碱的强弱分类,填入下列空白处。
FeCl3、 (NH4)2SO4
Na2CO3、CH3COONa
(NH4)2CO3、CH3COONH4
项目一:选择合适的方法测试下表所列盐溶液的酸碱性
c(H+)=c(OH-)
c(H+)>c(OH-)
c(H+)
练习2、 等物质的量浓度、等体积的酸HA与碱NaOH混合后,溶液的酸碱性是( )A、酸性 B、中性 C、碱性 D、碱性或中性
二、盐溶液呈现不同酸碱性的原因
上述盐既不能电离出H+,也不能电离出OH-,它们的水溶液为什么有的显酸性,有的显碱性呢?
【探究1】NaCl溶液为什么呈中性?
c(H+) = c(OH-)
c(Na+) = c(Cl-)
NaCl电离产生的Na+ 和Cl– 均不能与水电离产生的H+ 和 OH– 相互作用生成弱电解质。即加NaCl后不影响水的电离平衡。
NaCl Cl– + Na+
H2O H+ + OH–
【探究2】NH4Cl溶液为什么呈酸性?
c(H+) =c(OH-)
NH4Cl电离出来的NH4+能与水电离出来的OH–结合生成弱电解质—NH3·H2O,使水的电离平衡向右移动,最终使得溶液中c(H+)>c(OH-),溶液呈酸性。
总反应为:NH4Cl +H2O ⇌NH3·H2O + HCl
【探究3】CH3COONa溶液为什么呈碱性?
CH3COONa电离出来的CH3COO-能与水电离出来的H+ 结合生成弱电解质—CH3COOH,使水的电离平衡向右移动,最终使得溶液中c(H+) <c(OH-),溶液呈碱性。
总反应为:CH3COONa+H2O ⇌CH3COOH +NaOH
思考:同样为盐溶液,CH3COONa、NH4Cl两种溶液,却表现出不同的酸碱性,其根本原因是什么?
3.盐溶液呈现不同酸碱性的原因
在水溶液中,盐电离出来的离子与水电离出来的H+或OH—结合生成弱电解质的反应 。
盐易溶,有弱离子(弱酸阴离子或弱碱阳离子)。
⑵ 水解吸热:盐类水解是中和反应的逆反应,升温促进水解。
⑶ 水解程度很微弱:水解产物很少。一般不用“↑”或“↓”
口诀2:有弱才水解, 无弱不水解
Na2CO3=2Na++CO32-
H2O ⇌ OH- +H+
CO32-+H2O ⇌OH-+HCO3-
HCO3-+H2O ⇌OH-+H2CO3
Na2CO3的水解分两步进行,第一步是CO32-与水电离出来的H+结合生成HCO3-,第二步是HCO3-又与H+结合生成H2CO3,使水的电离平衡向右移动,最终使得溶液中c(H+) <c(OH-),溶液呈碱性。
第一步水解后溶液显碱性,抑制了第二步水解,故第一步的水解程度远远大于第二步,平衡时H2CO3的浓度很小,不会放出CO2气体。
【课堂练习】由一价离子组成的四种盐溶液:AC、BD、AD、BC各1 ml·L-1,在室温下,前两种溶液的pH=7,第三种溶液的pH>7,最后一种溶液的pH<7,则下列说法正确的是( )
无弱不水解,同强显中性
谁弱谁水解,谁强显谁性
都弱双水解,同弱显中性,谁(较)强显谁性
问题2:NaCl溶液与CH3COONH4溶液都显中性,那么两溶液中水的电离程度相同么?
问题1:查阅资料可知,CH3COOH和NH3·H2O的电离常数几乎相等,请问CH3COONH4溶液显啥性?为什么?
越弱越水解,同弱的情况,水解产生的c(H+)=c(OH-),故显中性
不相同,CH3COONH4溶液中水的电离程度大
盐类的水解可以看作酸碱中和反应的逆过程。
【课堂练习】写出以下溶液的水解离子方程式。
①NH4Br②Al2(SO4)3③NaF④FeCl3⑤NaClO⑥NaHCO3⑦NaAlO2⑧Na2S
2、多元弱酸,其酸根离子的水解是分步进行的,水解反应必须分步表示,不能合并,以第一步为主,第二步很微弱。
3、多元弱碱阳离子的水解也是分步进行的,但通常简化为一步表示。
(1)一般的双水解( ⇌ ):不能同时产生沉淀和气体,水解程度不是很大,阴阳离子仍能在溶液中大量共存的,如NH4HCO3、(NH4)2CO3
例:CH3COO– + NH4+ + H2O ⇌ CH3COOH + NH3·H2O
(2)完全双水解( =):若同时产生沉淀和气体,水解趋于完全,阴阳离子不能在溶液中大量共存的,用“ =”、“↑”、“↓”。
①Al3+ 与 AlO2-、CO32-、HCO3- 、 HS-、S2-、SiO32-② Fe3+ 与 AlO2-、CO32-、HCO3-③ NH4+ 与 SiO32-、AlO2-
例:Al3++3HCO3- ═ Al(OH)3↓+3CO2↑
2Al3+ + 3S2- + 6H2O = 2Al(OH)3↓+3H2S↑
2Al3+ + 3CO32- + 3H2O = 2Al(OH)3↓+3CO2↑
Al3+ + 3AlO2- + 6H2O = 4Al(OH)3↓
Al3+ + 3HCO3-= Al(OH)3↓+3CO2 ↑
双水解的离子方程式的书写: (1) Al3+ 与 CO32- (2) Al3+ 与 HCO3- (3) Al3+ 与 S2- (4)Al3+ 与 AlO2-
练习、 下列溶液中离子间能大量共存的是( )A、K+、Na+、HCO3-、OH- B、NH4+、Na+、CO32-、Cl-C、Al3+、K+、HCO3-、SO42- D、Fe3+、NH4+、SCN-、Cl-
HCO3-+OH-=CO32-+H2O
NH4+与CO32- 属于不完全双水解
Al3++3HCO3-=Al(OH)3↓+3CO2↑ 完全双水解
Fe3++3SCN-=Fe(SCN)3
H2O + AlO2- + HCO3- = Al(OH)3↓ + CO32-
不是双水解!属于较强制较弱原理!
思考:将NaAlO2溶液和 Na HCO3溶液混合后出现白色沉淀,写出其离子反应方程并判断是否发生了双水解。
多元弱酸酸式酸根的水解与电离的区别
电离<水解,呈碱性:NaHCO3、NaHS、 Na2HPO4电离>水解,呈酸性:如 NaHSO3、NaH2PO4
电离:HCO3- ⇌ H+ + CO32- (显酸性)水解:HCO3- + H2O ⇌ H2 CO3 + OH- (显碱性)电离<水解,呈碱性
电离:HSO3- ⇌ H+ + SO32- (显酸性)水解:HSO3- + H2O ⇌ H2 SO3 + OH- (显碱性)电离>水解,呈酸性:
当水解达到平衡时,溶液中还存在以下关系:
将以上关系代入Kh的表达式,得到如下关系:
思考:25 ℃时,CH3COOH的电离常数 Ka=1.75×10-5,HClO的电离常数Ka=2.98×10-8,比较同浓度时CH3COONa溶液与NaClO溶液碱性。
同浓度的醋酸钠和次氯酸钠溶液中,次氯酸钠溶液的碱性更强
酸碱电子理论,也称广义酸碱理论、路易斯酸碱理论,它认为:凡是可以接受外来电子对的分子、基团或离子为酸;凡可以提供电子对的分子、离子或原子团为碱。它认为酸碱反应的实质是形成配位键生成酸碱配合物的过程。
练习1、在溶液中,不能发生水解的离子是( )A、ClO – B、CO3 2–C、Fe 3+ D、SO4 2–
练习2、下列物质分别加入到水中,因促进水的电离而使溶液呈酸性的是( )A、硫酸 B、NaOH C、硫酸铝 D. 碳酸钠
练习3、下列关于盐类水解反应说法正确的是( )A、任何盐都可发生水解反应B、盐只能发生水解反应而不能发生其他反应C、盐水解反应肯定能破坏水的电离平衡且促进水的电离D、盐的水溶液为中性时,则盐一定不发生水解反应
相关课件
这是一份化学人教版 (2019)第三节 盐类的水解集体备课ppt课件,共24页。PPT课件主要包含了复习导入,生成的盐,强酸强碱盐,强酸弱碱盐,强碱弱酸盐,弱酸弱碱盐,生成NH3·H2O,促进水的电离,总反应,离子方程式等内容,欢迎下载使用。
这是一份高中第二章 化学反应速率与化学平衡第二节 化学平衡集体备课ppt课件,共25页。PPT课件主要包含了增大反应物的浓度,降低温度,增大压强,使用催化剂,ACDF,催化剂,向正反应方向,气体体积的变化,平衡曲线,平衡点等内容,欢迎下载使用。
这是一份苏教版 (2019)选择性必修1第三单元 盐类的水解一等奖ppt课件,共29页。PPT课件主要包含了核心素养发展目标,学习目标,课前导入,盐溶液的酸碱性,NH4Cl,习题研究,课堂总结等内容,欢迎下载使用。













