



高中化学苏教版 (2019)必修 第一册第三单元 人类对原子结构的认识备课ppt课件
展开人类认识原子结构的历程
感觉上,存在的是缤纷的色彩, 浓郁的芬芳, 深深的苦痛,但是实际上,存在的只是原子和空间。 ——德谟克利特
古希腊哲学家德谟克利特 ——“原子论”创始者他认为物质由原子构成,原子不可分割。
《庄子》载惠子之语曰:“一尺之棰,日取其半,万世不竭。”
惠施认为:物质可以无限可分的。
19世纪初,英国科学家道尔顿——原子学说,认为原子是实心球体。1897年,英国物理学家汤姆生——发现原子中存在电子
道尔顿 (1766—1844)
他提出——葡萄干面包式原子模型。
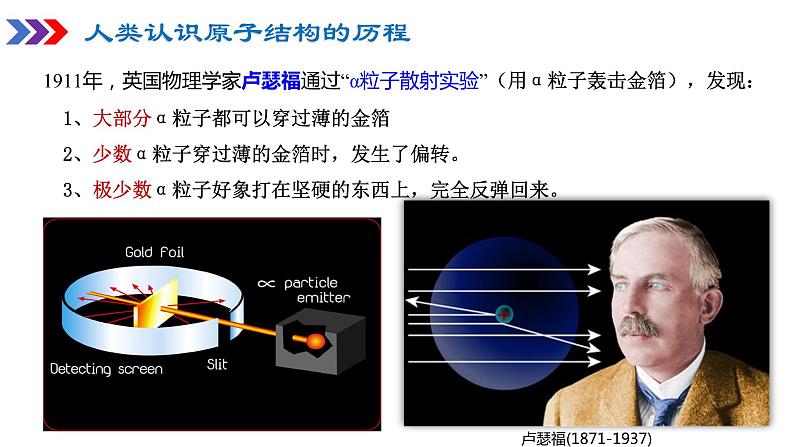
1911年,英国物理学家卢瑟福通过“α粒子散射实验”(用α粒子轰击金箔),发现: 1、大部分α粒子都可以穿过薄的金箔 2、少数α粒子穿过薄的金箔时,发生了偏转。 3、极少数α粒子好象打在坚硬的东西上,完全反弹回来。
卢瑟福(1871-1937)
卢瑟福推测原子中心存在原子核,带正电。电子带负电,在其周围高速运转,就像行星围绕太阳运转一样。 ——有核模型或行星模型。
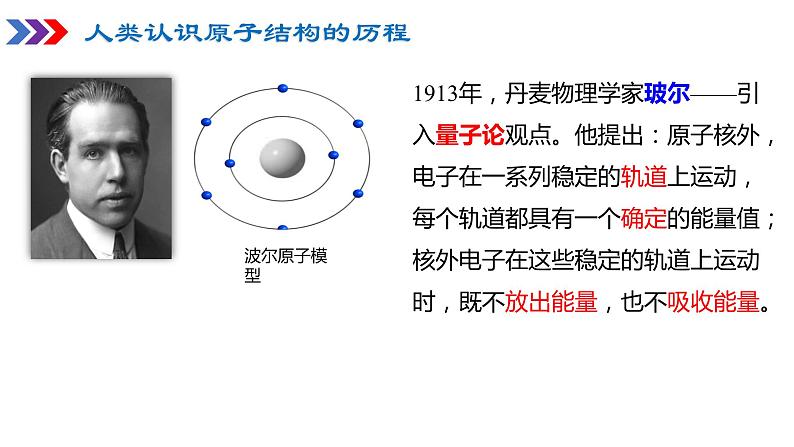
1913年,丹麦物理学家玻尔——引入量子论观点。他提出:原子核外,电子在一系列稳定的轨道上运动,每个轨道都具有一个确定的能量值;核外电子在这些稳定的轨道上运动时,既不放出能量,也不吸收能量。
20世纪初——电子云模型:电子在核外很小的空间内做高速运动,没有确定的轨道。
道尔顿模型(1803),不可再分实心球,研究大气物理性质提出; 汤姆生模型(1904),葡萄干面包式原子,发现电子后提出的;卢瑟福模型(1911),有核或行星运转式原子模型,α粒子散射实验提出 玻尔模型(1913),玻尔轨道式原子模型,研究氢原子光谱提出 电子云模型(1935),近代量子力学原子模型
1.如图所示的原子结构模型的演变图中,(1) 道尔顿实心球式原子模型,(2) 卢瑟福行星运转式原子模型,(3) 汤姆生葡萄干面包式原子模型,(4) 近代量子力学原子模型,(5) 玻尔轨道式原子模型。其中符合历史演变的顺序为 。
(1)(3)(2)(5)(4)
2. 下列实验事实与原子结构模型建立的关系正确的是( )A.电子的发现:道尔顿的原子结构模型 B.α粒子散射:卢瑟福原子结构模型C.α粒子散射:玻尔原子结构模型 D.氢原子光谱:卢瑟福原子结构模型
一个质子带一个单位正电荷
一个电子带一个单位负电荷
质子数=核电荷数=核外电子数=原子序数
拓展视野夸克 原子由质子、中子、电子等基本粒子构成。那么,基本粒子可不可以再分呢?1964年,美国科学家盖尔曼(M.Gellman)提出质子、中子由更小的夸克构成,建构了夸克模型。该模型能解释许多事实,引起了人们的普遍关注。1967年,以弗里德曼(J.Fruideman)、肯达尔(H.Kendall)、秦勒(R.Taylr)为核心的研究小组,在美国斯坦福大学直线加速器中心进行实验,证明了夸克的存在。这三位科学家因此获得了1990年诺贝尔物理学奖。 但迄今为止,人们尚未能分离出单个的夸克。美国科学家戴维·格罗斯()、戴维。波利策()和弗兰克·维尔切克(F.Wilczek)发现当夸克相距很近时相互作用力很小,但当距离增大时相互作用力急剧增大。这解释了人们在寻找单个夸克时遭遇的图境。这三位科学家因此获得了2004年诺贝尔物理学奖。
跟质子、中子相比,电子质量很小,通常忽略不计,原子的质量主要集中在原子核上。
原子核的体积只占原子体积的几百万亿分之一
质子和电子电量相等,电性相反
观察表格 ,思考下列问题
质子数、电子数不同。
氢原子的中子数为0,因此,不是所有的原子都有中子。
质子数 = 电子数 = 核电荷数 ; 中子数不一定等于电子数。
讨论:由表中数据分析12C中的12是什么意思呢?
将原子核内所有的质子和中子的相对质量取整数,加起来所得到的数值。用 A 表示。
质量数(A)=质子数(Z)+中子数(N)
意义:表示质子数为Z,质量数为A的一种X原子
12C原子是指质子数和中子数都是6的碳原子
1. 某些建筑材料中含有放射性元素氡(Rn),会对人体产生一定危害。Rn的中子数和质子数之差是( ) A.136 B.50 C.86 D.222
2. 据报道,最近中科院的有关专家在世界上首次发现了镤元素的一种新的同位素 ,它的中子数为( ) A.330 B.91 C.239 D.148
氕 氘 氚
氢气:H2 D2 T2
水:H2O D2O T2O
水 重水 超重水
“元素”是指具有相同核电荷数(即质子数)的同一类原子的总称。其中的“同一类”该如何理解的?
比如: 都是氢元素
同种元素:原子的原子核中质子数________。同种元素:原子的原子核中中子数可以 _________。同种元素:
可以有 ______ 种不同原子。
1. 核素:具有一定数目质子和一定数目中子的一种原子
2. 核素的表示方法:
大多数元素存在多种核素
(1)“六同”“三不同”:
3. 同位素:质子数相同而中子数不同的同一元素的不同原子
(2)同位素的应用①14C在考古工作中用于测定文物的年代;②235U用于制造原子弹、核发电;③2H、3H用于制造氢弹;④放射性同位素释放的射线可用于育种、治疗恶性肿瘤等。
②化学性质几乎完全相同,物理性质略有差别
H2 和D2 是两种不同的单质,化学性质基本相同。
H2O 和 D2O 是两种不同的化合物,化学性质基本相同。
③天然存在的同位素,相互间保持固定的比率
④绝大多数元素具有同位素,原子种类远大于元素种类
①同位素在周期表里占据同一位置;
⑥核素、同位素之间的转换既不属于化学变化,也不属于物理变化。
⑦H2O和D2O混合仍然是纯净物。
例:232Th可以转化成233U
⑤决定元素种类、核素种类的因素
现有下列八种化学符号:1H;2H;14C;6Li; 23Na;14N;7Li;24Mg。 (1)涉及的核素共有________种。 (2)互为同位素的是________和________,________和________。 (3)质量数相等,但不能互称为同位素的是________和________。 (4)中子数相等,但质子数不相等的是________和________。
由波尔轨道理论我们知道原子核外电子在一系列稳定的轨道上运动,每个轨道都有一个确定的能量值。它们在原子核外又是怎么运动的呢?
能量低的电子在离核近的区域内运动,能量高的电子在离核远的区域内运动 ,可以认为电子在原子核外是分层排布的,又叫电子层,分别用n=1、2、3、4、5、6、7…表示,分别称为K、L、M、N、O、P、Q…电子层
电子层离核由近及远,能量由低到高
K、L、M、N、O、P、Q
为了形象、简单的表示原子的结构,人们就创造了“原子结构示意图”这种特殊的图形。
电子在原子核外排布时,总是尽量先排在能量最低的电子层,然后由内向外依次排布在能量较高的电子层。(能量最低原理)
即电子最先排K层,当K层排满后,再排L层等
各电子层最多能容纳的电子数为2n2
最外电子层最多只能容纳8个电子(K层为最外层时,最多只能容纳2个电子)
次外电子层最多只能容纳18个电子
稀有气体元素原子电子层排布
分析稀有气体的核外电子排布,结合其化学活动性,你发现了什么?
稀有气体元素原子中最外电子层都已经填满,形成了稳定的电子层结构。
原子容易失去电子或得到电子转化为最外电子层上为8(有些为2)个电子的稳定结构。
原子最外层有8个电子(He为2)处于稳定状态,既不容易失去电子又不容易得到电子,化学性质稳定。
(如He、Ne、Ar)
(如易失电子的金属元素、易得电子的非金属元素)
每个Mg失去2个电子形成与Ne一样的稳定电子层结构的Mg2+,每个O得到2个电子形成与Ne一样的稳定电子层结构的O2-,带正电荷的Mg2+与带负电荷的O2-相互发生电性作用,形成稳定的MgO。
在化学反应过程中,原子核不发生变化,原子的最外层电子数会发生变化。
元素的化学性质主要由最外层电子数决定
离子:质子数 = 核外电子数
宏观:氧气和金属镁反应生成氧化镁,氧化镁是氧元素与镁元素相结合的产物。
2Mg+O2 = 2MgO
核外电子数=核电荷数(质子数)-电荷数
核外电子数=核电荷数(质子数)+电荷数
金属Na、Mg分别与非金属单质O2、Cl2发生反应,生成氧化物和氯化物,填写下面表格,写出其化学式。
化学式:NaCl Na2O MgO MgCl2
数据关系质量关系:质量数(A)=_____________+_____________。电性关系:原子:核电荷数=____________=____________;阴离子:核外电子数=____________+____________;阳离子:核外电子数=____________-____________ 。
苏教版 (2019)必修 第一册专题1 物质的分类及计量第一单元 物质及其反应的分类教学演示ppt课件: 这是一份苏教版 (2019)必修 第一册专题1 物质的分类及计量第一单元 物质及其反应的分类教学演示ppt课件,共40页。PPT课件主要包含了物质的分类等内容,欢迎下载使用。
苏教版 (2019)第三单元 人类对原子结构的认识评优课课件ppt: 这是一份苏教版 (2019)第三单元 人类对原子结构的认识评优课课件ppt,共35页。PPT课件主要包含了学习目标,活动方案,课堂反馈等内容,欢迎下载使用。
高中化学苏教版 (2019)必修 第一册第三单元 人类对原子结构的认识备课ppt课件: 这是一份高中化学苏教版 (2019)必修 第一册第三单元 人类对原子结构的认识备课ppt课件,共43页。













