





高中化学第一节 钠及其化合物教学ppt课件
展开当发生火灾时,我们一般选择用水或者二氧化碳灭火,但今天我们可以用水和二氧化碳生火,即滴水生火和吹气生火小魔术。同学们是否相信?
请同学们观看:老师这里有一团脱脂棉,现在将它放在石棉网上,向脱脂棉吹气,观察现象。然后取一团新的脱脂棉,在脱脂棉上滴加几滴水,观察发生的现象。
其实滴水生火和吹气生火与钠的其中一种化合物有关,那么钠的这些化合物具体有怎样的性质呢?是钠的哪种化合物可以滴水生火呢?这就是今天我们要学习的:钠的化合物。
姓名:过氧化钠肤色:淡黄色国籍:过氧化物 共和国体重:78性格:活泼,爱憎分明,一见到二氧化碳,脸色就变,一落水就非常生气
简历:中学毕业后参军,后调海军某潜艇当班长,负责制造氧气,复原后,在立白化工厂当工人,曾与氯气,二氧化硫等一起光荣出席全国漂白积极分子群英会,多次获得反黑模范称号。
通过实验探究了解过氧化钠的性质。 了解过氧化钠性质,了解其应用。掌握焰色试验,领会化学的魅力
第2课时 钠的氧化物
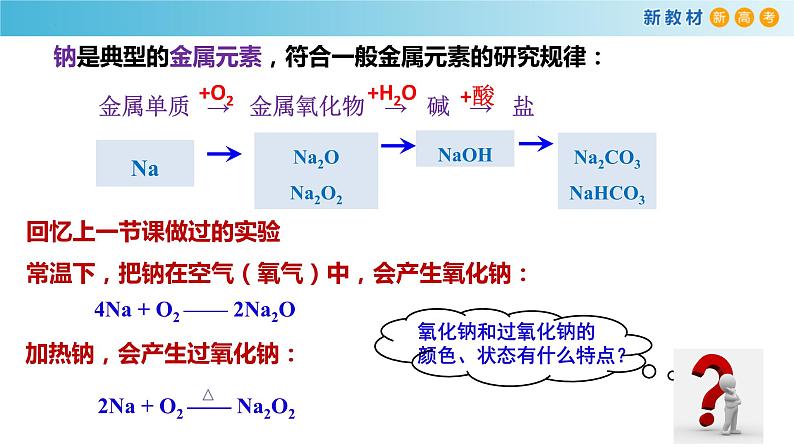
钠是典型的金属元素,符合一般金属元素的研究规律:
Na2CO3NaHCO3
回忆上一节课做过的实验常温下,把钠在空气(氧气)中,会产生氧化钠:
4Na + O2 —— 2Na2O
加热钠,会产生过氧化钠:
【思考与讨论】 (1)根据前面做过的实验,描述氧化钠和过氧化钠的颜色、状态。 (2)从物质分类的角度来看,氧化钠和过氧化钠都属于 氧化物。故氧化钠与氧化钙性质类似。请写出氧化钠与H2O、 CO2 、盐酸发生反应的化学方程式。
一。氧化钠与过氧化钠性质
1.氧化钠(Na2O)--碱性氧化物(1)与水反应: Na2O+H2O==2NaOH (2)与酸性氧化物反应: Na2O+CO2==Na2CO3 (3)与酸反应: Na2O+2HCl==2NaCl+H2O
【思考】 Na2O2是否同Na2O一样也能与水、CO2、盐酸反应?产物是否相同?
把1~2 mL水滴入在盛有1~2 g 过氧化钠固体的试管中,立即用带火星木条的伸入试管口,检验生成的气体。用手轻轻触摸试管外壁,有什么感觉?用 pH试纸检验溶液的酸碱性。
有气泡产生,反应放热,放出的气体能使带火星的木条复燃,溶液滴到pH试纸,试纸变蓝色。
2Na2O2 + 2CO2 = 2Na2CO3+O2
过氧化钠能与二氧化碳的反应吗?
取一小块脱脂棉与石棉网上,再取半角匙过氧化钠粉末至于脱脂棉上,小心包裹后,向包有过氧化钠的脱脂棉吹气。观察现象。
过氧化钠和二氧化碳反应放热,生成氧气和碳酸钠。
氧化钠能与二氧化碳反应生成碳酸钠 :Na2O + CO2 = Na2CO3
2Na2O2 + 2H2O —— 4NaOH + O2↑
2Na2O2 + 2CO2 —— 2Na2CO3 + O2
2Na2O2 + 2H2O = 4NaOH +O2↑
2Na2O2+2H2O=4NaOH+O2↑
1.指出过氧化钠与水反应中的氧化剂和还原剂
2Na2O2 + 2CO2 = 2Na2CO3+O2
2.指出过氧化钠与二氧化碳反应中的氧化剂和还原剂
类比Na2O2与水的反应,写出其与盐酸的反应方程式。
2Na2O2+2CO2=2Na2CO3+O2
2Na2O2+4HCl=4NaCl+2H2O+O2
思考1: Na2O2是不是碱性氧化物?
不是,Na2O2是过氧化物。
思考2:如何理解Na2O、Na2O2性质上的差异?
在Na2O2中,氧是-1价介于氧的两种较稳定化合价0和-2之间,因此Na2O2既可以在一定条件下获得电子表现氧化性又可以在一定条件下表现还原性,还可以在一定条件下发生自身氧化还原反应,但主要以氧化性为主。
2Na2O2 + 2H2O=4NaOH + O2↑
物质 氧化钠 过氧化钠化学式 氧元素化合价色、态阳离子、阴离子个数比
Na2O2 的阳离子、阴离子个数比为什么是2:1?
Na2O2可以拆成2个Na+和1个O22-(过氧根离子是原子团)
2Na2O2 + 2H2O = 4NaOH + O2↑
2Na2O2 + 2CO2 = 2Na2CO3 + O2
3.Na2O2的强氧化性与还原性
从元素化合价角度分析Na2O2的性质:过氧化钠中的氧是-1价,处于中间价态,既能表现氧化性,又能表现还原性。
(1)强氧化性①与Na2SO3溶液反应: Na2O2+Na2SO3+H2O===Na2SO4+2NaOH ②有强氧化性,具有杀菌、消毒、漂白的作用。 如能使品红溶液褪色。(2)还原性 遇KMnO4等强氧化剂时,Na2O2表现出还原性, 氧化产物为O2。(3)遇CO2、H2O、H+时,Na2O2发生自身的氧化还原反应,氧元素的歧化反应。此时,Na2O2既是氧化剂又是还原剂。
过氧化钠的漂白性——强氧化性
在以上反应中Na2O2 既作氧化剂,又作还原剂。Na2O 属于碱性氧化物,而Na2O2不属于碱性氧化物,属于过氧化物,主要表现出强氧化性。
根据过氧化钠的性质,猜测其用途。
⑵常作漂白剂,漂白织物、
⑴强氧化剂(消毒、杀菌)
(3)过氧化钠可在呼吸面具或潜水艇中作为氧气的来源。(性质决定用途)
拓展:1.氧气还有哪些制备方法?用过氧化钠制备氧气有什么优点? 2.课后查阅文献,了解过氧化钠的更多用途。
【学习任务二】过氧化钠用途
1.(1)金属钠着火时,能否用H2O或CO2灭火?为什么?
提示:不能。钠着火生成Na2O2,Na2O2与H2O、CO2均反应产生O2助燃,应用沙子等与之不反应的物质进行灭火。
(2)白色的Na2O粉末中若混有少量的Na2O2,如何进行检验?
提示:取少量白色粉末于试管中,滴加少量水,若有气体生成,则说明含有Na2O2。
(2)将一定量的Na2O2、Na2O分别加入滴有酚酞溶液的水中,二者现象是否相同?
提示:不同。将Na2O2加入滴有酚酞溶液的水中观察到有气体生成,溶液先变为红色后褪色;而Na2O加入滴有酚酞溶液的水中只观察到溶液变为红色。
2.对于反应:2Na2O2+2H2O===4NaOH+O2↑,下列说法中正确的是( )A.Na2O2是氧化剂,H2O是还原剂B.Na2O2和Na2O长期置于空气中,最终产物相同C.当生成1分子O2时,转移的电子数为4D.每有18 g H2O与足量Na2O2反应,则固体增重4 g
3.下列对于Na2O、Na2O2的比较正确的一项是( )A.Na2O2、Na2O都是钠的氧化物,都是碱性氧化物B.Na2O、Na2O2都是易溶于水(与水反应)的白色固体C.Na2O2在和CO2的反应中既是氧化剂又是还原剂D.Na2O2、Na2O均可作供氧剂
4.球形干燥管A中为块状CaCO3,B中为淡黄色粉末,C中为固体CaCl2,并将A、B、C按如图所示连接,当打开活塞(Ⅰ)(Ⅱ)时,D中蜡烛火焰明亮;打开活塞(Ⅰ)(Ⅲ)时,D中蜡烛火焰熄灭;关闭活塞(Ⅰ)时,A中反应自行停止。
问题探究:(1)写出A中反应的离子方程式。(2)打开活塞(Ⅰ)(Ⅱ)时,D中蜡烛火焰明亮的原因是什么?(3)打开活塞(Ⅰ)(Ⅲ)时,D中蜡烛熄灭的原因是什么?⑷关闭活塞(Ⅰ)时,A中反应为什么会自行停止?
[答案] (1)CaCO3+2H+===Ca2++CO2↑+H2O(2)A中产生的CO2与Na2O2反应生成了O2(3)干燥CO2使蜡烛火焰熄灭
5.分别向下列溶液中加入少量的过氧化钠固体,不会出现浑浊的是 ( )A.Na2CO3溶液 B.FeCl3溶液C.饱和Ca(OH)2溶液D.CuSO4溶液
6.把8.8 g CO2通过一定质量的固体Na2O2后,收集到6.0 g 气体,则这6.0 g气体是( )A.m(O2)=6.0 g B.m(O2)=4.8 g,m(CO2)=1.2 gC.m(O2)=2.6 g,m(CO2)=3.4 g D.m(O2)=1.6 g,m(CO2)=4.4 g
7.下列有关Na2O2的说法不正确的是( )A.向包有Na2O2粉末的脱脂棉上滴加几滴水,脱脂棉剧烈燃烧起来,说明Na2O2与H2O反应放热且有氧气生成B.Na2O2与CO2反应时有单质O2生成,该反应属于置换反应C.Na2O2在空气中久置变白,涉及有氧化还原反应D.Na2O2粉末加入Ca(HCO3)2溶液中,产生气体和浑浊【答案】B
8.下列关于钠和过氧化钠与水反应的说法不正确的是( )①将小块钠投入滴有石蕊溶液的水中,反应后溶液变红②将钠投入稀盐酸中,钠先与水反应,后与盐酸反应③过氧化钠投入到水中会有大量氢气产生④过氧化钠投入到滴有酚酞溶液的水中,烧杯中的水变红A.仅①②B.仅②③C.仅②③④D.①②③④【答案】D
人教版 (2019)必修 第一册第一节 钠及其化合物教学课件ppt: 这是一份人教版 (2019)必修 第一册第一节 钠及其化合物教学课件ppt,共31页。PPT课件主要包含了素养要求,课堂检测等内容,欢迎下载使用。
化学必修 第一册第一节 钠及其化合物教学课件ppt: 这是一份化学必修 第一册第一节 钠及其化合物教学课件ppt,共23页。PPT课件主要包含了学习目标等内容,欢迎下载使用。
人教版 (2019)必修 第一册第一节 钠及其化合物教学课件ppt: 这是一份人教版 (2019)必修 第一册第一节 钠及其化合物教学课件ppt,共28页。PPT课件主要包含了钠灯火辉煌,学习目标,认识钠等内容,欢迎下载使用。













