



化学必修 第一册第一节 钠及其化合物优质课件ppt
展开【考纲要求】1.掌握钠的几种化合物的主要性质;2.了解焰色反应及其用途。
【思考与讨论】1.回忆前面做过的实验,描述氧化钠和过氧化钠的颜色、状态。 氧化钠,白色固体;过氧化钠,淡黄色固体。 2.氧化钠与水的反应和氧化钙与水的反应类似,请写出氧化钠与水反应的化学方程式。 Na2O+H2O===2NaOH 从物质分类的角度看,氧化钠、过氧化钠都属于氧化物,氧化钠是碱性氧化物, 而过氧化钠是特殊氧化物。
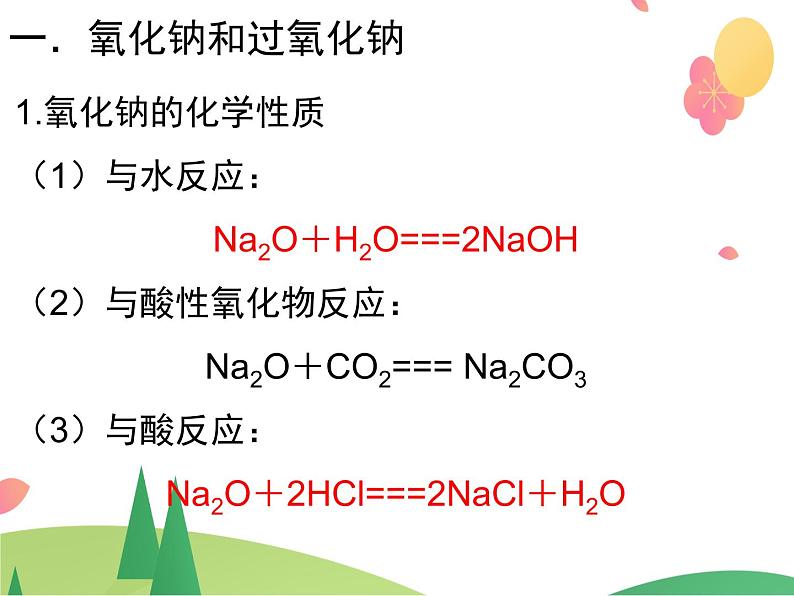
1.氧化钠的化学性质(1)与水反应: Na2O+H2O===2NaOH (2)与酸性氧化物反应: Na2O+CO2=== Na2CO3 (3)与酸反应: Na2O+2HCl===2NaCl+H2O
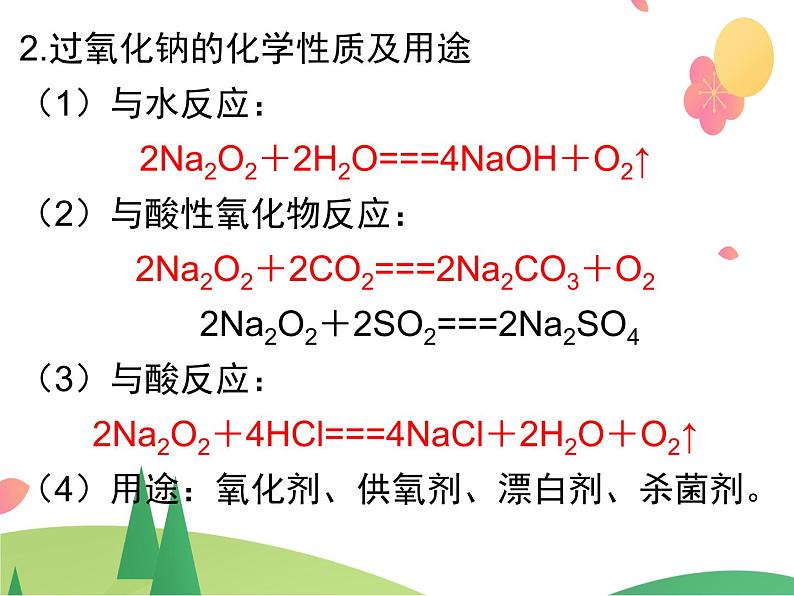
2.过氧化钠的化学性质及用途(1)与水反应: 2Na2O2+2H2O===4NaOH+O2↑ (2)与酸性氧化物反应: 2Na2O2+2CO2===2Na2CO3+O2 2Na2O2+2SO2===2Na2SO4 (3)与酸反应: 2Na2O2+4HCl===4NaCl+2H2O+O2↑ (4)用途:氧化剂、供氧剂、漂白剂、杀菌剂。
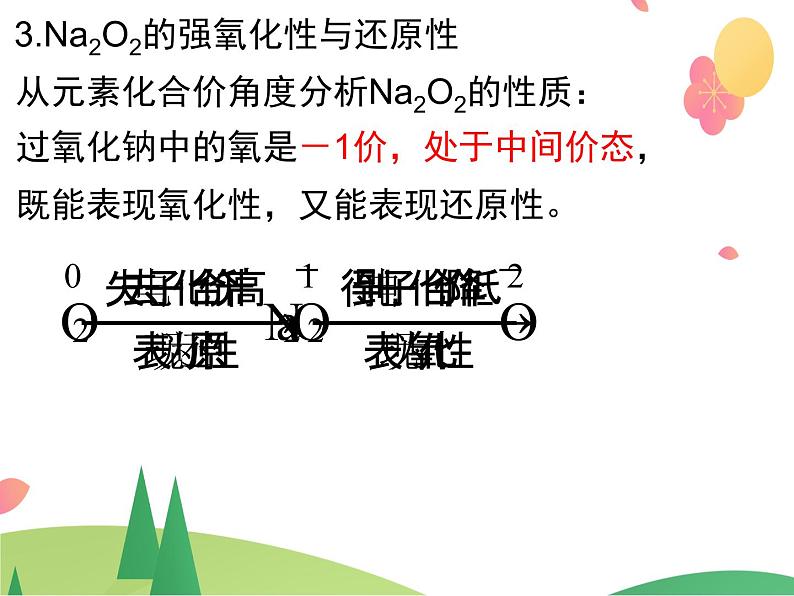
3.Na2O2的强氧化性与还原性
从元素化合价角度分析Na2O2的性质:过氧化钠中的氧是-1价,处于中间价态,既能表现氧化性,又能表现还原性。
(1)强氧化性①与Na2SO3溶液反应: Na2O2+Na2SO3+H2O===Na2SO4+2NaOH ②有强氧化性,具有杀菌、消毒、漂白的作用。 如能使品红溶液褪色。(2)还原性 遇KMnO4等强氧化剂时,Na2O2表现出还原性, 氧化产物为O2。(3)遇CO2、H2O、H+时,Na2O2发生自身的氧化还原反应,氧元素的歧化反应。此时,Na2O2既是氧化剂又是还原剂。
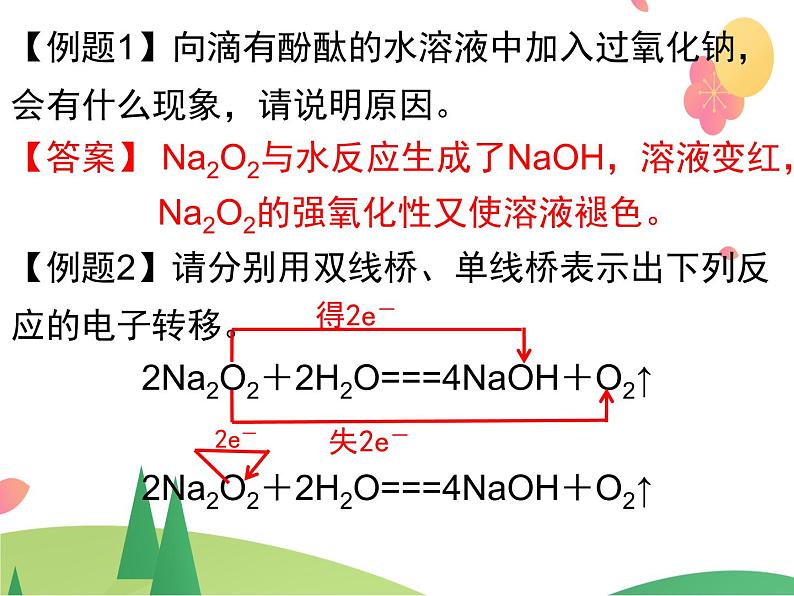
【例题1】向滴有酚酞的水溶液中加入过氧化钠,会有什么现象,请说明原因。【答案】 Na2O2与水反应生成了NaOH,溶液变红, Na2O2的强氧化性又使溶液褪色。【例题2】请分别用双线桥、单线桥表示出下列反应的电子转移。2Na2O2+2H2O===4NaOH+O2↑2Na2O2+2H2O===4NaOH+O2↑
1.如何鉴别Na2CO3 与 NaHCO3?(1)固体的鉴别用加热法:产生使澄清石灰水变浑浊的 气体的是NaHCO3固体。(2)溶液的鉴别可用沉淀法、气体法和测pH法。①沉淀法:加入BaCl2溶液或CaCl2溶液,产生沉淀的 是Na2CO3溶液。②气体法:滴入稀盐酸,立即产生气泡的是NaHCO3溶液。③测pH法:用pH试纸测相同浓度的稀溶液,pH大的是 Na2CO3溶液。
2.Na2CO3、NaHCO3的除杂
【例题3】Na2CO3和NaHCO3是常见的两种钠盐,它们广泛应用于生产和生活中。下列有关碳酸钠和碳酸氢钠的说法中,不正确的是( )A.小苏打能中和胃酸,对胃壁不产生强烈刺激或腐蚀作用,可用于治疗胃酸过多症,但不适合胃溃疡病人B.NaHCO3能中和面粉发酵后产生的酸,并且产生 二氧化碳气体,可用于做馒头C.可用澄清石灰水来鉴别Na2CO3溶液和NaHCO3溶液D.往Na2CO3饱和溶液中通入CO2气体,可获得NaHCO3 沉淀【答案】C
1.焰色反应:很多金属或它们的化合物在灼烧时都会使火焰呈现出特征颜色 ,这叫焰色反应。属于物理变化,属于元素的物理性质。2.焰色试验:根据火焰呈现的特征颜色,可以判断试样所含的金属元素,化学上把这样的定性分析操作称作焰色试验。
3.操作:洗 —— 将铂丝(或光洁的铁丝)用盐酸 洗净烧 —— 将洗净的铂丝在火焰上灼烧至与原来 火焰颜色相同 蘸 —— 蘸取待测物质烧 —— 在酒精灯上灼烧,观察焰色 洗 —— 将铂丝(或光洁的铁丝)用盐酸洗净
【实验2-6】灼烧Na2CO3溶液时,火焰呈黄色;灼烧K2CO3溶液时,透过蓝色钴玻璃片可观察到火焰呈紫色。
1.下列有关Na2O2的说法不正确的是( )A.向包有Na2O2粉末的脱脂棉上滴加几滴水,脱脂棉剧烈燃烧起来,说明Na2O2与H2O反应放热且有氧气生成B.Na2O2与CO2反应时有单质O2生成,该反应属于 置换反应C.Na2O2在空气中久置变白,涉及有氧化还原反应D.Na2O2粉末加入Ca(HCO3)2溶液中,产生气体和浑浊【答案】B
2.下列关于Na2O2的说法错误的是( )A.属于碱性氧化物B.氧元素的化合价为-1C.可用于呼吸面具中氧气的来源D.向与水反应后的溶液中滴加酚酞,溶液 先变红后褪色【答案】A
3.某白色固体混合物由NaCl、KCl、MgSO4、CaCO3中的两种组成,进行如下实验:① 混合物溶于水,得到澄清透明溶液;② 做焰色反应,通过钴玻璃可观察到紫色;③ 向溶液中加碱,产生白色沉淀。根据实验现象可判断其组成为( )A.KCl、NaCl B.KCl、MgSO4C.KCl、CaCO3D.MgSO4、NaCl【答案】B
4.在一密闭容器中有CO、H2、O2共16.5 g和足量的Na2O2,用电火花引燃,使其完全反应,Na2O2增重7.5 g,则原混合气体中O2的质量分数是( )A.54.5% B.40%C.36% D.33.3%【答案】A
5.用双线桥分析Na2O2与水反应中电子转移的方向和数目:__________________。氧化剂和还原剂是_____,氧化产物是______,还原产物是________。
Na2O2 O2 NaOH
人教版 (2019)第一节 钠及其化合物课文ppt课件: 这是一份人教版 (2019)第一节 钠及其化合物课文ppt课件,共1页。
人教版 (2019)必修 第一册第一节 钠及其化合物教课内容课件ppt: 这是一份人教版 (2019)必修 第一册第一节 钠及其化合物教课内容课件ppt,共22页。PPT课件主要包含了带火星的木条,用pH试纸检验,触摸外壁,振荡后褪色,显碱性,Na2O,Na2O2,白色固体,淡黄色固体,不褪色等内容,欢迎下载使用。
人教版 (2019)必修 第一册第一节 钠及其化合物背景图免费课件ppt: 这是一份人教版 (2019)必修 第一册第一节 钠及其化合物背景图免费课件ppt,共60页。PPT课件主要包含了结块变成晶体,NaCl,蓝色钴玻璃,Na2O2,Na2CO3,NaHCO3等内容,欢迎下载使用。













