






还剩37页未读,
继续阅读
所属成套资源:高一化学同步精品课件(苏教版2019必修第一册)
成套系列资料,整套一键下载
专题3 第2单元 课题1 钠的性质与制备 高一化学同步精品课件(苏教版2019必修第一册)
展开
这是一份专题3 第2单元 课题1 钠的性质与制备 高一化学同步精品课件(苏教版2019必修第一册),共45页。
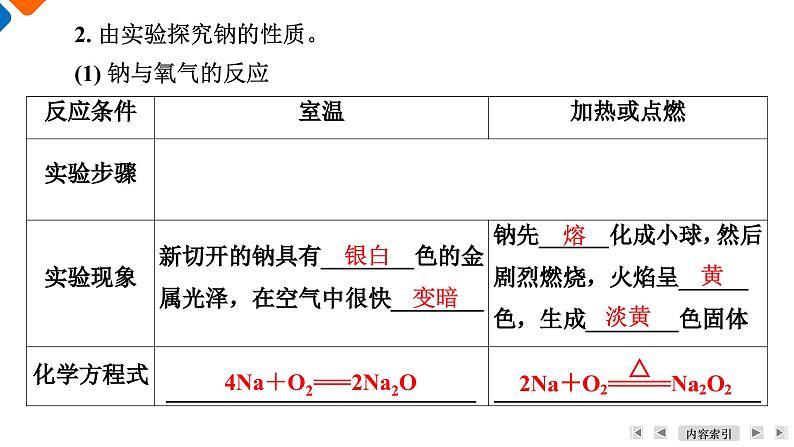
学 习 目 标1. 了解钠的物理性质,掌握钠的化学性质,认识钠是一种很活泼的金属。2. 了解钠的存在、用途及制备方法。3. 了解钠的氧化物的性质。4. 通过实验操作及观察,培养学生根据对实验现象的分析得出结论的能力。活 动 方 案1. 由钠原子结构预测钠的性质及存在。活动一:由实验探究钠的性质2. 由实验探究钠的性质。(1) 钠与氧气的反应银白变暗熔黄淡黄4Na+O2===2Na2O思考:①钠为什么可以保存在煤油中?【答案】 钠的密度比煤油大且不与煤油反应,因钠能与空气中的氧气反应,煤油隔绝空气。②由以上实验你能得到钠有哪些物理性质?【答案】 钠单质呈银白色,质地软。③钠与氧气的反应,说明条件对产物的影响?如何理解这个观点?【答案】 常温下生成Na2O、燃烧或加热生成Na2O2。④判断下列说法是否正确。Ⅰ . 取用钠时,可以用手直接接触它( )Ⅱ . 金属钠能存放于煤油中,也可存放于CCl4中( )Ⅲ. 常温下,钠与氧气反应生成淡黄色固体( )Ⅳ. 钠与氧气反应时,条件不同,产物也不同( )Ⅴ. 实验中取出的药品都不能再放回原瓶( )Ⅵ. 等质量的钠无论生成氧化钠、过氧化钠还是它们的混合物,转移的电子数相同( )×××√×√(2) 钠与水的反应钠的密度比水小钠熔点低,反应放热反应产生的氢气推动小球运动钠与水剧烈反应,产生气体有碱性物质(氢氧化钠)生成浮熔化迅速游动红结论:钠与水剧烈反应,其化学方程式是2Na+2H2O===2NaOH+H2↑。还原剂是______,氧化剂是______,反应的实质是钠与水电离出的H+反应。①钠与酸溶液的反应。若酸过量,钠与酸反应放出氢气,比与水反应剧烈;若酸不足,钠将酸反应完后,剩余的钠再与水反应。钠水②钠与水溶液反应问题的思维模型。某实验小组做了以下几个实验,将三块绿豆粒大小的钠分别同时投入甲、乙、丙三个小烧杯中。Ⅰ. 甲烧杯中除观察到浮、熔、游、响现象外,溶液还出现浑浊,写出反应的化学方程式:_________________________________________,产生浑浊的原因是______________________________________。Ⅱ. 乙烧杯中钠反应更剧烈,写出反应的化学方程式:_________________________________Ⅲ. 丙烧杯中能否析出红色铜?写出钠与硫酸铜溶液反应的化学方程式。【答案】 不能,2Na+2H2O===2NaOH+H2↑、CuSO4+2NaOH ===Cu(OH)2↓+Na2SO4。2Na+2H2O===2NaOH+H2↑钠与水反应,溶剂减少析出Ca(OH)22Na+2HCl===2NaCl+H2↑③某实验室钠着火时,能否用水灭火?为什么?【答案】 不能,因为钠极易与水反应产生氢气,用水灭火易发生爆炸,常用干燥的沙土来灭火。④由以上两组实验,你可以总结一下钠的物理性质和化学性质吗?【答案】 钠的物理性质:银白色,有金属光泽的固体,质地柔软,熔点低(小于100 ℃),密度比水的小,但比煤油的大。钠的化学性质:钠是活泼的金属,能与非金属、水、酸反应,在反应中均失去一个电子表现强还原性。金属钠是在1807年利用电解氢氧化钠制得的,约在1891年应用于工业生产,1921年电解氯化钠制钠的工业方法实现。目前,世界上钠的工业生产多数是用电解氯化钠的方法,少数仍沿用电解氢氧化钠的方法。电解氯化钠制金属钠通常在电解槽(见下图)里进行。电解时氯化钠需要熔融,氯化钠的熔点为801 ℃,在技术上有困难。实际生产中用熔融温度约为580 ℃的40%氯化钠和60%氯化钙的低共熔物(即两种或两种以上物质形成的熔点最低的混合物),降低了电解时所需的温度。活动二:钠的工业制备电解时,氯气在阳极放出,当电流通过熔融盐时,金属钠和金属钙同时被还原出来,浮在阴极上方的熔融盐上面,从管道溢出。把熔融的金属混合物冷却到105~110 ℃,金属钙成晶体析出,经过滤就可以把金属钠跟金属钙分离。1. 写出工业制备利用电解熔融氯化钠制备钠的化学方程式。2. 下列有关钠的用途,理解其中的化学性质与原理。(1) 充有钠蒸气的高压钠灯常用于道路和广场的照明,为什么?【答案】 高压钠灯发出的黄光射程远,透雾能力强。(2) 钠钾合金可用作快中子反应堆的热交换剂,原理是什么?【答案】 钠钾合金熔点低,常温下呈液态,导热性好。(3) 一定条件下钠可以用来冶炼钛、锆、铌、钽等稀有金属,利用钠的什么性质?写出700~800 ℃时,钠与熔融TiCl4反应制备金属Ti的化学方程式。1. 某同学在搜索关于Na2O的文献时,查得以下一段文字:危险特性:①遇水发生剧烈反应并放热;②与酸类物质能发生剧烈反应;③与铵盐反应放出氨气;④在潮湿条件下能腐蚀某些金属。(1) 分别写出氧化钠与水、盐酸、二氧化碳发生反应的化学方程式。【答案】 Na2O+H2O===2NaOH;Na2O+2HCl===2NaCl+H2O;Na2O+CO2===Na2CO3。(2) 为什么氧化钠可以与铵盐反应放出氨气?【答案】 氧化钠与水反应生成氢氧化钠,氢氧化钠能与铵盐反应放出氨气。活动三:认识两种钠的氧化物(3) 氧化钠在潮湿条件下,最容易腐蚀哪一种常见金属?【答案】 铝。2. 按照图1、图2所示操作分别完成“滴水生火”和“吹气生火”(可改用口吹)实验。(1) 实验现象是什么?试加以解释。【答案】 脱脂棉燃烧。因为两个反应均为放热反应,并有氧气产生,故脱脂棉燃烧。(2) 分别写出发生反应的化学方程式。【答案】 2Na2O2+2H2O===4NaOH+O2↑;2Na2O2+2CO2=== 2Na2CO3+O2。3. 思考分析。类比Na与水溶液反应的分析方法及Na2O2与H2O反应的化学方程式,试着分析。①将适量过氧化钠投入盐酸中,有什么现象?写出化学方程式。【答案】 有气泡产生,2Na2O2+4HCl===4NaCl+O2↑+2H2O。②将适量过氧化钠投入硫酸铜溶液中,有什么现象?写出相关反应的方程式。【答案】 有气泡放出,溶液颜色变浅,同时有蓝色沉淀生成。2Na2O2+2H2O===4NaOH+O2↑,2NaOH+CuSO4===Cu(OH)2↓+Na2SO4。③判断下列说法是否正确。Ⅰ. Na2O与Na2O2均为碱性氧化物( )Ⅱ. Na2O与Na2O2中的氧元素的化合价不相同,钠元素的化合价相同( )Ⅲ. Na2O与Na2O2的阴、阳离子个数比均为1∶2( )Ⅳ. Na2O2与CO2的反应中,Na2O2既是氧化剂,又是还原剂( )×√√√课 堂 反 馈245137968101. (2022·苏州期中)下列有关金属钠的说法中,不正确的是( )A. 钠只有在加热条件下才能与氯气反应B. 钠在化学反应中易失去电子,表现出还原性C. 实验室中少量金属钠保存在煤油中D. 钠钾合金熔点低,导热性好,可用作快中子反应堆的热交换剂【答案】 A11245137968102. (2022·高邮高一期中)下列关于钠的说法正确的是( )A. 钠的熔点很高,硬度很大B. 工业上用电解熔融氯化钠的方法制备金属钠C. 钠投入硫酸铜溶液中,会析出红色固体D. 实验室中,钠着火时可用水扑灭【解析】 钠的熔点低,硬度小,A错误;钠投入硫酸铜溶液中,先与水反应,置换不出金属,C错误;钠能与水反应,钠着火时不能用水扑灭,应用干燥的沙子覆盖,D错误。【答案】 B1124537968103. (2021·如皋中学高一调研)下列叙述正确的是( )A. Na2O与CO2发生化合反应生成Na2CO3,Na2O2与CO2发生置换反应生成O2B. Na2O与Na2O2都能和水反应生成碱,它们都是碱性氧化物C. Na2O能继续被氧化成Na2O2D. Na2O2只有还原性11124537968101【解析】 Na2O2与CO2反应生成Na2CO3和O2,没有单质参加,不是置换反应,A错误;Na2O2和水反应生成NaOH和O2,不是碱性氧化物,B错误;Na2O和O2在加热条件下生成Na2O2,C正确;Na2O2中氧显-1价,既有氧化性,又有还原性,D错误。【答案】 C112453796810 4. 将一小块金属钠投入下列溶液中,既能产生气体又会出现沉淀的是( )A. 稀硫酸 B. 氯化钠溶液C. 硫酸铜溶液 D. 氯化铵溶液1【解析】 C项,钠与水反应生成氢气和氢氧化钠,氢氧化钠与硫酸铜反应生成氢氧化铜沉淀。【答案】 C1124537968105. 某同学按如下图所示实验装置进行钠跟水反应的实验,据此判断下列说法正确的是( )A. 打开右端软塞,将一小块金属钠加入煤油中,反应前片刻,钠的位置在a处B. 开始反应后,能观察到的实验现象是钠在b处液面以下的水中反应C. 反应一段时间后,左端液面上升进入长颈漏斗,b处有无色气体产生D. 若用苯或酒精来代替煤油,可观察到相同的实验现象11124537968101【解析】 钠的密度大于煤油,所以会沉在煤油中,A错误;钠的密度大于煤油而小于水,所以钠会沉在煤油中而漂浮在水面上,上下跳动,不可能在b处液面以下的水中反应,B错误;钠和水反应生成NaOH和氢气,生成的氢气导致左端液面上升,进入长颈漏斗,b处有无色气体产生,C正确;乙醇和水互溶,所以不会出现相同的实验现象,D错误。【答案】 C1124537968106. (2022·洛阳期中)以CO2和Na2O2为原料,制取纯净干燥的O2,实验装置如下。下列说法正确的是( )A. 装置②的作用是干燥O2B. 装置③中试剂可以是NaOH溶液C. 收集氧气应选择装置bD. 装置①中反应的化学方程式:Na2O2+CO2===Na2CO3+O2↑11124537968101【解析】 装置②的作用是吸收没有反应的CO2,盛放的是NaOH溶液;装置③的作用是干燥O2,盛放浓硫酸;O2密度大于空气,排空气收集时长进短出,选择装置b;装置①发生反应2Na2O2+2CO2=== 2Na2CO3+O2,故选C。【答案】 C1124537968107. (2022·苏州高一上期中)在给定条件下,下列选项所示的物质间转化均能实现的是( )11124537968101【解析】 B项,氯气与铁在点燃条件下反应生成 FeCl3,错误;C项,加热条件下,Na与O2生成Na2O2,错误;D项,HCl与KI不反应,错误。【答案】 A1124537968108. 过氧化钠与水反应后滴加酚酞,酚酞先变红后褪色。某小组欲探究其原因,进行以下实验: 实验①取反应后溶液加入二氧化锰后迅速产生大量气体;实验②③中红色均不褪去。下列分析错误的是( )A. 过氧化钠与水反应产生的气体为O2B. 过氧化钠与水反应需要MnO2作催化剂C. 实验②③证明使酚酞褪色的不是氢氧化钠和氧气D. 过氧化钠与水反应可能生成了具有漂白性的H2O211124537968101【解析】 过氧化钠与水反应产生的气体为O2,A正确;过氧化钠与水反应不需要催化剂,双氧水分解需要MnO2作催化剂,B错误;实验②③作为对照实验,能证明使酚酞褪色的不是氢氧化钠和氧气,C正确;根据反应后溶液加入二氧化锰后迅速产生大量气体可推断,过氧化钠与水反应可能生成了具有漂白性的H2O2,D正确。【答案】 B1124537968109. (2022·安康期中)A、B、C、D、E五种物质都含1~18号元素中的某一元素,它们按图所示关系相互转化,已知A为单质,其化合物的焰色都为黄色。1112453796810(1) 写出A→E的化学式:A_______;B_________;C___________;E_______________。(2) 写出A→D、C→D、C→E反应的化学方程式:A→D:____________________________________________;C→D:__________________________________________________;C→E:_________________________________________________。111NaNa2ONa2O2Na2CO32Na+2H2O===2NaOH+H2↑2Na2O2+2H2O===4NaOH+O2↑2Na2O2+2CO2===2Na2CO3+O2245379681010. 在实验室里为了研究钠的性质,做了如下实验:(1) 取用浸没在煤油中的金属钠的操作方法是______________________________________________________________________________________________________________________________。(2) 一小块金属钠长时间置于空气中,可能出现下列现象:①变成白色粉末;②变暗;③变成白色固体;④表面变潮。这些现象出现的先后顺序是______(填字母,下同)。A. ①②③④ B. ②③④① C. ②③①④ D. ③②④①111用镊子取出钠块,用滤纸吸干钠块表面的煤油,在玻璃片上用小刀切去表面的氧化层,再切下一小粒备用,余下的钠全部放回试剂瓶中B2453796810(3) 取一块金属钠放在燃烧匙里加热,观察到下列实验现象:①金属先熔化;②在空气中燃烧,放出黄色火花;③燃烧后得白色固体;④燃烧时火焰为黄色;⑤燃烧后生成淡黄色固体。其中描述正确的是______。A. ①② B. ①②③ C. ①③ D. ①④⑤(4) 将一小块钠投入FeCl3溶液中,发生反应的有关化学方程式为_____________________________________________________________。111D2Na+2H2O===2NaOH+H2↑、3NaOH+FeCl3===Fe(OH)3↓+3NaCl245379681011. 在呼吸面具和潜水艇中可用过氧化钠作供氧剂。请选用适当的化学试剂和实验用品,用如图中的实验装置进行实验,证明过氧化钠可作供氧剂。1112453796810(1) A装置中盛放有大理石,写出A中发生反应的化学方程式: _______________________________________________________。(2) B、D中依次盛有饱和NaHCO3溶液、NaOH溶液,其目的分别是________________________________________________。(3) C中发生反应的化学方程式为_____________________________、______________________________________________。(4) F中收集的气体为________,每生成1 mol该气体,转移电子的物质的量为______________。111CaCO3+2HCl===CaCl2+CO2↑+H2O除去CO2中混有的HCl、吸收未反应的CO22Na2O2+2H2O===4NaOH+O2↑2Na2O2+2CO2===2Na2CO3+O2O22 mol谢谢观看Thank you for watching
学 习 目 标1. 了解钠的物理性质,掌握钠的化学性质,认识钠是一种很活泼的金属。2. 了解钠的存在、用途及制备方法。3. 了解钠的氧化物的性质。4. 通过实验操作及观察,培养学生根据对实验现象的分析得出结论的能力。活 动 方 案1. 由钠原子结构预测钠的性质及存在。活动一:由实验探究钠的性质2. 由实验探究钠的性质。(1) 钠与氧气的反应银白变暗熔黄淡黄4Na+O2===2Na2O思考:①钠为什么可以保存在煤油中?【答案】 钠的密度比煤油大且不与煤油反应,因钠能与空气中的氧气反应,煤油隔绝空气。②由以上实验你能得到钠有哪些物理性质?【答案】 钠单质呈银白色,质地软。③钠与氧气的反应,说明条件对产物的影响?如何理解这个观点?【答案】 常温下生成Na2O、燃烧或加热生成Na2O2。④判断下列说法是否正确。Ⅰ . 取用钠时,可以用手直接接触它( )Ⅱ . 金属钠能存放于煤油中,也可存放于CCl4中( )Ⅲ. 常温下,钠与氧气反应生成淡黄色固体( )Ⅳ. 钠与氧气反应时,条件不同,产物也不同( )Ⅴ. 实验中取出的药品都不能再放回原瓶( )Ⅵ. 等质量的钠无论生成氧化钠、过氧化钠还是它们的混合物,转移的电子数相同( )×××√×√(2) 钠与水的反应钠的密度比水小钠熔点低,反应放热反应产生的氢气推动小球运动钠与水剧烈反应,产生气体有碱性物质(氢氧化钠)生成浮熔化迅速游动红结论:钠与水剧烈反应,其化学方程式是2Na+2H2O===2NaOH+H2↑。还原剂是______,氧化剂是______,反应的实质是钠与水电离出的H+反应。①钠与酸溶液的反应。若酸过量,钠与酸反应放出氢气,比与水反应剧烈;若酸不足,钠将酸反应完后,剩余的钠再与水反应。钠水②钠与水溶液反应问题的思维模型。某实验小组做了以下几个实验,将三块绿豆粒大小的钠分别同时投入甲、乙、丙三个小烧杯中。Ⅰ. 甲烧杯中除观察到浮、熔、游、响现象外,溶液还出现浑浊,写出反应的化学方程式:_________________________________________,产生浑浊的原因是______________________________________。Ⅱ. 乙烧杯中钠反应更剧烈,写出反应的化学方程式:_________________________________Ⅲ. 丙烧杯中能否析出红色铜?写出钠与硫酸铜溶液反应的化学方程式。【答案】 不能,2Na+2H2O===2NaOH+H2↑、CuSO4+2NaOH ===Cu(OH)2↓+Na2SO4。2Na+2H2O===2NaOH+H2↑钠与水反应,溶剂减少析出Ca(OH)22Na+2HCl===2NaCl+H2↑③某实验室钠着火时,能否用水灭火?为什么?【答案】 不能,因为钠极易与水反应产生氢气,用水灭火易发生爆炸,常用干燥的沙土来灭火。④由以上两组实验,你可以总结一下钠的物理性质和化学性质吗?【答案】 钠的物理性质:银白色,有金属光泽的固体,质地柔软,熔点低(小于100 ℃),密度比水的小,但比煤油的大。钠的化学性质:钠是活泼的金属,能与非金属、水、酸反应,在反应中均失去一个电子表现强还原性。金属钠是在1807年利用电解氢氧化钠制得的,约在1891年应用于工业生产,1921年电解氯化钠制钠的工业方法实现。目前,世界上钠的工业生产多数是用电解氯化钠的方法,少数仍沿用电解氢氧化钠的方法。电解氯化钠制金属钠通常在电解槽(见下图)里进行。电解时氯化钠需要熔融,氯化钠的熔点为801 ℃,在技术上有困难。实际生产中用熔融温度约为580 ℃的40%氯化钠和60%氯化钙的低共熔物(即两种或两种以上物质形成的熔点最低的混合物),降低了电解时所需的温度。活动二:钠的工业制备电解时,氯气在阳极放出,当电流通过熔融盐时,金属钠和金属钙同时被还原出来,浮在阴极上方的熔融盐上面,从管道溢出。把熔融的金属混合物冷却到105~110 ℃,金属钙成晶体析出,经过滤就可以把金属钠跟金属钙分离。1. 写出工业制备利用电解熔融氯化钠制备钠的化学方程式。2. 下列有关钠的用途,理解其中的化学性质与原理。(1) 充有钠蒸气的高压钠灯常用于道路和广场的照明,为什么?【答案】 高压钠灯发出的黄光射程远,透雾能力强。(2) 钠钾合金可用作快中子反应堆的热交换剂,原理是什么?【答案】 钠钾合金熔点低,常温下呈液态,导热性好。(3) 一定条件下钠可以用来冶炼钛、锆、铌、钽等稀有金属,利用钠的什么性质?写出700~800 ℃时,钠与熔融TiCl4反应制备金属Ti的化学方程式。1. 某同学在搜索关于Na2O的文献时,查得以下一段文字:危险特性:①遇水发生剧烈反应并放热;②与酸类物质能发生剧烈反应;③与铵盐反应放出氨气;④在潮湿条件下能腐蚀某些金属。(1) 分别写出氧化钠与水、盐酸、二氧化碳发生反应的化学方程式。【答案】 Na2O+H2O===2NaOH;Na2O+2HCl===2NaCl+H2O;Na2O+CO2===Na2CO3。(2) 为什么氧化钠可以与铵盐反应放出氨气?【答案】 氧化钠与水反应生成氢氧化钠,氢氧化钠能与铵盐反应放出氨气。活动三:认识两种钠的氧化物(3) 氧化钠在潮湿条件下,最容易腐蚀哪一种常见金属?【答案】 铝。2. 按照图1、图2所示操作分别完成“滴水生火”和“吹气生火”(可改用口吹)实验。(1) 实验现象是什么?试加以解释。【答案】 脱脂棉燃烧。因为两个反应均为放热反应,并有氧气产生,故脱脂棉燃烧。(2) 分别写出发生反应的化学方程式。【答案】 2Na2O2+2H2O===4NaOH+O2↑;2Na2O2+2CO2=== 2Na2CO3+O2。3. 思考分析。类比Na与水溶液反应的分析方法及Na2O2与H2O反应的化学方程式,试着分析。①将适量过氧化钠投入盐酸中,有什么现象?写出化学方程式。【答案】 有气泡产生,2Na2O2+4HCl===4NaCl+O2↑+2H2O。②将适量过氧化钠投入硫酸铜溶液中,有什么现象?写出相关反应的方程式。【答案】 有气泡放出,溶液颜色变浅,同时有蓝色沉淀生成。2Na2O2+2H2O===4NaOH+O2↑,2NaOH+CuSO4===Cu(OH)2↓+Na2SO4。③判断下列说法是否正确。Ⅰ. Na2O与Na2O2均为碱性氧化物( )Ⅱ. Na2O与Na2O2中的氧元素的化合价不相同,钠元素的化合价相同( )Ⅲ. Na2O与Na2O2的阴、阳离子个数比均为1∶2( )Ⅳ. Na2O2与CO2的反应中,Na2O2既是氧化剂,又是还原剂( )×√√√课 堂 反 馈245137968101. (2022·苏州期中)下列有关金属钠的说法中,不正确的是( )A. 钠只有在加热条件下才能与氯气反应B. 钠在化学反应中易失去电子,表现出还原性C. 实验室中少量金属钠保存在煤油中D. 钠钾合金熔点低,导热性好,可用作快中子反应堆的热交换剂【答案】 A11245137968102. (2022·高邮高一期中)下列关于钠的说法正确的是( )A. 钠的熔点很高,硬度很大B. 工业上用电解熔融氯化钠的方法制备金属钠C. 钠投入硫酸铜溶液中,会析出红色固体D. 实验室中,钠着火时可用水扑灭【解析】 钠的熔点低,硬度小,A错误;钠投入硫酸铜溶液中,先与水反应,置换不出金属,C错误;钠能与水反应,钠着火时不能用水扑灭,应用干燥的沙子覆盖,D错误。【答案】 B1124537968103. (2021·如皋中学高一调研)下列叙述正确的是( )A. Na2O与CO2发生化合反应生成Na2CO3,Na2O2与CO2发生置换反应生成O2B. Na2O与Na2O2都能和水反应生成碱,它们都是碱性氧化物C. Na2O能继续被氧化成Na2O2D. Na2O2只有还原性11124537968101【解析】 Na2O2与CO2反应生成Na2CO3和O2,没有单质参加,不是置换反应,A错误;Na2O2和水反应生成NaOH和O2,不是碱性氧化物,B错误;Na2O和O2在加热条件下生成Na2O2,C正确;Na2O2中氧显-1价,既有氧化性,又有还原性,D错误。【答案】 C112453796810 4. 将一小块金属钠投入下列溶液中,既能产生气体又会出现沉淀的是( )A. 稀硫酸 B. 氯化钠溶液C. 硫酸铜溶液 D. 氯化铵溶液1【解析】 C项,钠与水反应生成氢气和氢氧化钠,氢氧化钠与硫酸铜反应生成氢氧化铜沉淀。【答案】 C1124537968105. 某同学按如下图所示实验装置进行钠跟水反应的实验,据此判断下列说法正确的是( )A. 打开右端软塞,将一小块金属钠加入煤油中,反应前片刻,钠的位置在a处B. 开始反应后,能观察到的实验现象是钠在b处液面以下的水中反应C. 反应一段时间后,左端液面上升进入长颈漏斗,b处有无色气体产生D. 若用苯或酒精来代替煤油,可观察到相同的实验现象11124537968101【解析】 钠的密度大于煤油,所以会沉在煤油中,A错误;钠的密度大于煤油而小于水,所以钠会沉在煤油中而漂浮在水面上,上下跳动,不可能在b处液面以下的水中反应,B错误;钠和水反应生成NaOH和氢气,生成的氢气导致左端液面上升,进入长颈漏斗,b处有无色气体产生,C正确;乙醇和水互溶,所以不会出现相同的实验现象,D错误。【答案】 C1124537968106. (2022·洛阳期中)以CO2和Na2O2为原料,制取纯净干燥的O2,实验装置如下。下列说法正确的是( )A. 装置②的作用是干燥O2B. 装置③中试剂可以是NaOH溶液C. 收集氧气应选择装置bD. 装置①中反应的化学方程式:Na2O2+CO2===Na2CO3+O2↑11124537968101【解析】 装置②的作用是吸收没有反应的CO2,盛放的是NaOH溶液;装置③的作用是干燥O2,盛放浓硫酸;O2密度大于空气,排空气收集时长进短出,选择装置b;装置①发生反应2Na2O2+2CO2=== 2Na2CO3+O2,故选C。【答案】 C1124537968107. (2022·苏州高一上期中)在给定条件下,下列选项所示的物质间转化均能实现的是( )11124537968101【解析】 B项,氯气与铁在点燃条件下反应生成 FeCl3,错误;C项,加热条件下,Na与O2生成Na2O2,错误;D项,HCl与KI不反应,错误。【答案】 A1124537968108. 过氧化钠与水反应后滴加酚酞,酚酞先变红后褪色。某小组欲探究其原因,进行以下实验: 实验①取反应后溶液加入二氧化锰后迅速产生大量气体;实验②③中红色均不褪去。下列分析错误的是( )A. 过氧化钠与水反应产生的气体为O2B. 过氧化钠与水反应需要MnO2作催化剂C. 实验②③证明使酚酞褪色的不是氢氧化钠和氧气D. 过氧化钠与水反应可能生成了具有漂白性的H2O211124537968101【解析】 过氧化钠与水反应产生的气体为O2,A正确;过氧化钠与水反应不需要催化剂,双氧水分解需要MnO2作催化剂,B错误;实验②③作为对照实验,能证明使酚酞褪色的不是氢氧化钠和氧气,C正确;根据反应后溶液加入二氧化锰后迅速产生大量气体可推断,过氧化钠与水反应可能生成了具有漂白性的H2O2,D正确。【答案】 B1124537968109. (2022·安康期中)A、B、C、D、E五种物质都含1~18号元素中的某一元素,它们按图所示关系相互转化,已知A为单质,其化合物的焰色都为黄色。1112453796810(1) 写出A→E的化学式:A_______;B_________;C___________;E_______________。(2) 写出A→D、C→D、C→E反应的化学方程式:A→D:____________________________________________;C→D:__________________________________________________;C→E:_________________________________________________。111NaNa2ONa2O2Na2CO32Na+2H2O===2NaOH+H2↑2Na2O2+2H2O===4NaOH+O2↑2Na2O2+2CO2===2Na2CO3+O2245379681010. 在实验室里为了研究钠的性质,做了如下实验:(1) 取用浸没在煤油中的金属钠的操作方法是______________________________________________________________________________________________________________________________。(2) 一小块金属钠长时间置于空气中,可能出现下列现象:①变成白色粉末;②变暗;③变成白色固体;④表面变潮。这些现象出现的先后顺序是______(填字母,下同)。A. ①②③④ B. ②③④① C. ②③①④ D. ③②④①111用镊子取出钠块,用滤纸吸干钠块表面的煤油,在玻璃片上用小刀切去表面的氧化层,再切下一小粒备用,余下的钠全部放回试剂瓶中B2453796810(3) 取一块金属钠放在燃烧匙里加热,观察到下列实验现象:①金属先熔化;②在空气中燃烧,放出黄色火花;③燃烧后得白色固体;④燃烧时火焰为黄色;⑤燃烧后生成淡黄色固体。其中描述正确的是______。A. ①② B. ①②③ C. ①③ D. ①④⑤(4) 将一小块钠投入FeCl3溶液中,发生反应的有关化学方程式为_____________________________________________________________。111D2Na+2H2O===2NaOH+H2↑、3NaOH+FeCl3===Fe(OH)3↓+3NaCl245379681011. 在呼吸面具和潜水艇中可用过氧化钠作供氧剂。请选用适当的化学试剂和实验用品,用如图中的实验装置进行实验,证明过氧化钠可作供氧剂。1112453796810(1) A装置中盛放有大理石,写出A中发生反应的化学方程式: _______________________________________________________。(2) B、D中依次盛有饱和NaHCO3溶液、NaOH溶液,其目的分别是________________________________________________。(3) C中发生反应的化学方程式为_____________________________、______________________________________________。(4) F中收集的气体为________,每生成1 mol该气体,转移电子的物质的量为______________。111CaCO3+2HCl===CaCl2+CO2↑+H2O除去CO2中混有的HCl、吸收未反应的CO22Na2O2+2H2O===4NaOH+O2↑2Na2O2+2CO2===2Na2CO3+O2O22 mol谢谢观看Thank you for watching
相关资料
更多









