




- 苏教版(2019)高中化学必修一教案:专题2 研究物质的基本方法 物质的量浓度 ( 含解析,2课时打包) 教案 3 次下载
- 苏教版(2019)高中化学必修一教案:专题3 从海水中获得的化学物质 从海水中提取镁 ( Word版含解析,2课时打包) 教案 1 次下载
- 苏教版(2019)高中化学必修一教案:专题3 从海水中获得的化学物质 氯气的性质与应用 ( Word版含解析,2课时打包) 教案 2 次下载
- 苏教版(2019)高中化学必修一教案:专题3 从海水中获得的化学物质 碳酸钠 碳酸氢钠 ( Word版含解析,2课时打包) 教案 1 次下载
- 苏教版(2019)高中化学必修一教案:专题3 从海水中获得的化学物质 离子反应 ( Word版含解析,2课时打包) 教案 1 次下载
苏教版(2019)高中化学必修一教案:专题3 从海水中获得的化学物质 氧化还原反应 ( Word版含解析,2课时打包)
展开![]() 3.1.3氧化还原反应
3.1.3氧化还原反应
![]()
教材以分析氯气与钠反应的化学类型和化合价变化的原因入手,详细介绍了氯化钠的形成过程,从得失电子的角度引入“氧化还原反应”和“非氧化还原反应”概念,强调氧化还原反应的实质是反应中发生了电子的转移,让学生能用电子的转移或化合价的变化来判断氧化还原反应和非氧化还原反应,判断反应中的氧化剂和还原剂,及其相应的氧化性和还原性。培养了学生微观想象、逻辑推理能力。
![]()
1、宏观辨识与微观探析:能从电子转移的角度判断氧化还原反应和非氧化还原反应
2、变化观念与平衡思想:电子的转移与化合价的关系。
3、证据推理与模型认知:从原子结构角度表示氧化还原反应中电子的转移情况。会判断氧化剂和还原剂,氧化性和还原性。
4、科学探究与创新意识:培养学生微观相像、逻辑推理能力
![]()
1.理解氧化还原反应的本质是电子的转移,能够判断氧化剂、还原剂、氧化产物和还原产物。
2.能表示化学反应的中电子转移方向和数目。
![]()
学案、课件
![]()
知识回顾:在初中我们学习过以下几个化学反应,总结有什么特点?
1、3Fe + 2O2 == Fe3O4
2、4P + 5O2 == 2P2O5
3、S + O2 == SO2
讲解:这些物质都与氧气发生的反应,属于氧化反应。氧化反应中,氧气提供氧原子给铁原子、磷原子和硫原子,氧气具有氧化性。
引入新课:钠和氯气反应生成氯化钠。请从元素的化合价是否发生变化的角度,对氯气和金属钠的化学反应进行分类,它属于何种反应类型?反应中化合价发生变化的原因是什么?
板书:一、氧化还原反应
讲解:2Na+Cl22NaCl在反应中,钠原子失去最外层上一个电子变成Na+,形成稳定的结构,氯原子最外层上得到一个电子,变成Cl-,形成稳定的结构。Na+与Cl-再结合形成稳定的化合物氯化钠。元素化合价的变化与原子的最外层电子的转移有关系。
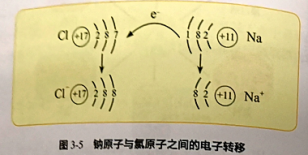
板书:1、定义:有化合价变化的化学反应(或有电子转移的化学反应)叫氧化还原反应。
2、特点:发生化合价的变化
3、实质:电子的转移(得失或偏移)
讲解:氧化还原反应是有电子转移(电子得失或共用电子对偏移)的化学反应。没有电子转移的化学反应称为非氧化还原反应。在氧化还原反应中,失去电子的物质是还原剂,还原剂发生氧化反应,表现出还原性;得到电子的物质是氧化剂,氧化剂发生还原反应,表现出氧化剂。
板书:4、氧化剂:得到电子的物质。发生还原反应,表现氧化性。
还原剂:失云电子的物质。发生氧化反应,表现还原性。
过度:钠原子与氯原子之间发生了电子转移,导致钠元素与氯元素的化合价发生了改变。那么怎样表示该化学反应中电子转移情况呢?
板书:二、氧化还原反应中电子转移的表示方法
1、双线桥法:表示反应前后同一元素由反应物转化为生成物时电子转移的情况。
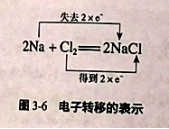 例:
例:
钠是还原剂,发生氧化反应,表现还原性;氯气是氧化剂,发生还原反应,表现氧化性。
书写步骤:
(1)标价态:正确标出反应前后各元素的化合价,明确变价元素的化合价升降关系
(2)双线桥:一条线始于被还原的物质中的降价元素,止于还原产物中的相应元素;一条线始于被氧化的物质中的升价元素,终止于氧化产物中的相应元素
(3)注得失:标出“失去”或“得到”电子的总数
讲解:1、箭头、箭尾必须对应化合价变化的同种元素的原子;
2、必须注明“得到”或“失去”;
3、被还原的物质和被氧化的物质得、失电子数守恒。
学以致用:高锰酸钾与浓盐酸在一定条件下可以反应生成氯气。2KMn04+16HCl(浓)==2KC1+2MnCl2+5Cl2↑+8H2O该反应是氧化还原反应吗?如果是,指出反应中化合价发生变化的元素,分析电子转移的方向和数目,并指出氧化剂和还原剂。如果不是,请给出理由。
板书:2、单线桥法:表示反应过程中不同元素原子间的电子转移情况。
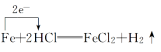 例:
例:
书写步骤:
(1)标价态:正确标出反应前后各元素的化合价;明确变价元素的化合价升降关系
(2)单箭头:始于被氧化物质中化合价升高的元素,止于被还原物质中化合价降低的元素
(3)标数目:标出转移电子的总数
讲解:1、不需要标明“得到”或“失去”,只标明电子转移数目;
2、要用箭号标明电子转移的方向;
3、箭头由反应物中失电子元素原子指向得电子元素原子。
思考:我们知道化学反应前后遵循质量守恒,那么化合价、电子转移遵循哪些规律呢?
板书:三、氧化还原反应中的守恒
1、质量守恒:参加化学反应的各物质的总质量等于反应后生成的各物质的总质量。
2、化合价升降守恒:反应前后元素化合价升、降的总数相等。
3、电子守恒:反应中氧化剂得电子的数目等于还原剂失电子的数目。
课堂练习:
1、下列化学反应中,不属于氧化还原反应的是( )
A.Mg+2HCl===MgCl2+H2↑
B.2NO+O2===2NO2
C.CuO+H2Cu+H2O
D.CaCl2+Na2CO3===CaCO3↓+2NaCl
2、下列关于氧化还原反应的说法中正确的是( )
A.氧化还原反应前后元素化合价有升降
B.氧化还原反应前后一定有氧的得失
C.实现Fe3+―→Fe2+的变化过程一定是氧化反应
D.元素化合价升高的反应是还原反应
![]()
本节课重点讲了氧化还原反应的特征、实质,让学生从初中所学的得失氧的角度认识氧化还原反应,上升到化合价(特征)、电子转移(实质)的层面,学生对氧化还原反应有了进一步的了解。









