



- 苏教版(2019)高中化学必修一教案:专题3 从海水中获得的化学物质 碳酸钠 碳酸氢钠 ( Word版含解析,2课时打包) 教案 1 次下载
- 苏教版(2019)高中化学必修一教案:专题3 从海水中获得的化学物质 离子反应 ( Word版含解析,2课时打包) 教案 1 次下载
- 苏教版(2019)高中化学必修一教案:专题3 从海水中获得的化学物质 氯气的发现与制备 ( Word版含解析,2课时打包) 教案 2 次下载
- 苏教版(2019)高中化学必修一教案:专题3 从海水中获得的化学物质 钠的性质与制备 ( Word版含解析,2课时打包) 教案 1 次下载
- 苏教版(2019)高中化学必修一教案:专题4 硫及环境保护 二氧化硫的性质与应用 ( Word版含解析,2课时打包) 教案 1 次下载
苏教版(2019)高中化学必修一教案:专题3 从海水中获得的化学物质 粗盐提纯 ( Word版含解析,2课时打包)
展开![]() 3.3.1 粗盐提纯 从海水中提取溴
3.3.1 粗盐提纯 从海水中提取溴
![]()
教材以自然资源十分丰富的海水作为研究对象,引出海水中氯化钠的提纯和溴元素的提取,使学生在获取相关化学知识和实验研究技能的同时,形成利用自然资源需要化学科学的发展认识,激发学生的探索兴趣和学习的积极性。了解实验探究的过程的一般方法,形成化学实验操作的基本技能,知道化学实验是研究和认识化学物质的重要途径。认识到海水是人类的宝贵自然资源,培养与大自然友好相处的情感。注重从工业生产实际出发,体现化学在生产和生活中应用十分广泛的学科特点。
![]()
1、宏观辨识与微观探析:初步了解海洋化学资源的分布;
2、变化观念与平衡思想:具有绿色化学的意识;
3、证据推理与模型认知:了解实验探究的过程的一般方法,形成化学实验操作的基本技能
4、科学探究与创新意识:能依据物质性质和实验方法设计资源综合用的方案;
5、科学精神与社会责任:认识化学科学在开发利用自然资源、制备新物质、保护环境和促进科技发展等方面发挥和作用。
![]()
1、粗盐提纯的方法和过程
2、海水提取溴的基本原理和工艺流程
![]()
相关课件、海洋图片和视频
![]()
复习引入:
1、从海水中制备氯化钠方法有哪些?
2、实验室制氯气的原理和装置,怎样收集一瓶纯净、干燥的氯气?
3、氯碱工业的原理(用化学方程式表示)
4、工业上冶炼金属钠的原理(用化学方程式表示)
PPT展示:海水中各盐成分的质量分数分布图
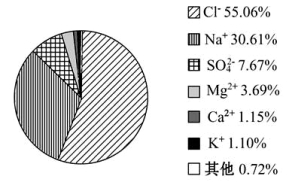
讲解:地球表面积5.1亿km2 ,其中: 海洋3.61亿km2 ,占70.8%;海水是一种化学成分复杂的混合溶液,包括水、溶解干水中的多种化学元素和气体。迄今已发现的化学元素达80多种,依其含量可分为三类:常量元素、微量元素和痕量元素。海水中含有各种盐类,其中90%左右是氯化钠,从海水中提取氯化钠是生产和生活中的主要方法。
PPT展示图片:太空中遥望地球和数据图
思考:1、生活中我们用的食用盐来自海水,从海水中晒的盐能食用吗?
2、氯碱工业和冶炼金属钠所用的氯化钠主要来自海水的氯化钠,能直接做为原料来用吗?
学生阅读教材:第78页内容
讲解:直接从海水中提取的氯化钠含有CaCl2、MgCl2、Na2SO4和难溶性物质等许多杂质,需要提纯,也就是精制,那么精制原理是什么,具体的操作过程怎样?
板书:一、粗盐精制
教材79页:基础实验“粗盐中杂质离子的去除”
学生思考回答下列问题
1、除杂的基本原则是什么?
2、用什么试剂除去Ca2+?原理是什么?
3、用什么试剂除去Mg2+?原理是什么?
4、用什么试剂除去SO42-?原理是什么?
5、实验过程怎样?
板书:(一)除杂原则:
1、不可引进新的杂质
2、尽量减少被精制物的损失
3、实验方案简单合理
学生总结:用碳酸钠除去Ca2+、用氢氧化钠除去Mg2+、用氯化钡除去SO42-,再用过滤法,除去生成的固体和原有的难溶性杂质,用盐酸调节溶液,最后再加热蒸发结晶,制备出纯净的氯化钠。
板书:(二)原理与过程
1、除杂试剂:Na2CO3、NaOH、 BaCl2 、盐酸
2、原理:
CaCl2 + Na2CO3 == CaCO3↓ + 2NaCl
MgCl2 + 2NaOH == Mg(OH)2↓ + 2NaCl
Na2SO4 + BaCl2 == BaSO4↓ + 2NaCl
思考:除杂试剂要稍过量才能保证除净,那么怎样除去过量的除杂试剂呢?
3、过程:(除杂试剂加入的顺序)
(1)BaCl2 → Na2CO3 → NaOH →过滤 → 加盐酸 → 蒸发结晶
(2)NaOH → BaCl2 →Na2CO3 →过滤 → 加盐酸 → 蒸发结晶
(3)BaCl2 → NaOH → Na2CO3→过滤 → 加盐酸 → 蒸发结晶
思考:加入的除杂试剂的顺序有什么特点?为什么?
讲解:碳酸钠溶液一定要加在氯化钡溶液的后面,这样才能保证过量的氯化钡被除去,不引入新的杂质。工业上运用物理方法、化学方法将粗盐进行提纯后,就可以获得基础化工原料氯化钠。
过度:从海水中除了可以提取食盐外,还可以提取镁、溴等元素。世界上99%的溴都蕴藏在大海中。
溴及其化合物有着很重要的应用,怎样从海水中提取溴呢?请阅读教材第79-80页内容。
板书:二、从海水中提取溴
PPT展示:溴元素的相关应用
1、原理:2Br- + Cl2 == Br2 + 2Cl-
讲解:利用氧化还原反应原理,将氯气通入提取食盐后的母液(用硫酸酸化以抑制氯、溴与水的反应)中,将溶液中的溴离子转化为溴单质。
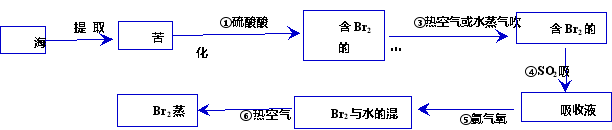 2、提取过程(PPT展示)
2、提取过程(PPT展示)
播放视频:海水提取溴
问题思考:
(1)得到的单质溴仍然溶解在海水中,如何将溴从海水中提取出来呢?
(2)为什么不直接用含溴的海水进行蒸馏得到液溴,而要经过“空气吹出、SO2吸收、氯化”?
(3)含溴的空气通入吸收液与SO2反应的原理是什么?
(4)观察液溴的颜色。怎样保存液溴?
讲解:
1、液溴深红棕色,保存在棕色试剂瓶中,用水封。试剂瓶中分成三部分,上面是溴蒸气,中间是溴水,下面是液溴。
2、用热空气或水蒸气吹出溴蒸气,再用SO2吸收,是一个Br2的浓缩、富集的过程。
原理是:SO2 + Br2 + 2H2O == H2SO4 + 2HBr
课堂小结:
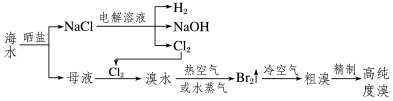
课堂练习:
海水是巨大的资源宝库,从海水中提取食盐和溴的过程如下:

(1)将NaCl溶液进行电解,在电解槽中可直接得到的产品有H2、__________、__________或H2、__________。
(2)步骤Ⅱ用SO2水溶液吸收Br2,可制得HBr和硫酸,该反应中,氧化剂是____________(填化学式,下同),氧化产物是____________。
(3)写出步骤Ⅲ反应的化学方程式:___________________________。
![]()
本节课重点学习了粗盐的精制和从海水提取溴的过程,重点讲解了实验过程和工艺流程,让学生了解实验探究的过程的一般方法,形成化学实验操作的基本技能,能依据物质性质和实验方法设计资源综合用的方案,认识化学科学在开发利用自然资源、制备新物质、保护环境和促进科技发展等方面发挥和作用。









