






- 浙江专版2023_2024学年新教材高中化学第2章化学反应速率与化学平衡第1节化学反应速率第2课时活化能课件新人教版选择性必修1 课件 0 次下载
- 浙江专版2023_2024学年新教材高中化学第2章化学反应速率与化学平衡第2节化学平衡第1课时化学平衡状态化学平衡常数课件新人教版选择性必修1 课件 0 次下载
- 浙江专版2023_2024学年新教材高中化学第2章化学反应速率与化学平衡第4节化学反应的调控课件新人教版选择性必修1 课件 0 次下载
- 浙江专版2023_2024学年新教材高中化学第3章水溶液中的离子反应与平衡第2节水的电离和溶液的pH第1课时水的电离溶液的酸碱性与pH课件新人教版选择性必修1 课件 0 次下载
- 浙江专版2023_2024学年新教材高中化学第3章水溶液中的离子反应与平衡第3节盐类的水解第1课时盐类的水解课件新人教版选择性必修1 课件 0 次下载
人教版 (2019)选择性必修1第二节 化学平衡课前预习课件ppt
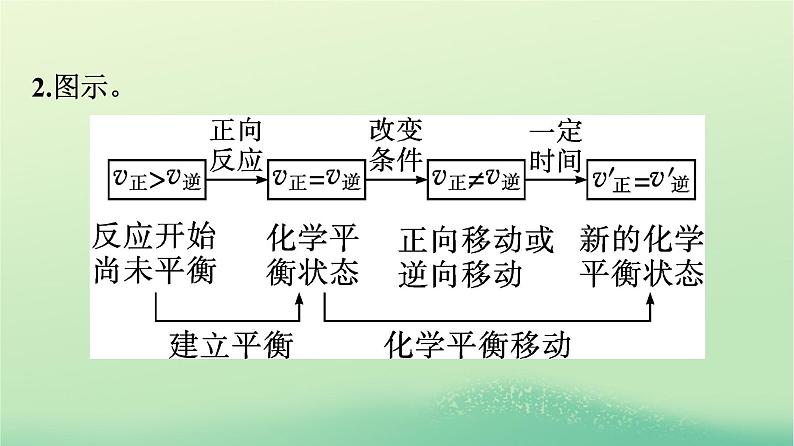
展开一、化学平衡的移动1.含义。在一定条件下,当一个可逆反应达到平衡后,如果改变 浓度 、 压强 、 温度 等反应条件,原来的平衡状态会被破坏,平衡体系的物质组成也会随着改变,直至达到新的平衡,这种由原有的平衡状态达到新的平衡状态的过程叫做化学平衡的移动。
微思考1 改变条件,v正、v逆均改变,平衡一定移动吗?提示:不一定。v正、v逆改变后不再相等则平衡发生移动,但如果是同等程度改变,改变后满足v正=v逆,则平衡不发生移动。
微判断1 (1)化学平衡移动的根本原因在于v正不等于v逆。( )(2)改变外界条件,引起v正>v逆时,化学平衡向反应速率小的方向即逆反应方向移动。( )
二、外界条件对化学平衡的影响1.浓度对化学平衡的影响。(1)对于平衡Fe3++3SCN- Fe(SCN)3,加入少量铁粉,平衡向 逆 反应方向移动,溶液颜色变 浅 ;加入KSCN溶液,平衡向 正 反应方向移动,溶液颜色变 深 。
(2)影响规律。①增大反应物浓度或减小生成物浓度,平衡向 正反应 方向移动。 ②减小反应物浓度或增大生成物浓度,平衡向 逆反应 方向移动。
(3)利用浓度商Q与平衡常数K的大小关系判断平衡移动方向。①当Q = K时,可逆反应处于 平衡 状态; ②当Q < K时,化学平衡向正反应方向移动,直至达到新的平衡状态; ③当Q > K时,化学平衡向逆反应方向移动,直至达到新的平衡状态。
2.压强对化学平衡的影响。(1)适用对象:有 气体 参加的可逆反应。 (2)影响规律。当其他条件不变时:①若为体积不等的反应,如2NO2(g) N2O4(g):增大压强(减小容器的容积),平衡向气体体积 缩小 的方向移动; 减小压强(增大容器的容积),平衡向气体体积 增大 的方向移动。
②若为等体积反应,如H2(g)+I2(g) 2HI(g):增大压强时,v正、v逆同等程度地增大;减小压强时,v正、v逆同等程度地减小,平衡均 不发生 移动。 微思考2 对于只有固体或液体参加的反应,体系压强的改变能使化学平衡状态发生变化吗?提示:不能。
3.温度对化学平衡的影响。(1)对于2NO2(g) N2O4(g) ΔH=-56.9 kJ·ml-1,将装有NO2和N2O4的烧瓶浸泡在冰水中,混合气体红棕色变 浅 ,平衡向 正 反应方向移动;装有NO2和N2O4的烧瓶浸泡在热水中,混合气体红棕色变 深 ,平衡向 逆 反应方向移动。 (2)影响规律。①升高温度,平衡向 吸热 反应的方向移动; ②降低温度,平衡向 放热 反应的方向移动。
4.勒夏特列原理。如果改变影响平衡的一个因素(如温度、压强及参加反应的物质的浓度),平衡就向着能够 减弱 这种改变的方向移动。
微判断2 (1)合成氨反应,使用催化剂可以促进平衡向生成氨的方向移动,因此可以用勒夏特列原理解释使用催化剂的原因。( )(2)若改变外界条件,引起化学平衡向正反应方向移动,反应物的转化率一定变大。( )(3)在平衡体系FeCl3+3KSCN Fe(SCN)3+3KCl中加入少量铁粉,平衡向左移动,溶液的颜色变浅。( )(4)对于平衡体系2NO2(g) N2O4(g),压缩容器容积,增大压强,平衡向右移动,混合气体的颜色变浅。( )
微训练 1. 现有反应X(g)+Y(g) 2Z(g) ΔH<0。下图表示从反应开始到t1 时刻达到平衡,在t2时刻由于条件变化使平衡破坏,到t3时刻又达平衡。则在图中t2时刻改变的条件可能是( )。A.增大压强B.使用了催化剂C.降低温度D.减小了X或Y的浓度答案:C
解析:增大压强,平衡不移动,改变条件瞬间X、Y、Z的浓度应增大,A项错误;使用了催化剂,平衡不移动,X、Y、Z的浓度应不变,B项错误;该反应ΔH<0,降低温度,平衡向正反应方向移动,X或Y的浓度降低,Z的浓度增大,图像符合,C项正确;若减小X或Y的浓度,平衡向逆反应方向移动,Z的浓度应减小,D项错误。
2.已知FeCl3+3KSCN Fe(SCN)3+3KCl,达到平衡后,进行下列操作,平衡怎样移动?(1)加入少量FeCl3固体:平衡 移动。 (2)加入少量KSCN固体:平衡 移动。 (3)加入少量KCl固体:平衡 移动,其理由是 。 答案:(1)正向(2)正向(3)不 K+和Cl-不参加反应,溶液中Fe3+、SCN-浓度不变
解析:分析给出的化学方程式可知,反应的本质是Fe3++3SCN- Fe(SCN)3。(1)加入少量FeCl3固体,溶液中Fe3+浓度增大,即增大了反应物的浓度,故平衡正向移动。(2)加入少量KSCN固体,溶液中SCN-浓度增大,即增大了反应物的浓度,平衡正向移动。(3)加入少量KCl固体,溶液中Fe3+、SCN-浓度不变,K+和Cl-不参加反应,即不影响反应物、生成物的浓度,故化学平衡不移动。
一、认识化学平衡图像重难归纳1.应用v-t图像分析外界因素对化学平衡的影响。以mA(g)+nB(g) pC(g) ΔH<0且m+n
②减小生成物C的浓度,v逆减小的瞬间,v正保持不变,v'正>v'逆,平衡向正反应方向移动,直至建立新的平衡。新平衡时,v'正、v'逆均变小。如图2所示。
③减小反应物A或B的浓度,v正减小的瞬间,v逆保持不变,v'逆>v'正,平衡向逆反应方向移动,直至建立新的平衡。新平衡时,v'正、v'逆均变小。如图3所示。
④增大生成物C的浓度,v逆增大的瞬间,v正保持不变,v'逆>v'正,平衡向逆反应方向移动,直至建立新的平衡。新平衡时,v'正、v'逆均变大。如图4所示。
(2)压强和温度。①增大压强(减小容器的容积)或升高温度,v正、v逆均瞬间变大,且v'逆(即v'减、v'吸)大于v'正(即v'增、v'放),平衡向逆反应方向移动,直至建立新的平衡。新平衡时,v'正、v'逆均变大。如图5所示。
②减小压强(增大容器的容积)或降低温度,v正、v逆均瞬间变小,且v'逆(即v'减、v'吸)小于v'正(即v'增、v'放),平衡向正反应方向移动,直至建立新的平衡。新平衡时,v'正、v'逆均变小。如图6所示。
(3)使用催化剂(通常指正催化剂),v正、v逆均瞬间变大,且v'正=v'逆,平衡不移动。如图7所示。
2.识别化学平衡图像的方法。(1)看图像:一看面,即横坐标和纵坐标的含义;二看线,即线的斜率或者趋势;三看点,即曲线上的特殊点,如起点、拐点、交点、终点;四看辅助线,根据需要添加等温线、等压线、平衡线等。(2)想规律、作判断:联想外界条件的改变对化学反应速率和化学平衡的影响规律,根据图像中表达的关系与规律相对比,作出符合题目要求的判断。
3.解答化学平衡图像题的常用原则。以可逆反应aA(g)+bB(g) cC(g)为例说明。(1)“定一议二”原则。在化学平衡图像中,包括横坐标、纵坐标和曲线所表示的三个量,确定横坐标所表示的量后,讨论纵坐标与曲线的关系;确定纵坐标所表示的量,讨论横坐标与曲线的关系。
(2)“先拐先平,数值大”原则。在化学平衡图像中,先出现拐点的反应则先达到平衡,先出现拐点的曲线表示的温度较高(图8)或表示的压强较大(图9)。
图8表示T2>T1。升高温度,平衡时C的质量分数减小,故平衡向逆反应方向移动,正反应是放热反应。图9表示p1
可逆反应在一定条件下达到的化学平衡状态是有条件的,若外界条件改变引起正反应速率和逆反应速率的改变,并且两者改变的程度不相等,则原来的化学平衡状态会被破坏,将在新的条件下建立新的化学平衡状态,即发生化学平衡的移动。
1.某一可逆反应,一定条件下达到了化学平衡状态。若化学反应速率改变,化学平衡是否一定发生移动?若平衡发生移动,化学反应速率是否一定发生改变?提示:化学反应速率改变,平衡不一定移动。若速率改变后,v正=v逆,平衡不移动;若v正≠v逆,则平衡发生移动。若平衡发生移动,说明v正≠v逆,即化学反应速率一定发生改变。
2.化学反应达到平衡后,改变温度平衡是否一定发生移动?提示:是。只要升高温度,新平衡状态下的反应速率一定大于原平衡状态下的反应速率,化学平衡向吸热反应方向移动;降低温度,新平衡状态下的反应速率一定小于原平衡状态下的反应速率,化学平衡向放热反应方向移动。
典例剖析已知:①N2(g)+3H2(g) 2NH3(g) ΔH<0②2NH3(g) N2(g)+3H2(g) ΔH>0其中v-t图像为
(1)对于反应①,t1时刻改变的条件为 ; t2时刻改变的条件为 。 (2)对于反应②,t1时刻改变的条件为 ; t2时刻改变的条件为 。答案:(1)增大压强 降低温度 (2)升高温度 减小压强解析:t1时刻反应速率增大,说明是升高温度或增大压强;而t2时刻反应速率减小,说明是降低温度或减小压强。
【拓展延伸】 对于反应①,以上条件的改变对反应物转化率有什么影响?答案:对于反应①,增大压强或降低温度,平衡正向移动,反应物转化率增大;升高温度或减小压强,平衡逆向移动,反应物转化率减小。
学以致用1.在恒温恒容的条件下,2A(g)+B(g) 2C(g)的反应速率随反应时间的变化示意图如下,下列叙述与示意图不相符的是( )。
A.反应达到平衡时,正反应速率和逆反应速率相等B.平衡状态Ⅰ后,可能是增大A的浓度,平衡发生移动,达到平衡状态ⅡC.平衡状态Ⅰ后,可能是减小C的浓度,平衡发生移动,达到平衡状态ⅡD.B在平衡状态Ⅰ和平衡状态Ⅱ时浓度不相等答案:C
解析:由题给图像可以看出,平衡状态Ⅰ改变的瞬间,逆反应速率未改变,正反应速率突然增大,可知改变条件为增大反应物的浓度,B项正确,C项不正确;由于平衡发生移动,可知两平衡状态时同一种反应物的浓度不相等,D项正确。
2.已知某可逆反应mA(g)+nB(g) pC(g)在密闭容器中进行,如图表示在不同反应时间t时,温度T和压强p与反应物B在混合气体中的体积分数[φ(B)]的关系曲线,由曲线分析,下列判断正确的是( )。A.T1
(2)平衡移动的结果是“减弱”外界条件的影响,而不是“消除”外界条件的影响,更不是“扭转”外界条件的影响。①从定性角度看,平衡移动的方向为减弱外界条件变化的方向,如增大反应物浓度,平衡就向减弱这种改变即反应物浓度减小的方向移动;增大压强,平衡就向气体体积缩小即气体的物质的量减小、压强减小的方向移动;升高温度,平衡就向吸热反应即使温度降低的方向移动。这种移动可以理解为与条件改变“对着干”。
②从定量角度看,平衡移动的结果只是减弱了外界条件的变化,而不能完全抵消外界条件的变化。如向平衡体系N2(g)+3H2(g) 2NH3(g)(平衡时,N2、H2、NH3的物质的量分别为a ml、b ml、c ml)中又充入d ml N2,则达到新平衡时,n(N2)的取值范围为a ml
典例剖析将等物质的量的X、Y气体充入某密闭容器中,在一定条件下,发生反应并达到平衡:X(g)+3Y(g) 2Z(g) ΔH<0。当改变某个条件并维持新条件直至新的平衡时,表中关于新平衡与原平衡的比较正确的是( )。
解析:升高温度,平衡逆向移动,X的转化率变小,A项正确;增大压强,平衡正向移动,但容器的容积减小,X的浓度增大,B项错误;充入一定量Y,X的转化率增大,而Y的转化率减小,C项错误;使用适当催化剂,只能增大反应速率,不能使平衡发生移动,X的体积分数不变,D项错误。
【拓展延伸】 对于反应X(g)+3Y(g) 2Z(g) ΔH<0,建立平衡后增大X的转化率的方法有哪些?答案:增大Y的浓度、增大压强、降低温度等。
方法归纳 应用勒夏特列原理需要注意的问题。 (1)确定条件的改变是否影响化学平衡,即确定是不是改变了影响化学平衡的条件。 ①改变化学平衡体系中固体或纯液体的物质的量,并未改变影响化学平衡的条件。 ②即使是有气体存在的化学平衡体系,在恒容、恒温条件下充入稀有气体,也未改变影响化学平衡的条件。
(2)可逆反应是否存在能够减弱某项条件改变的反应方向。例如aA(g)+bB(g) cC(g)+dD(g),当a+b=c+d时,即使改变压强,化学平衡也不移动。
学以致用1.下列不能用勒夏特列原理解释的事实是( )。A.增大压强(减小容器的容积),NO2与N2O4混合气体的颜色先变深后变浅B.增大压强(减小容器的容积),氢气、碘蒸气、碘化氢气体组成的平衡体系颜色变深C.黄绿色的氯水光照后颜色变浅D.向含有Fe(SCN)3的红色溶液中加铁粉,振荡,溶液红色变浅或褪去
解析:A项,涉及二氧化氮与四氧化二氮的平衡转化,故可以用勒夏特列原理解释;B项,增大压强后平衡不移动,但容器的容积缩小,碘蒸气浓度增大使体系颜色变深,故不能用勒夏特列原理解释;C项,光照后,次氯酸见光分解,使氯气与水反应的平衡正向移动,故可以用勒夏特列原理解释;D项,在该溶液中存在平衡:Fe3++3SCN- Fe(SCN)3,向溶液中加入铁粉,Fe3+会与Fe发生反应生成Fe2+,导致Fe3+浓度降低,平衡向能够减弱这种改变的方向移动,即向逆反应方向移动,使Fe(SCN)3的浓度降低,所以溶液红色变浅或褪去,故可以用勒夏特列原理解释。
2.在密闭容器中进行反应:A(g)+3B(g) 2C(g)。下列有关图像的说法不正确的是( )。
A.依据图a可判断正反应为放热反应B.在图b中,虚线可表示使用了催化剂C.若正反应的ΔH<0,图c可表示升高温度使平衡向逆反应方向移动D.由图d中混合气体的平均相对分子质量随温度的变化情况,可推知正反应的ΔH>0答案:D
解析:由图d可知,混合气体的平均相对分子质量随温度的升高而降低,即温度升高,平衡向逆反应方向移动,故正反应的ΔH<0。
3.在2 L恒容密闭容器中充入2 ml X和1 ml Y,发生反应: 2X(g)+Y(g) 3Z(g),反应过程中持续升高温度,测得X的体积分数与温度的关系如图所示。下列推断正确的是( )。A.Q点时,Y的转化率最大B.升高温度,平衡常数增大C.W点X的正反应速率等于M点X的正反应速率D.平衡时,再充入Y,达到平衡时Z的体积分数一定增大
解析:从反应开始到Q点是正向建立平衡的过程,Y的转化率逐渐增大,从Q点到M点升高温度,平衡逆向移动,Y的转化率降低,即Q点时Y的转化率最大,A项正确;分析图像,X的体积分数先减小到最低,这是化学平衡的建立过程,后增大,这是平衡的移动过程,升高温度,X的体积分数增大,说明升高温度平衡逆向移动,平衡常数减小,B项错误;M点温度高,反应速率大,C项错误;平衡时再充入Y,平衡正向移动,n(Z)增大但n(Y)也增大,故Z的体积分数不一定增大,D项错误。
1.反应2A(g) 2B(g)+E(g) ΔH>0达到平衡时,要使正反应速率减小,A的浓度增大,应采取的措施是( )。A.增大压强B.减小压强C.减少E的浓度D.降低温度答案:D解析:正反应速率减小,可能是减小压强或降低温度,A的浓度增大,说明平衡向逆反应方向移动,只能是降低温度。
2.下列事实不能用勒夏特列原理解释的是( )。
解析:勒夏特列原理用于解释改变条件后化学平衡的移动方向问题,所以必须涉及化学平衡的移动。
3.NO与CO是燃油汽车尾气中的两种有害气体,常温常压下它们之间发生反应:CO(g)+NO(g) CO2(g)+ N2(g) ΔH=-374.3 kJ·ml-1;K=2.5×1060。有关该反应的说法不正确的是( )。A.因为K很大,所以反应速率很大,NO与CO排入大气之前就已经反应完全B.升高温度,反应速率增大,K减小C.增大压强,平衡向右移动,K不变D.选用适宜催化剂可使其达到尾气排放标准
解析:K只能反映化学反应正向进行的程度,不能反映化学反应进行的快慢,K>105认为完全反应,但是不知道速率大小不能判断NO与CO排入大气之前就已经反应完全,A项错误;升高温度,速率增大,正反应为放热反应,升高温度平衡逆向移动,K减小,B项正确;正反应是气体分子数减小的反应,增大压强,平衡向右移动,但是温度不变,K不变,C项正确;选用适宜催化剂可以增大反应速率,可使其达到尾气排放标准,D项正确。
4.已知反应COCl2(g) CO(g)+Cl2(g) ΔH>0,当反应达到平衡时,下列措施:①升温 ②恒容通入惰性气体 ③增加CO浓度 ④减压 ⑤加催化剂 ⑥恒压通入惰性气体其中能提高COCl2转化率的是( )。A.①②④B.①④⑥C.②③⑤D.③⑤⑥答案:B
解析:该反应的正反应是气体体积增大的吸热反应,所以升温和减压均可以促使反应正向移动。恒压通入惰性气体,相当于减压,使平衡正向移动。恒容通入惰性气体与加催化剂均对平衡无影响。增加CO的浓度,将导致平衡逆向移动。
5.在温度一定时,反应N2O4(g) 2NO2(g)平衡体系中NO2的体积分数φ(NO2)随压强的变化情况如图所示(实线上的点表示对应压强下的平衡点),下列说法正确的是( )。
下列说法正确的是( )。A.A、C两点的正反应速率的关系为v(A)>v(C)B.A、B、C、D、E各状态中,v正
回答下列问题。(1)①表示改变压强的方式是 压强,化学平衡 移动,m+n p+q。 (2)②表示改变压强的方式是 压强,化学平衡 移动,m+n p+q。 (3)③表示改变压强的方式是 压强,化学平衡 移动,m+n p+q。 答案:(1)增大 逆向 < (2)减小 正向 <(3)减小 不 =
化学选择性必修1第二章 化学反应速率与化学平衡第二节 化学平衡说课ppt课件: 这是一份化学选择性必修1第二章 化学反应速率与化学平衡第二节 化学平衡说课ppt课件,共52页。PPT课件主要包含了第二节化学平衡,新课情景呈现,课前素能奠基,化学平衡,浓度幂之积,平衡常数,不完全,课堂素能探究,名师博客呈现,课堂达标验收等内容,欢迎下载使用。
人教版 (2019)选择性必修1第二节 化学平衡评课ppt课件: 这是一份人教版 (2019)选择性必修1第二节 化学平衡评课ppt课件,共52页。PPT课件主要包含了第二节化学平衡,新课情景呈现,课前素能奠基,正反应,逆反应,可逆反应的特点,保持不变,可逆反应,新的化学平衡,课堂素能探究等内容,欢迎下载使用。
人教版 (2019)选择性必修1实验活动1 探究影响化学平衡移动的因素课文内容ppt课件: 这是一份人教版 (2019)选择性必修1实验活动1 探究影响化学平衡移动的因素课文内容ppt课件,共52页。PPT课件主要包含了变浅黄色,变深橙色,变深蓝色等内容,欢迎下载使用。













