



苏教版 (2019)选择性必修1第四单元 沉淀溶解平衡试讲课ppt课件
展开1.能根据化学平衡移动原理分析难溶电解质沉淀溶解平衡的本质
1.认识难溶电解质在水溶液中存在沉淀溶解平衡2.了解沉淀的生成与溶解
物质在水中的溶解度将物质分为易溶、可溶、微溶、难溶等。那么,难溶的物质在水中是否完全不溶呢?
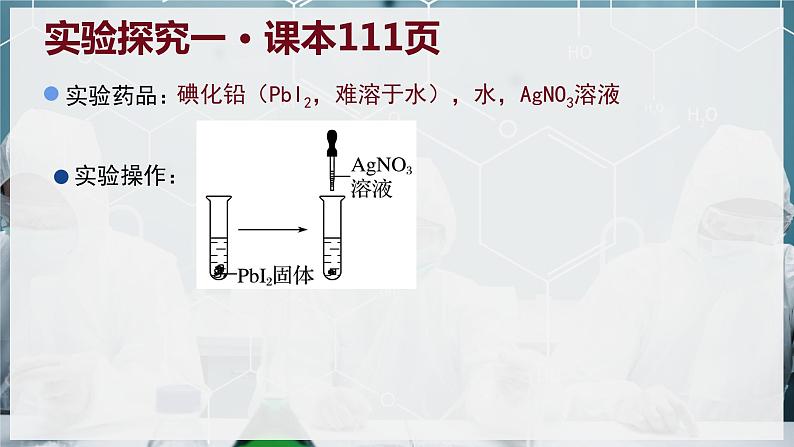
碘化铅(PbI2,难溶于水),水,AgNO3溶液
实验探究一 · 课本111页
原上层清液中含有I-,虽然难溶电解质PbI2的溶解度很小,但在水中仍有极少量的溶解。
Ag2SO4Ca(OH)2CaSO4
CaCO3AgClAgBrAg2SBaSO4Mg(OH)2Fe(OH)3
习惯上将溶解度小于0.01 g的电解质称为难溶电解质。 尽管难溶电解质的溶解度很小,但在水中并不是绝对不溶。
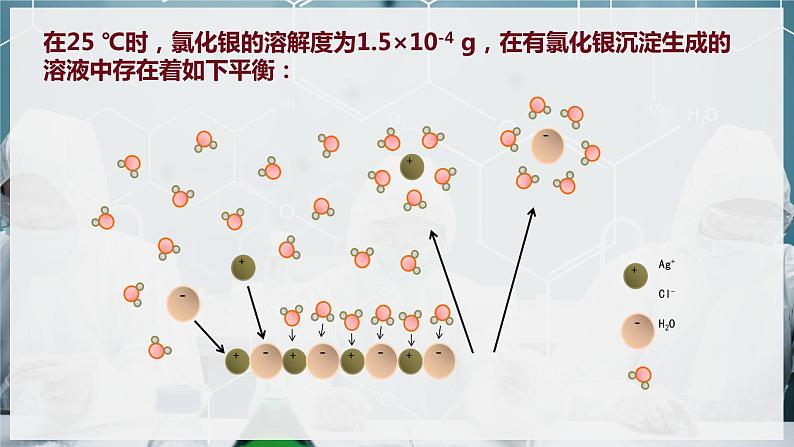
在25 ℃时,氯化银的溶解度为1.5×10-4 g,在有氯化银沉淀生成的溶液中存在着如下平衡:
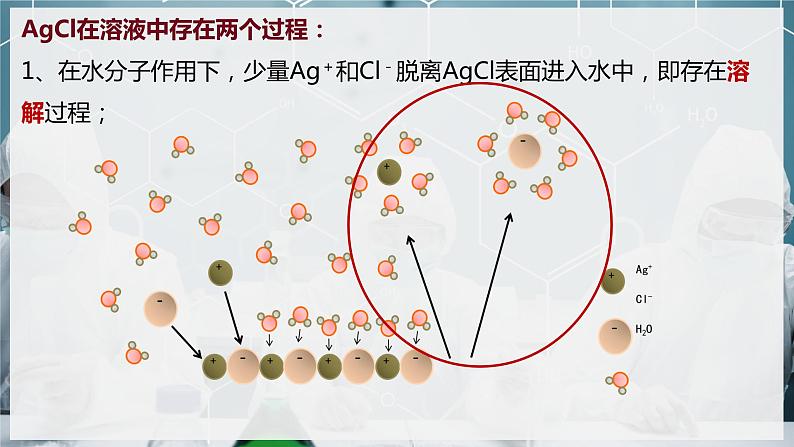
AgCl在溶液中存在两个过程:1、在水分子作用下,少量Ag+和Cl-脱离AgCl表面进入水中,即存在溶解过程;
AgCl在溶液中存在两个过程:2、溶液中的Ag+和Cl-受AgCl表面阴、阳离子的吸引,回到AgCl表面析出,即存在沉淀过程。
1.沉淀溶解平衡的建立:
V溶解>V沉淀 ,固体溶解
V溶解= V沉淀 ,溶解平衡
V溶解<V沉淀 ,沉淀析出
1.沉淀溶解平衡的建立
在一定温度下,当难溶电解质溶于水形成饱和溶液时,溶解速率和生成沉淀速率相等的状态。
2.溶解平衡常数的表达式:
AgCl(s) ⇌Ag+(aq) + Cl-(aq)
AmBn(s) ⇌ mAn++nBm-
注意:①可逆号表示沉淀、溶解同时进行 ②物质状态:固体(s)、溶液(aq)
1.请写出BaSO4、CaCO3、AgI、Ag2S的沉淀溶解平衡表达式。
2.沉淀溶解平衡的特点
达到平衡时,固体质量、离子浓度不变
外界条件改变,溶解平衡将发生移动
二、沉淀溶解平衡的影响因素
加入可与难溶电解质溶解所得的离子反应的物质,沉淀溶解平衡向溶解方向移动。
升高温度,多数沉淀溶解平衡向溶解方向移动;少数沉淀溶解平衡向生成沉淀方向移动,如Ca(OH)2的沉淀溶解平衡。
加水稀释,沉淀溶解平衡向溶解方向移动。
加入与难溶电解质构成中相同的离子,平衡向生成沉淀方向移动。
溶洞是石灰岩地区的地下水长期侵蚀岩层而形成的。石灰岩主要成分是碳酸钙。碳酸钙难溶于水,在25 ℃时,溶解度仅为7.1×10-4 g。当溶有CO2的水流经石灰岩时,能够发生和建立如下平衡:
当水中溶有的CO2浓度较大时,该平衡能够向着碳酸钙溶解的方向移动,生成溶解度相对较大的Ca(HCO3)2;当CO2的浓度减小或温度升高时,该平衡又向着逆反应方向移动,重新析出CaCO3沉淀。
三、溶度积的概念与表达式
Ksp = c(Ag+)· c(Cl-)
Ksp只受难溶物质本身和温度影响。
对于相同类型的难溶电解质,KSP 的数值越大,其在水中的溶解能力越强 。不同类型的难溶电解质KSP 不具有可比性。
溶解在水溶液中离子浓度的乘积
2.请写出AgCl、AgI、Ag2CrO4的Ksp表达式。
3.请根据常温下AgCl、AgI、Ag2CrO4的Ksp常数比较它们的溶解度。
4. 常温下,某溶液中含有Cl-、I-、CrO4-2,均为0.01ml/L,向该溶液中逐滴0.01ml/L的AgNO3溶液,三种阴离子产生沉淀的先后顺序。
溶液中离子沉淀顺序与溶解度有关,溶解度越小越先沉淀。
以AgCl(s) ⇌Ag+(aq) + Cl-(aq)△H为例,(AgCl)
(1)判断沉淀生成顺序
对于同类型且含有相同离子的沉淀,溶度积越小,沉淀越先生成。
(2)判断沉淀生成的条件。
看Qc与Ksp的关系Qc=Ksp,沉淀溶解平衡Qc>Ksp,生成沉淀Qc<Ksp,沉淀溶解
(1)根据已知溶度积,求饱和溶液中某种离子浓度。
(2)计算沉淀转化反应的平衡常数
如反应Cu2++ZnS(s) ⇌ CuS(s)+Zn2+
人教版 (2019)选择性必修1第四节 沉淀溶解平衡背景图ppt课件: 这是一份人教版 (2019)选择性必修1第四节 沉淀溶解平衡背景图ppt课件,共15页。
高中化学人教版 (2019)选择性必修1第四节 沉淀溶解平衡授课课件ppt: 这是一份高中化学人教版 (2019)选择性必修1第四节 沉淀溶解平衡授课课件ppt,共27页。PPT课件主要包含了镁与水的反应,探究活动,溶液显碱性,难溶并非不溶,有气泡产生溶液变红,溶解度,nAgCl,V溶液,≈1×10-6mol,100mL等内容,欢迎下载使用。
高中化学苏教版 (2019)选择性必修1第四单元 沉淀溶解平衡优秀课件ppt: 这是一份高中化学苏教版 (2019)选择性必修1第四单元 沉淀溶解平衡优秀课件ppt,共21页。PPT课件主要包含了核心素养发展目标,了解沉淀的转化,学习目标,课前导入,交流讨论,沉淀的生成,随堂反馈,实验探究一,沉淀的转化,原理解释等内容,欢迎下载使用。













