

还剩38页未读,
继续阅读
所属成套资源:人教版 (2019)高中化学选择性必修1 同步课件
成套系列资料,整套一键下载
- 2.4 化学反应的调控课件PPT 课件 1 次下载
- 3.1电离平衡课件PPT 课件 0 次下载
- 3.2.2 酸碱中和滴定课件PPT 课件 2 次下载
- 3.3.1 盐类的水解课件PPT 课件 2 次下载
- 3.3.2 影响盐类水解的主要因素 盐类水解的应用课件PPT 课件 3 次下载
3.2.1 水的电离 溶液的酸碱性与pH课件PPT
展开
这是一份3.2.1 水的电离 溶液的酸碱性与pH课件PPT,共46页。
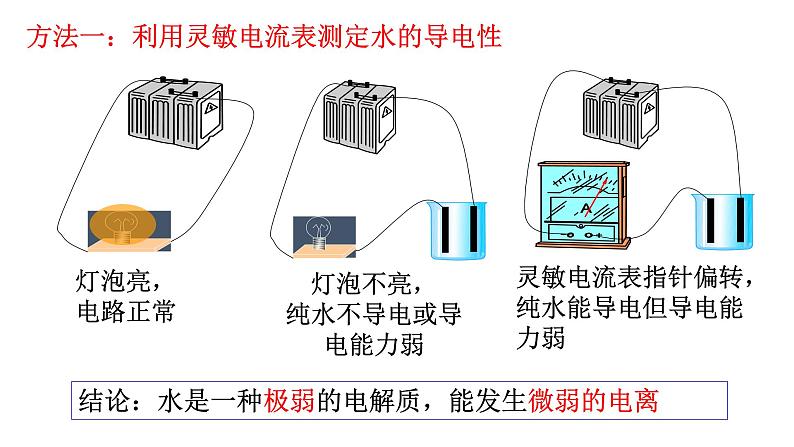
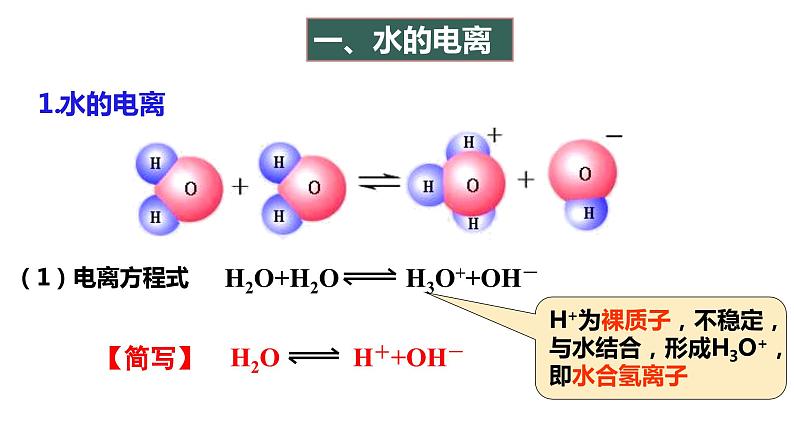
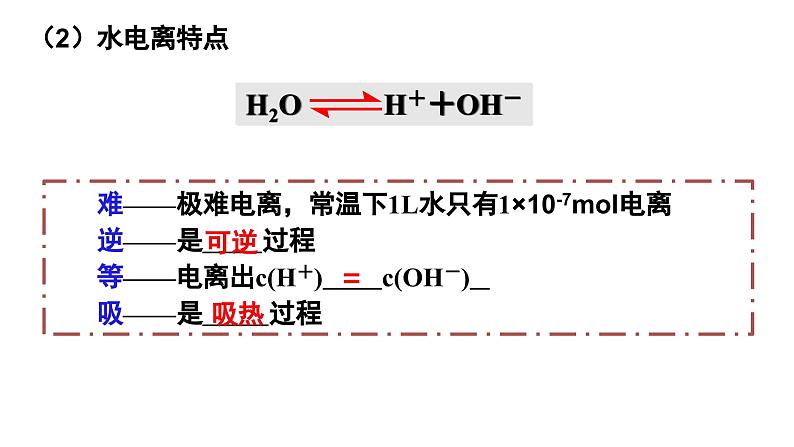
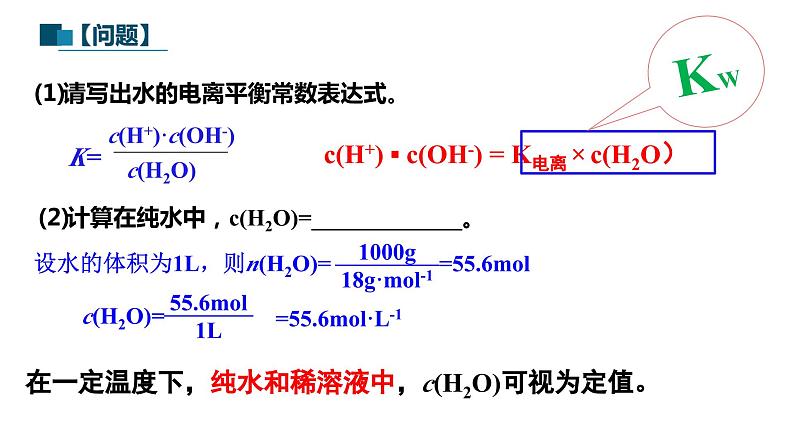
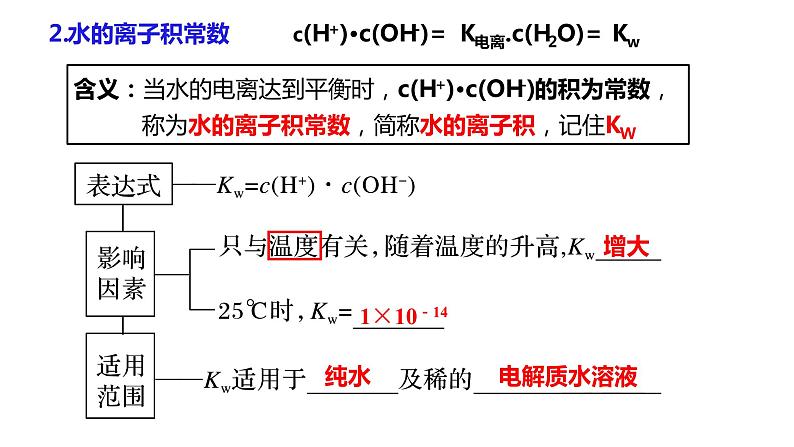
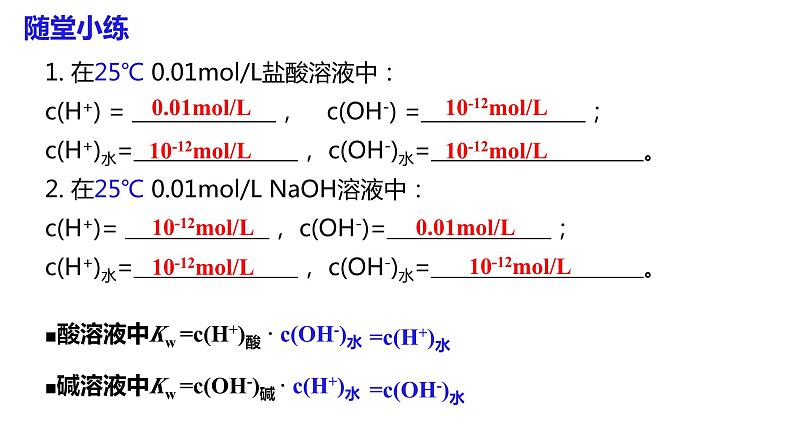
第1课时 水的电离、溶液的酸碱性与pH第二节 水的电离和溶液的pH第三章 水溶液中的离子反应与平衡【思考与讨论】 在水溶液中,酸、碱和盐全部或部分以离子形式存在,那么,其中的溶剂——水是全部以分子形式存在,还是部分以离子形式存在呢? 怎样验证你的猜想? H2O是一种最普通而又具有许多特性的物质,也是应用最广泛的溶剂。 方法一:利用灵敏电流表测定水的导电性 灯泡亮,电路正常灯泡不亮,纯水不导电或导电能力弱灵敏电流表指针偏转,纯水能导电但导电能力弱结论:水是一种极弱的电解质,能发生微弱的电离一、水的电离1.水的电离H+为裸质子,不稳定,与水结合,形成H3O+,即水合氢离子【简写】(1)电离方程式(2)水电离特点难——极难电离,常温下1L水只有1×10-7mol电离逆——是 过程等——电离出c(H+) c(OH-) 吸——是 过程=吸热可逆(1)请写出水的电离平衡常数表达式。(2)计算在纯水中,c(H2O)=_____________。在一定温度下,纯水和稀溶液中,c(H2O)可视为定值。c(H+) ▪ c(OH-) = K电离 × c(H2O) KW2.水的离子积常数增大1×10-14纯水电解质水溶液含义:当水的电离达到平衡时,c(H+)•c(OH-)的积为常数, 称为水的离子积常数,简称水的离子积,记住KW=c(H+)水1. 在25℃ 0.01mol/L盐酸溶液中:c(H+) = , c(OH-) = ;c(H+)水= , c(OH-)水= 。 2. 在25℃ 0.01mol/L NaOH溶液中:c(H+)= , c(OH-)= ;c(H+)水= , c(OH-)水= 。 0.01mol/L10-12mol/L10-12mol/L10-12mol/L■酸溶液中Kw =c(H+)酸 · c(OH-)水=c(OH-)水10-12mol/L10-12mol/L10-12mol/L0.01mol/L■碱溶液中Kw =c(OH-)碱 · c(H+)水随堂小练1.某温度时,水溶液中Kw=4×10-14,那么该温度比室温(25 ℃)高还是低?该温度下纯水中c(H+)是多少?提示 因此时水的离子积大于常温时水的离子积,故温度高于25 ℃,此时c(H+)=2×10-7mol·L-1。2.水的离子积常数Kw=c(H+)·c(OH-)中H+和OH-一定是水电离出来的吗?提示 不一定。c(H+)和c(OH-)均指溶液中H+或OH-的总浓度,如盐酸中的H+包括HCl和H2O电离产生的H+,即c(H+)=c酸(H+)+c水(H+),而OH-全部来自水的电离。3.常温下,某溶液中由水电离出来的c(H+)=1×10-11mol/L,该溶液可能是哪些?请说明理由。①二氧化硫的水溶液②氯化钠的水溶液③硝酸钠的水溶液④氢氧化钠的水溶液提示 c(H+)=1×10-11mol/L<1×10-7mol/L,抑制了水的电离,可能是酸性也可能是碱性 ①④【练1】在由水电离产生的H+浓度为1×10-13mol·L-1的溶液中,一定能大量共存的离子组是( )① K+、Cl-、NO3-、S2- ② K+、Fe2+、I-、SO42- ③ Na+、Cl-、NO3-、SO42-④Na+、Ca2+、Cl-、HCO3- ⑤ K+、Ba2+、Cl-、NO3-A.①③ B.③⑤ C.③④ D.②⑤酸性条件不能共存碱性条件不能共存能共存酸、碱性条件都不能共存能共存B 右移增大增大增大左移增大减小不变左移减小增大不变右移减小增大不变右移增大减小不变右移减小增大不变左移增大减小不变【思考】水的电离平衡曲线的理解与识别(1)曲线上的任意点(如a,b,c)的Kw都 ,即c(H+)·c(OH-) ,温度 。(2)曲线外的任意点(如d)与曲线上任意点的Kw ,温度 。相同相同相同(3)实现曲线上点之间的转化需保持温度不变,改变 ;实现曲线上点与曲线外点之间的转化一定改变 。不同不同酸碱性温度 DB二、溶液的酸碱性与pH根据室温时水的电离平衡,运用平衡移动原理分析下列问题。 【思考与讨论】10-7 mol/L中性10-7 mol/Lc(H+) = c(OH-)减小增大增大减小碱性酸性c(H+) > c(OH-)c(H+) < c(OH-)1.溶液的酸碱性(1)任何水溶液中都有H+和OH-。(2)溶液的酸碱性取决于溶液中c(H+)、c(OH-)的相对大小。= 1×10-7> 1×10-7< 1×10-7c(H+) = c(OH-)c(H+) > c(OH-)c(H+) < c(OH-)①某溶液中c(H+)=1×10-6 mol·L-1,该溶液一定呈酸性吗?如何判断溶液的酸碱性? 提示 未指明温度,不一定呈酸性。②在初中化学中我们用pH表示溶液的酸碱度,那么pH与c(H+)有什么关系呢? (1)pH定义:c(H+)的负对数(2)计算公式:pH=-lg c(H+)c(H+) =10-pH2.溶液的pH与c(H+)及酸碱性的关系(3)常温下c(H+)、pH与溶液酸碱性的关系:① 当c(H+) = 10-7 mol/L,pH=7,溶液呈中性。 ② 当c(H+)>10-7 mol/L,pH<7,溶液呈酸性。pH越小,酸性越强③ 当c(H+)<10-7 mol/L,pH>7,溶液呈碱性。pH越大,碱性越强①pH适用于c(H+) 或 c(OH-)≤1mol/L的溶液的酸碱性表示,常温时pH的范围0-14② c(H+)越大,pH越小,酸性越强。③pH是否等于7,仅为常温时溶液是否是中性的判断依据100℃下, Kw = 55×10-14 ≈ 10-12 c(H+) = c(OH-) = Kw1/2 =1.0×10-6pH = -lgc(H+) = -lg(1.0×10-6) = 6pH 等于 7 的溶液不一定为中性【练1】常温下,求pH:(lg2≈0.3 ) (1)c(H+)为1×10-7mol/L的溶液 (2) 0.05mol/L 的硫酸溶液 (3) c(H+)=2×10-5mol/L的HCl溶液 (4) 0.01mol/L的NaOH溶液 (5) c(OH-)=0.01mol/L的Ba(OH)2溶液 (6)常温下,0.05mol/L的硫酸溶液中水电离出的c(H+)= ; (7)常温下,pH=12的Ba(OH)2的浓度 。pH=7pH=1pH=4.7pH=12pH=120.005mol/L1×10-13【练2】25℃,下列溶液的酸性最强的是 ( ) A.0.01mol/L HCl B.pH=2的H2SO4溶液 C.c(OH-)=10-13 mol/LD.pH=1溶液加水稀释1倍C溶液的pH可以用pH试纸测量,也可以用pH计测量。①pH试纸类型广泛pH试纸 pH范围1~14(最常用) 或1~10、pH差约为1精密pH试纸 pH范围较窄,pH差为0.2或0.3专用pH试纸 酸性或碱性溶液专用3.溶液酸碱性的测定①pH试纸使用方法:取一小片pH试纸于干燥洁净的 上, 用干燥洁净的玻璃棒蘸取待测液点在试纸的中央,当试纸变色后与 对照比色,读出pH。玻璃片(或表面皿)标准比色卡注意:① pH试纸不能润湿;(检验气体要润湿)② pH试纸不能直接插入待测液③广泛pH试纸读数只能是整数,不能是小数②用pH计测定(准确读数)pH计,又叫 ,可用来精密测量溶液的pH,其量程为 。可识别的pH差:0.01。酸度计0~14③酸碱指示剂法(只能测定pH大致范围)红紫蓝无浅红红红橙黄4.pH的测定和调控的意义 【练3】下列关于pH测定的说法正确的是( )A.pH试纸在使用之前应用蒸馏水润湿B.用广泛pH试纸测得某盐酸的pH=2.3C.利用酸碱指示剂可以测溶液的pHD.pH计是精确测定溶液pH的仪器D1.单一溶液pH的计算①酸性溶液:②碱性溶液:三、溶液pH的计算【例】常温下,计算0.05mol/L的H2SO4溶液中的pH值。解:c(H+)=2c(H2SO4)=0.05×2=10-1mol/LpH =-lg 0.1=1先求c(H+),再计算pH = -lgc(H+) 【例】常温时,计算浓度为0.005mol/L的Ba(OH)2溶液的pH解:c(OH-)=0.005×2=10-2mol/L pH =-lg c(H+)=122.混合溶液pH的计算方法(1)强酸与强酸混合(稀溶液体积变化忽略)【例】求算25℃时pH=3的盐酸与pH=5的硫酸等体积混合后的pH。lg2≈0.3 lg7≈0.85 lg5≈0.7lg3≈0.48pH=-lgc(H+)=-lg(5×10-4)=3.3 解:(2)强碱与强碱混合(稀溶液体积变化忽略)【例】在25℃时,pH等于9和pH等于11的两种氢氧化钠溶液等体积混合pH等于多少?pH=10.7【例】在25℃时,100mL 0.6mol/L的盐酸与等体积0.4mol/L 的氢氧化钠溶液混合后,溶液的pH等于多少?②酸过量:(3)强酸与强碱混合(稀溶液体积变化忽略)①恰好完全反应,溶液呈中性,pH=7 (25 ℃)。pH=1③碱过量:【例】pH=2盐酸和pH=13的Ba(OH)2溶液等体积相混合,求混合后溶液的pH。pH≈12.7【及时练习】按要求计算下列溶液的pH(忽略溶液混合时体积的变化):(1)常温下,0.005 mol·L-1的稀硫酸。(2)常温下,将0.1 mol·L-1氢氧化钠溶液与0.06 mol·L-1硫酸溶液等体积混合。(3)25 ℃时,pH=3的硝酸溶液和pH=12的氢氧化钡溶液以体积比9∶1混合。答:(1)pH=2 (2)pH=2 (3)pH=103. 溶液稀释pH的计算方法【例1】在25℃时,pH等于2的盐酸溶液稀释到原来的1000倍后, pH等于多少?再稀释到原来的10000倍呢?【例2】在25℃时,pH等于9的强碱溶液稀释到原来的10倍,pH为多少?稀释到1000倍后, pH等于多少?(1)强酸或强碱54910约为7约为7(2)弱酸或弱碱在稀释弱酸或弱碱的过程中既有浓度的变化,又有电离平衡的移动,不能求得具体的数值,只能确定pH范围,如:pH=3的醋酸溶液,稀释100倍,稀释后溶液的pH3<pH<5pH=10的氨水溶液,稀释100倍,稀释后溶液的pH8<pH<10①强酸pH=a,加水稀释10n,则 pH=a+n<7③弱酸pH= a ,加水稀释10n,则 a <pH< a+n <7④弱碱pH=b,加水稀释10n,则 b>pH>b-n>7。②强碱pH=b,加水稀释10n,则 pH=b-n>7溶液稀释后pH的计算规律4.强弱电解质的稀释规律【例1】常温下,pH=13的NaOH溶液加水稀释为原来的10倍,则pH= ;若稀释为原来的103倍,则pH= ;稀释107倍,则pH 。【例2】常温下,pH=13的 NH3·H2O溶液加水稀释为原来的100倍,则pH范围为 ;稀释108倍,则pH范围为 。【练3】将体积均为10 mL、pH均为3的盐酸和醋酸,加水稀释至a mL和b mL,测得稀释后溶液的pH均为5,则稀释后溶液的体积( ) A.a=b=100 B.a=b=1000 C.ab【及时练习】C1210≈7111×10-14 C.=1×10-14 D.不确定2.向纯水中加入少量NaHSO4固体,在温度不变时,溶液中( ) A.c(H+)/c(OH-)增大 B.c(H+)减小 C.c(H+)与c(OH-)的乘积增大 D.c(OH-)增大3.室温下,某溶液中由水电离产生的c(H+)=1×10-10mol/L,该溶液的溶质不可能是( ) A.NaHSO4 B.NaCl C.HCl D.Ba(OH)2CAB4.已知在100℃时水的离子积Kw=1×10-12,下列溶液的温度均为100℃,其中说法正确的是( )A.0.005mol/L的H2SO4溶液,pH=2B.0.01mol/L的NaOH溶液,pH=11C.0.005mol/L 的H2SO4溶液与0.01mol/L的NaOH溶液等体积混合,混合溶液的pH为6,溶液显酸性D.完全中和pH=3的H2SO4溶液50mL,需要pH=9的NaOH溶液100mLA5.常温下,关于溶液稀释的说法正确的是( )A.将1L 0.1mol/L的Ba(OH)2溶液加水稀释为2L,pH=13B.pH=3的醋酸溶液加水稀释100倍,pH=5C.pH=4的H2SO4溶液加水稀释100倍,溶液中由水电离产生的 c(H+)=1×10-6mol/LD.pH=8的NaOH溶液加水稀释100倍,其pH=6A6.常温下,按要求完成关于溶液稀释的问题。(1)将2L 0.1mol/L的Ba(OH)2溶液加水稀释为4L,pH= 。(2)pH=3的H2SO4溶液加水稀释1000倍,溶液中由水电离产生的c(H+)= 。(3)体积相同、pH均为3的盐酸和醋酸,加入水稀释至amL和bmL,测得稀释后溶液的pH均为5,则a b(填“>”“<”“=”)。(4)pH=5的硫酸稀释10000倍后,c(H+):c(SO42-)= 。131×10-8mol/L<200:1
第1课时 水的电离、溶液的酸碱性与pH第二节 水的电离和溶液的pH第三章 水溶液中的离子反应与平衡【思考与讨论】 在水溶液中,酸、碱和盐全部或部分以离子形式存在,那么,其中的溶剂——水是全部以分子形式存在,还是部分以离子形式存在呢? 怎样验证你的猜想? H2O是一种最普通而又具有许多特性的物质,也是应用最广泛的溶剂。 方法一:利用灵敏电流表测定水的导电性 灯泡亮,电路正常灯泡不亮,纯水不导电或导电能力弱灵敏电流表指针偏转,纯水能导电但导电能力弱结论:水是一种极弱的电解质,能发生微弱的电离一、水的电离1.水的电离H+为裸质子,不稳定,与水结合,形成H3O+,即水合氢离子【简写】(1)电离方程式(2)水电离特点难——极难电离,常温下1L水只有1×10-7mol电离逆——是 过程等——电离出c(H+) c(OH-) 吸——是 过程=吸热可逆(1)请写出水的电离平衡常数表达式。(2)计算在纯水中,c(H2O)=_____________。在一定温度下,纯水和稀溶液中,c(H2O)可视为定值。c(H+) ▪ c(OH-) = K电离 × c(H2O) KW2.水的离子积常数增大1×10-14纯水电解质水溶液含义:当水的电离达到平衡时,c(H+)•c(OH-)的积为常数, 称为水的离子积常数,简称水的离子积,记住KW=c(H+)水1. 在25℃ 0.01mol/L盐酸溶液中:c(H+) = , c(OH-) = ;c(H+)水= , c(OH-)水= 。 2. 在25℃ 0.01mol/L NaOH溶液中:c(H+)= , c(OH-)= ;c(H+)水= , c(OH-)水= 。 0.01mol/L10-12mol/L10-12mol/L10-12mol/L■酸溶液中Kw =c(H+)酸 · c(OH-)水=c(OH-)水10-12mol/L10-12mol/L10-12mol/L0.01mol/L■碱溶液中Kw =c(OH-)碱 · c(H+)水随堂小练1.某温度时,水溶液中Kw=4×10-14,那么该温度比室温(25 ℃)高还是低?该温度下纯水中c(H+)是多少?提示 因此时水的离子积大于常温时水的离子积,故温度高于25 ℃,此时c(H+)=2×10-7mol·L-1。2.水的离子积常数Kw=c(H+)·c(OH-)中H+和OH-一定是水电离出来的吗?提示 不一定。c(H+)和c(OH-)均指溶液中H+或OH-的总浓度,如盐酸中的H+包括HCl和H2O电离产生的H+,即c(H+)=c酸(H+)+c水(H+),而OH-全部来自水的电离。3.常温下,某溶液中由水电离出来的c(H+)=1×10-11mol/L,该溶液可能是哪些?请说明理由。①二氧化硫的水溶液②氯化钠的水溶液③硝酸钠的水溶液④氢氧化钠的水溶液提示 c(H+)=1×10-11mol/L<1×10-7mol/L,抑制了水的电离,可能是酸性也可能是碱性 ①④【练1】在由水电离产生的H+浓度为1×10-13mol·L-1的溶液中,一定能大量共存的离子组是( )① K+、Cl-、NO3-、S2- ② K+、Fe2+、I-、SO42- ③ Na+、Cl-、NO3-、SO42-④Na+、Ca2+、Cl-、HCO3- ⑤ K+、Ba2+、Cl-、NO3-A.①③ B.③⑤ C.③④ D.②⑤酸性条件不能共存碱性条件不能共存能共存酸、碱性条件都不能共存能共存B 右移增大增大增大左移增大减小不变左移减小增大不变右移减小增大不变右移增大减小不变右移减小增大不变左移增大减小不变【思考】水的电离平衡曲线的理解与识别(1)曲线上的任意点(如a,b,c)的Kw都 ,即c(H+)·c(OH-) ,温度 。(2)曲线外的任意点(如d)与曲线上任意点的Kw ,温度 。相同相同相同(3)实现曲线上点之间的转化需保持温度不变,改变 ;实现曲线上点与曲线外点之间的转化一定改变 。不同不同酸碱性温度 DB二、溶液的酸碱性与pH根据室温时水的电离平衡,运用平衡移动原理分析下列问题。 【思考与讨论】10-7 mol/L中性10-7 mol/Lc(H+) = c(OH-)减小增大增大减小碱性酸性c(H+) > c(OH-)c(H+) < c(OH-)1.溶液的酸碱性(1)任何水溶液中都有H+和OH-。(2)溶液的酸碱性取决于溶液中c(H+)、c(OH-)的相对大小。= 1×10-7> 1×10-7< 1×10-7c(H+) = c(OH-)c(H+) > c(OH-)c(H+) < c(OH-)①某溶液中c(H+)=1×10-6 mol·L-1,该溶液一定呈酸性吗?如何判断溶液的酸碱性? 提示 未指明温度,不一定呈酸性。②在初中化学中我们用pH表示溶液的酸碱度,那么pH与c(H+)有什么关系呢? (1)pH定义:c(H+)的负对数(2)计算公式:pH=-lg c(H+)c(H+) =10-pH2.溶液的pH与c(H+)及酸碱性的关系(3)常温下c(H+)、pH与溶液酸碱性的关系:① 当c(H+) = 10-7 mol/L,pH=7,溶液呈中性。 ② 当c(H+)>10-7 mol/L,pH<7,溶液呈酸性。pH越小,酸性越强③ 当c(H+)<10-7 mol/L,pH>7,溶液呈碱性。pH越大,碱性越强①pH适用于c(H+) 或 c(OH-)≤1mol/L的溶液的酸碱性表示,常温时pH的范围0-14② c(H+)越大,pH越小,酸性越强。③pH是否等于7,仅为常温时溶液是否是中性的判断依据100℃下, Kw = 55×10-14 ≈ 10-12 c(H+) = c(OH-) = Kw1/2 =1.0×10-6pH = -lgc(H+) = -lg(1.0×10-6) = 6pH 等于 7 的溶液不一定为中性【练1】常温下,求pH:(lg2≈0.3 ) (1)c(H+)为1×10-7mol/L的溶液 (2) 0.05mol/L 的硫酸溶液 (3) c(H+)=2×10-5mol/L的HCl溶液 (4) 0.01mol/L的NaOH溶液 (5) c(OH-)=0.01mol/L的Ba(OH)2溶液 (6)常温下,0.05mol/L的硫酸溶液中水电离出的c(H+)= ; (7)常温下,pH=12的Ba(OH)2的浓度 。pH=7pH=1pH=4.7pH=12pH=120.005mol/L1×10-13【练2】25℃,下列溶液的酸性最强的是 ( ) A.0.01mol/L HCl B.pH=2的H2SO4溶液 C.c(OH-)=10-13 mol/LD.pH=1溶液加水稀释1倍C溶液的pH可以用pH试纸测量,也可以用pH计测量。①pH试纸类型广泛pH试纸 pH范围1~14(最常用) 或1~10、pH差约为1精密pH试纸 pH范围较窄,pH差为0.2或0.3专用pH试纸 酸性或碱性溶液专用3.溶液酸碱性的测定①pH试纸使用方法:取一小片pH试纸于干燥洁净的 上, 用干燥洁净的玻璃棒蘸取待测液点在试纸的中央,当试纸变色后与 对照比色,读出pH。玻璃片(或表面皿)标准比色卡注意:① pH试纸不能润湿;(检验气体要润湿)② pH试纸不能直接插入待测液③广泛pH试纸读数只能是整数,不能是小数②用pH计测定(准确读数)pH计,又叫 ,可用来精密测量溶液的pH,其量程为 。可识别的pH差:0.01。酸度计0~14③酸碱指示剂法(只能测定pH大致范围)红紫蓝无浅红红红橙黄4.pH的测定和调控的意义 【练3】下列关于pH测定的说法正确的是( )A.pH试纸在使用之前应用蒸馏水润湿B.用广泛pH试纸测得某盐酸的pH=2.3C.利用酸碱指示剂可以测溶液的pHD.pH计是精确测定溶液pH的仪器D1.单一溶液pH的计算①酸性溶液:②碱性溶液:三、溶液pH的计算【例】常温下,计算0.05mol/L的H2SO4溶液中的pH值。解:c(H+)=2c(H2SO4)=0.05×2=10-1mol/LpH =-lg 0.1=1先求c(H+),再计算pH = -lgc(H+) 【例】常温时,计算浓度为0.005mol/L的Ba(OH)2溶液的pH解:c(OH-)=0.005×2=10-2mol/L pH =-lg c(H+)=122.混合溶液pH的计算方法(1)强酸与强酸混合(稀溶液体积变化忽略)【例】求算25℃时pH=3的盐酸与pH=5的硫酸等体积混合后的pH。lg2≈0.3 lg7≈0.85 lg5≈0.7lg3≈0.48pH=-lgc(H+)=-lg(5×10-4)=3.3 解:(2)强碱与强碱混合(稀溶液体积变化忽略)【例】在25℃时,pH等于9和pH等于11的两种氢氧化钠溶液等体积混合pH等于多少?pH=10.7【例】在25℃时,100mL 0.6mol/L的盐酸与等体积0.4mol/L 的氢氧化钠溶液混合后,溶液的pH等于多少?②酸过量:(3)强酸与强碱混合(稀溶液体积变化忽略)①恰好完全反应,溶液呈中性,pH=7 (25 ℃)。pH=1③碱过量:【例】pH=2盐酸和pH=13的Ba(OH)2溶液等体积相混合,求混合后溶液的pH。pH≈12.7【及时练习】按要求计算下列溶液的pH(忽略溶液混合时体积的变化):(1)常温下,0.005 mol·L-1的稀硫酸。(2)常温下,将0.1 mol·L-1氢氧化钠溶液与0.06 mol·L-1硫酸溶液等体积混合。(3)25 ℃时,pH=3的硝酸溶液和pH=12的氢氧化钡溶液以体积比9∶1混合。答:(1)pH=2 (2)pH=2 (3)pH=103. 溶液稀释pH的计算方法【例1】在25℃时,pH等于2的盐酸溶液稀释到原来的1000倍后, pH等于多少?再稀释到原来的10000倍呢?【例2】在25℃时,pH等于9的强碱溶液稀释到原来的10倍,pH为多少?稀释到1000倍后, pH等于多少?(1)强酸或强碱54910约为7约为7(2)弱酸或弱碱在稀释弱酸或弱碱的过程中既有浓度的变化,又有电离平衡的移动,不能求得具体的数值,只能确定pH范围,如:pH=3的醋酸溶液,稀释100倍,稀释后溶液的pH3<pH<5pH=10的氨水溶液,稀释100倍,稀释后溶液的pH8<pH<10①强酸pH=a,加水稀释10n,则 pH=a+n<7③弱酸pH= a ,加水稀释10n,则 a <pH< a+n <7④弱碱pH=b,加水稀释10n,则 b>pH>b-n>7。②强碱pH=b,加水稀释10n,则 pH=b-n>7溶液稀释后pH的计算规律4.强弱电解质的稀释规律【例1】常温下,pH=13的NaOH溶液加水稀释为原来的10倍,则pH= ;若稀释为原来的103倍,则pH= ;稀释107倍,则pH 。【例2】常温下,pH=13的 NH3·H2O溶液加水稀释为原来的100倍,则pH范围为 ;稀释108倍,则pH范围为 。【练3】将体积均为10 mL、pH均为3的盐酸和醋酸,加水稀释至a mL和b mL,测得稀释后溶液的pH均为5,则稀释后溶液的体积( ) A.a=b=100 B.a=b=1000 C.ab【及时练习】C1210≈711
相关资料
更多









