资料中包含下列文件,点击文件名可预览资料内容











还剩32页未读,
继续阅读
所属成套资源:人教版化学选择性必修1PPT课件+教案+同步练习整套
成套系列资料,整套一键下载
新人教版化学选择性必修一 3.2.2 溶液的酸碱性及PH (课件+教案+练习)
展开
这是一份新人教版化学选择性必修一 3.2.2 溶液的酸碱性及PH (课件+教案+练习),文件包含新人教版化学选择性必修一322溶液的酸碱性及PH课件pptx、新人教版化学选择性必修一322溶液的酸碱性与pH针对练习含解析docx、新人教版化学选择性必修一322溶液的酸碱性与pH教案-docx等3份课件配套教学资源,其中PPT共40页, 欢迎下载使用。
第三章 水溶液中的离子反应与平衡
人教版 高中化学 必修一
第二节 水的电离和溶液的ph第2课时 溶液的酸碱性和pH
目录
一 、课标要求
二 、思考交流
三 、活学活用
四 、问题探究
1.认识溶液的酸碱性及pH。2.掌握检验溶液pH的方法。3.了解溶液的pH的计算及溶液稀释时pH的变化规律。4.了解溶液pH的调控在工农业生产和科学研究中的应用。
课程目标
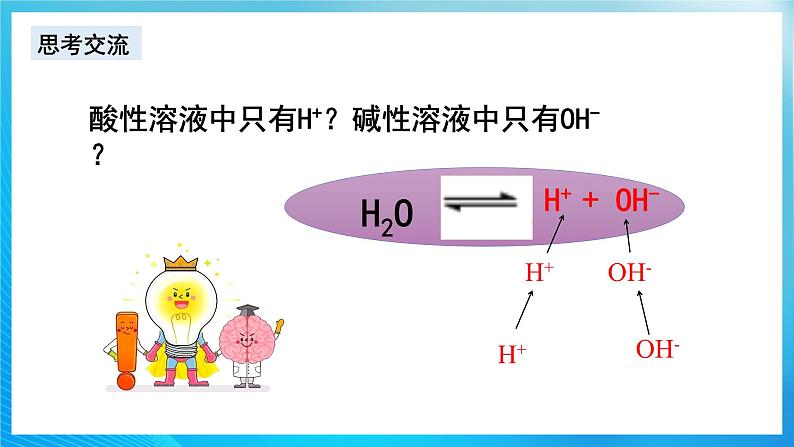
酸性溶液中只有H+?碱性溶液中只有OH-?
H2O
H+ + OH-
H+
H+
OH-
OH-
思考交流
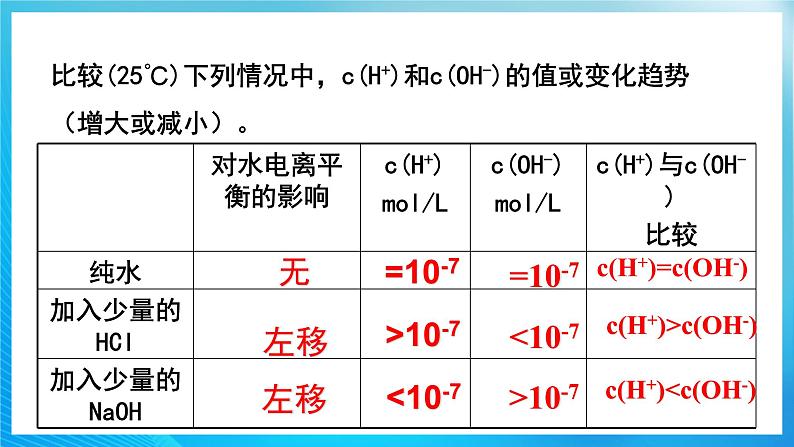
比较(25℃)下列情况中,c(H+)和c(OH-)的值或变化趋势(增大或减小)。
无
=10-7
=10-7
c(H+)=c(OH-)
>10-7
<10-7
c(H+)>c(OH-)
<10-7
>10-7
c(H+)左移
左移
1.溶液的酸碱性与H+、OH-浓度的关系
(1)酸性溶液:c(H+)_____c(OH-)(2)中性溶液:c(H+)_____c(OH-)(3)碱性溶液:c(H+)_____c(OH-)
>
=
<
一、溶液的酸碱性与pH的关系
不能用c(H+)等于多少来判断溶液酸、碱性,只能通过 的相对大小来判断。
c(H+)和c(OH-)
1、动手绘制25℃时溶液酸碱性与pH(0-14) 的关系图。
思考交流
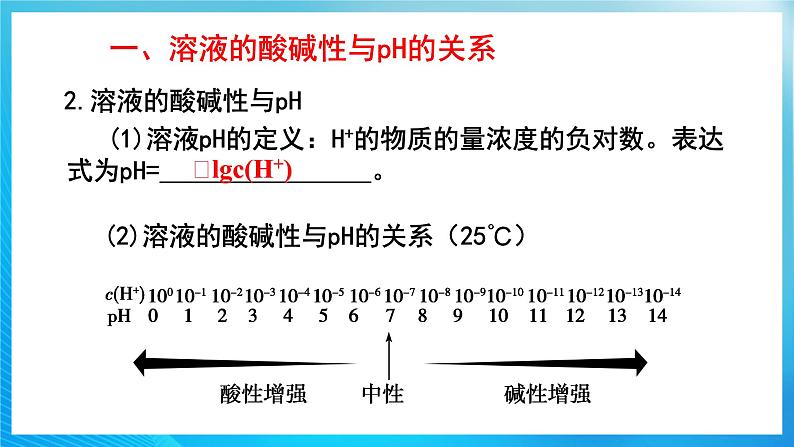
2.溶液的酸碱性与pH
(1)溶液pH的定义:H+的物质的量浓度的负对数。表达式为pH= 。
﹣lgc(H+)
一、溶液的酸碱性与pH的关系
(2)溶液的酸碱性与pH的关系(25℃)
强
弱
0~14
(2)溶液的酸碱性与pH的关系(25℃)
pH越小,溶液的酸性越 ,碱性越 ,pH的适用范围是 。
①pH<7,c(H+)>10-7,溶液呈 。 ②pH=7,c(H+)=10-7,溶液呈 。③pH>7,c(H+)<10-7,溶液呈 。
强
弱
酸性
碱性
中性
0~14
pH=7的溶液一定呈中性吗?
不一定。25 ℃时,pH=7的溶液呈中性,温度高于25 ℃时,由于水的电离程度增大,KW>1.0×10-14,此时pH=7呈碱性。判断溶液酸碱性的唯一标准是溶液中c(H+)和c(OH-)的相对大小,不应看pH的大小,因此只有满足c(H+)=c(OH-)的溶液才一定呈中性。
思考交流
×
×
×
√
活学活用
1.在任何水溶液中,都存在H+与OH-,但不能大量共存。 2.溶液呈酸性或碱性的本质在于c(H+)与c(OH-)的相对大小;而不在于c(H+)或c(OH-)的绝对大小。在一定温度下,c(H+)与c(OH-)此增彼减,但Kw=c(H+)•c(OH-)始终不变。 3.碱溶液中由水电离出的c水(H+)=Kw/c碱(OH-)(忽略水电离出的OH-的浓度);同理,酸溶液中由水电离出的c水(OH-)=Kw/c酸(H+)(忽略水电离出的H+的浓度)。
4.任何情况下,均可根据溶液中c(H+)和c(OH-)的相对大小来判断溶液的酸碱性。但只有在25℃时才能利用c(H+)与1.0×10-7mol/L的相对大小来判断溶液的酸碱性。 5.在分析c(H+)、pH与溶液的酸碱性的关系时,要注意溶液的温度是否为常温。 6.溶液的pH范围通常是0~14,对于c(H+)≤1 mol/L或c(OH-)≤1mol/L的电解质溶液,用pH表示其酸碱度比直接使用c(H+)或c(OH-)要方便。当c(H+)或c(OH-)大于1 mol/L时,则直接用c(H+)或c(OH-)来表示溶液的酸碱度。
常用的pH值的测定方法有哪些? 如何用pH试纸测定溶液的pH值?
问题探究
1.酸碱指示剂法(只能粗略测定溶液的pH范围,不能准确测定出pH的具体值)
二、溶液pH的测定方法
2.pH试纸法(定量粗略测量)
(2)使用方法:使用时把一小片试纸放在 或点滴板上,用洁净干燥的玻璃棒直接蘸取少量待测液点在干燥的pH试纸上,半分钟内,与 对照可确定溶液的pH。
(1)种类:广泛pH试纸的范围为 (最常用)或0~10,用广泛pH试纸测定溶液的pH都为 ;精密pH试纸的pH范围较窄,可以判别0.2或0.3的pH差值。
1~14
整数
表面皿
标准比色卡
1、下列有关pH试纸的使用说法正确的是( ) A、把pH试纸浸入待测液 B、用湿润的玻璃棒蘸取待测液 C、测出石灰水的pH为12.4 D、把显色的pH试纸与标准比色卡对照读数
D
活学活用
某溶液中由水电离产生的c(H+) = 10-12 mol/L ,则该溶液呈酸性还是碱性?
问题探究
1.由水电离的c(H+)或c(OH-)的计算(25℃)
(1)中性溶液 c(H+)=c(OH-)=1.0× 10-7 mol/L。(2)溶质为酸的溶液H+来源于酸的电离和水的电离,而OH-只来源于水的电离。Kw=c(H+)•c(OH-) c(H+)=c酸(H+)+c水(H+)由于酸电离产生的H+抑制了水的电离,因此c水(H+)<1×10-7 mol/L,c水(H+)三、pH的计算
(3)溶质为碱的溶液OH-来源于碱的电离和水的电离,而H+只来源于水的电离。Kw=c(H+)•c(OH-)c(OH-)=c碱(OH-)+c水(OH-)由于碱电离产生的OH-抑制了水的电离,因此 c水(OH-)<1×10-7 mol/L,c水(OH-)2.溶液pH的计算(25℃)
(1)单一溶液pH的计算步骤:①强酸溶液(HnA) 设HnA的浓度为c mol/L,则c(H+)=nc mol/L, pH=﹣lgc(H+)=﹣lg(nc)
②强碱溶液(B(OH)n)设B(OH)n的浓度为c mol/L,则c(OH-)=nc mol/L, pH=﹣lgc(H+)=14+lg(nc)
【例1】取1mL pH=3的硫酸溶液加水稀释到100mL,溶液的pH变为多少? (忽略溶液体积变化)
解:
(一)、强酸的稀释
若将上述溶液加水稀释到原体积的1000倍,则pH=____ 若稀释到原体积的105倍,则溶液的pH_____
2、溶液的稀释
6
约为7
(一)、强酸的稀释
2、溶液的稀释
【结论1】 1、酸抓住c(H+)离子进行计算! 2、强酸 pH=a,加水稀释10n倍, 则 pH=a+n≤7
【例2】:取 pH=11的NaOH溶液与水按1:99的体积比混合后,溶液的pH变为多少?(忽略溶液体积变化)
解:
稀释后c(OH-) =
(二)、强碱的稀释
8
约为7
(二)、强碱的稀释
【结论2】 1、碱先求c(OH-),再由Kw求c(H+). 2、强碱 pH=b,加水稀释10n倍,则 pH=b-n≥7
(三).弱酸、弱碱的稀释
(1).弱酸稀释【例3】:pH=2的盐酸稀释100倍后pH=? pH=2的醋酸稀释100倍后pH=?【结论3】弱酸稀释10n倍pH变化(增大)<n
(2).弱碱稀释【例4】pH=12的NaOH溶液稀释100倍后pH=? pH=12的氨水稀释100倍后pH=?
【结论4】弱碱稀释10n倍pH变化(减小)<n.
酸或碱稀释后溶液pH的计算及图像
1、pH=1的两种酸溶液A、B各1 mL,分别加水稀释到1000mL,其pH值与溶液体积的关系如图,下列说法正确的是( ) A、A、B两种酸溶液的物质的量浓度一定相等 B、稀释后,A酸溶液的酸性比B酸溶液强; C、若a=4,则A是强酸,B是弱酸; D、若1CD
(一)强酸与强酸混合
例1、pH=2的盐酸和pH=4的盐酸溶液等体积混合后,所得溶液的pH= 。pH=2的盐酸和pH=5的硫酸溶液等体积混合后,所得溶液的pH= 。
3、溶液混合的pH计算
关键:强酸与强酸混合,抓住H+进行计算!
酸按氢离子进行计算,当相加、减的两个量相差100倍以上时,小的可忽略
(二)强碱与强碱混合
[OH-]=( 1 × 10—6 +1×10—4) / (1+1) = 5×10-5 mol/L
=10 - lg2
=-lg(10-14/ 5×10-5 )
= 9.7
=-lg(2×10-10 )
关键:强碱与强碱混合,抓住OH- 进行计算!再转化为H+
D
1、pH=13 的Ba(OH)2 溶液与pH=10的NaOH溶液体积比按1∶3混合后的pH值______。 2、pH=13 的Ba(OH)2 溶液与pH=10的NaOH溶液体积比按1∶1混合后的pH值______。
活学活用
实质:酸碱发生中和反应:H++OH-=H2O, 实质上为H+与OH-间的抵消问题;
方法:所发生的酸碱中和反应,需先判 断过量与适量问题,后再进行计算。
4、强酸与强碱混合一般中和
(三)强酸与强碱混合
例4、在25℃时,100ml 0.4mol/L的盐酸与等体积0.6mol/L的NaOH溶液混合后,溶液的pH值等于多少?
例3、在25℃时,100ml 0.6mol/L的盐酸与等体积0.4mol/L的NaOH溶液混合后,溶液的pH值等于多少?
关键:酸过量抓住 H+ 进行计算!
碱过量抓住 OH- 进行计算!
NaOH + HCl = NaCl + H2O
0.06
0.04
3.常温下将pH=4的HCl和pH=10的NaOH溶液,若等体积混合后,溶液的pH为 ;若按11∶9的体积比混合后,溶液的pH为 ;若按9∶11的体积比混合后,溶液的pH为 。
7
5
9
活学活用
(1)把pH=2的HCl溶液V1 和 pH=12的NaOH溶液V2混合后,溶液呈中性。则V1:V2= ______; (2)把pH=2的HCl溶液V1 和 pH=11的NaOH溶液V2混合后,溶液呈中性。则V1:V2= _______; (3)把pH=2的HCl溶液V1 和 pH=13的NaOH溶液V2混合后,溶液呈中性。则V1:V2= ______。
1:1
10:1
1:10
活学活用
工农业生产和科学实验中常常涉及溶液的酸碱性,人们的生活和健康也与溶液的酸碱性有密切关系。因此,测试和调控溶液的pH,对工农业生产、科学研究,以及日常生活和医疗保健等都具有重要意义。
课程结束
第三章 水溶液中的离子反应与平衡
人教版 高中化学 必修一
第二节 水的电离和溶液的ph第2课时 溶液的酸碱性和pH
目录
一 、课标要求
二 、思考交流
三 、活学活用
四 、问题探究
1.认识溶液的酸碱性及pH。2.掌握检验溶液pH的方法。3.了解溶液的pH的计算及溶液稀释时pH的变化规律。4.了解溶液pH的调控在工农业生产和科学研究中的应用。
课程目标
酸性溶液中只有H+?碱性溶液中只有OH-?
H2O
H+ + OH-
H+
H+
OH-
OH-
思考交流
比较(25℃)下列情况中,c(H+)和c(OH-)的值或变化趋势(增大或减小)。
无
=10-7
=10-7
c(H+)=c(OH-)
>10-7
<10-7
c(H+)>c(OH-)
<10-7
>10-7
c(H+)
左移
1.溶液的酸碱性与H+、OH-浓度的关系
(1)酸性溶液:c(H+)_____c(OH-)(2)中性溶液:c(H+)_____c(OH-)(3)碱性溶液:c(H+)_____c(OH-)
>
=
<
一、溶液的酸碱性与pH的关系
不能用c(H+)等于多少来判断溶液酸、碱性,只能通过 的相对大小来判断。
c(H+)和c(OH-)
1、动手绘制25℃时溶液酸碱性与pH(0-14) 的关系图。
思考交流
2.溶液的酸碱性与pH
(1)溶液pH的定义:H+的物质的量浓度的负对数。表达式为pH= 。
﹣lgc(H+)
一、溶液的酸碱性与pH的关系
(2)溶液的酸碱性与pH的关系(25℃)
强
弱
0~14
(2)溶液的酸碱性与pH的关系(25℃)
pH越小,溶液的酸性越 ,碱性越 ,pH的适用范围是 。
①pH<7,c(H+)>10-7,溶液呈 。 ②pH=7,c(H+)=10-7,溶液呈 。③pH>7,c(H+)<10-7,溶液呈 。
强
弱
酸性
碱性
中性
0~14
pH=7的溶液一定呈中性吗?
不一定。25 ℃时,pH=7的溶液呈中性,温度高于25 ℃时,由于水的电离程度增大,KW>1.0×10-14,此时pH=7呈碱性。判断溶液酸碱性的唯一标准是溶液中c(H+)和c(OH-)的相对大小,不应看pH的大小,因此只有满足c(H+)=c(OH-)的溶液才一定呈中性。
思考交流
×
×
×
√
活学活用
1.在任何水溶液中,都存在H+与OH-,但不能大量共存。 2.溶液呈酸性或碱性的本质在于c(H+)与c(OH-)的相对大小;而不在于c(H+)或c(OH-)的绝对大小。在一定温度下,c(H+)与c(OH-)此增彼减,但Kw=c(H+)•c(OH-)始终不变。 3.碱溶液中由水电离出的c水(H+)=Kw/c碱(OH-)(忽略水电离出的OH-的浓度);同理,酸溶液中由水电离出的c水(OH-)=Kw/c酸(H+)(忽略水电离出的H+的浓度)。
4.任何情况下,均可根据溶液中c(H+)和c(OH-)的相对大小来判断溶液的酸碱性。但只有在25℃时才能利用c(H+)与1.0×10-7mol/L的相对大小来判断溶液的酸碱性。 5.在分析c(H+)、pH与溶液的酸碱性的关系时,要注意溶液的温度是否为常温。 6.溶液的pH范围通常是0~14,对于c(H+)≤1 mol/L或c(OH-)≤1mol/L的电解质溶液,用pH表示其酸碱度比直接使用c(H+)或c(OH-)要方便。当c(H+)或c(OH-)大于1 mol/L时,则直接用c(H+)或c(OH-)来表示溶液的酸碱度。
常用的pH值的测定方法有哪些? 如何用pH试纸测定溶液的pH值?
问题探究
1.酸碱指示剂法(只能粗略测定溶液的pH范围,不能准确测定出pH的具体值)
二、溶液pH的测定方法
2.pH试纸法(定量粗略测量)
(2)使用方法:使用时把一小片试纸放在 或点滴板上,用洁净干燥的玻璃棒直接蘸取少量待测液点在干燥的pH试纸上,半分钟内,与 对照可确定溶液的pH。
(1)种类:广泛pH试纸的范围为 (最常用)或0~10,用广泛pH试纸测定溶液的pH都为 ;精密pH试纸的pH范围较窄,可以判别0.2或0.3的pH差值。
1~14
整数
表面皿
标准比色卡
1、下列有关pH试纸的使用说法正确的是( ) A、把pH试纸浸入待测液 B、用湿润的玻璃棒蘸取待测液 C、测出石灰水的pH为12.4 D、把显色的pH试纸与标准比色卡对照读数
D
活学活用
某溶液中由水电离产生的c(H+) = 10-12 mol/L ,则该溶液呈酸性还是碱性?
问题探究
1.由水电离的c(H+)或c(OH-)的计算(25℃)
(1)中性溶液 c(H+)=c(OH-)=1.0× 10-7 mol/L。(2)溶质为酸的溶液H+来源于酸的电离和水的电离,而OH-只来源于水的电离。Kw=c(H+)•c(OH-) c(H+)=c酸(H+)+c水(H+)由于酸电离产生的H+抑制了水的电离,因此c水(H+)<1×10-7 mol/L,c水(H+)
(3)溶质为碱的溶液OH-来源于碱的电离和水的电离,而H+只来源于水的电离。Kw=c(H+)•c(OH-)c(OH-)=c碱(OH-)+c水(OH-)由于碱电离产生的OH-抑制了水的电离,因此 c水(OH-)<1×10-7 mol/L,c水(OH-)
(1)单一溶液pH的计算步骤:①强酸溶液(HnA) 设HnA的浓度为c mol/L,则c(H+)=nc mol/L, pH=﹣lgc(H+)=﹣lg(nc)
②强碱溶液(B(OH)n)设B(OH)n的浓度为c mol/L,则c(OH-)=nc mol/L, pH=﹣lgc(H+)=14+lg(nc)
【例1】取1mL pH=3的硫酸溶液加水稀释到100mL,溶液的pH变为多少? (忽略溶液体积变化)
解:
(一)、强酸的稀释
若将上述溶液加水稀释到原体积的1000倍,则pH=____ 若稀释到原体积的105倍,则溶液的pH_____
2、溶液的稀释
6
约为7
(一)、强酸的稀释
2、溶液的稀释
【结论1】 1、酸抓住c(H+)离子进行计算! 2、强酸 pH=a,加水稀释10n倍, 则 pH=a+n≤7
【例2】:取 pH=11的NaOH溶液与水按1:99的体积比混合后,溶液的pH变为多少?(忽略溶液体积变化)
解:
稀释后c(OH-) =
(二)、强碱的稀释
8
约为7
(二)、强碱的稀释
【结论2】 1、碱先求c(OH-),再由Kw求c(H+). 2、强碱 pH=b,加水稀释10n倍,则 pH=b-n≥7
(三).弱酸、弱碱的稀释
(1).弱酸稀释【例3】:pH=2的盐酸稀释100倍后pH=? pH=2的醋酸稀释100倍后pH=?【结论3】弱酸稀释10n倍pH变化(增大)<n
(2).弱碱稀释【例4】pH=12的NaOH溶液稀释100倍后pH=? pH=12的氨水稀释100倍后pH=?
【结论4】弱碱稀释10n倍pH变化(减小)<n.
酸或碱稀释后溶液pH的计算及图像
1、pH=1的两种酸溶液A、B各1 mL,分别加水稀释到1000mL,其pH值与溶液体积的关系如图,下列说法正确的是( ) A、A、B两种酸溶液的物质的量浓度一定相等 B、稀释后,A酸溶液的酸性比B酸溶液强; C、若a=4,则A是强酸,B是弱酸; D、若1
(一)强酸与强酸混合
例1、pH=2的盐酸和pH=4的盐酸溶液等体积混合后,所得溶液的pH= 。pH=2的盐酸和pH=5的硫酸溶液等体积混合后,所得溶液的pH= 。
3、溶液混合的pH计算
关键:强酸与强酸混合,抓住H+进行计算!
酸按氢离子进行计算,当相加、减的两个量相差100倍以上时,小的可忽略
(二)强碱与强碱混合
[OH-]=( 1 × 10—6 +1×10—4) / (1+1) = 5×10-5 mol/L
=10 - lg2
=-lg(10-14/ 5×10-5 )
= 9.7
=-lg(2×10-10 )
关键:强碱与强碱混合,抓住OH- 进行计算!再转化为H+
D
1、pH=13 的Ba(OH)2 溶液与pH=10的NaOH溶液体积比按1∶3混合后的pH值______。 2、pH=13 的Ba(OH)2 溶液与pH=10的NaOH溶液体积比按1∶1混合后的pH值______。
活学活用
实质:酸碱发生中和反应:H++OH-=H2O, 实质上为H+与OH-间的抵消问题;
方法:所发生的酸碱中和反应,需先判 断过量与适量问题,后再进行计算。
4、强酸与强碱混合一般中和
(三)强酸与强碱混合
例4、在25℃时,100ml 0.4mol/L的盐酸与等体积0.6mol/L的NaOH溶液混合后,溶液的pH值等于多少?
例3、在25℃时,100ml 0.6mol/L的盐酸与等体积0.4mol/L的NaOH溶液混合后,溶液的pH值等于多少?
关键:酸过量抓住 H+ 进行计算!
碱过量抓住 OH- 进行计算!
NaOH + HCl = NaCl + H2O
0.06
0.04
3.常温下将pH=4的HCl和pH=10的NaOH溶液,若等体积混合后,溶液的pH为 ;若按11∶9的体积比混合后,溶液的pH为 ;若按9∶11的体积比混合后,溶液的pH为 。
7
5
9
活学活用
(1)把pH=2的HCl溶液V1 和 pH=12的NaOH溶液V2混合后,溶液呈中性。则V1:V2= ______; (2)把pH=2的HCl溶液V1 和 pH=11的NaOH溶液V2混合后,溶液呈中性。则V1:V2= _______; (3)把pH=2的HCl溶液V1 和 pH=13的NaOH溶液V2混合后,溶液呈中性。则V1:V2= ______。
1:1
10:1
1:10
活学活用
工农业生产和科学实验中常常涉及溶液的酸碱性,人们的生活和健康也与溶液的酸碱性有密切关系。因此,测试和调控溶液的pH,对工农业生产、科学研究,以及日常生活和医疗保健等都具有重要意义。
课程结束
相关资料
更多









