吉林高考化学三年(2021-2023)模拟题汇编-19原子结构与性质
展开吉林高考化学三年(2021-2023)模拟题汇编-19原子结构与性质
一、单选题
1.(2023·吉林白山·统考模拟预测)胍( )是一元强碱,其盐酸盐( )是病毒核酸保存液的主要成分。下列说法错误的是
A.胍中所含元素的第一电离能:N>H>C
B.胍中键角:∠HNH >∠NCN
C.胍的熔点低于胍盐
D.胍及其盐酸盐均易溶于水
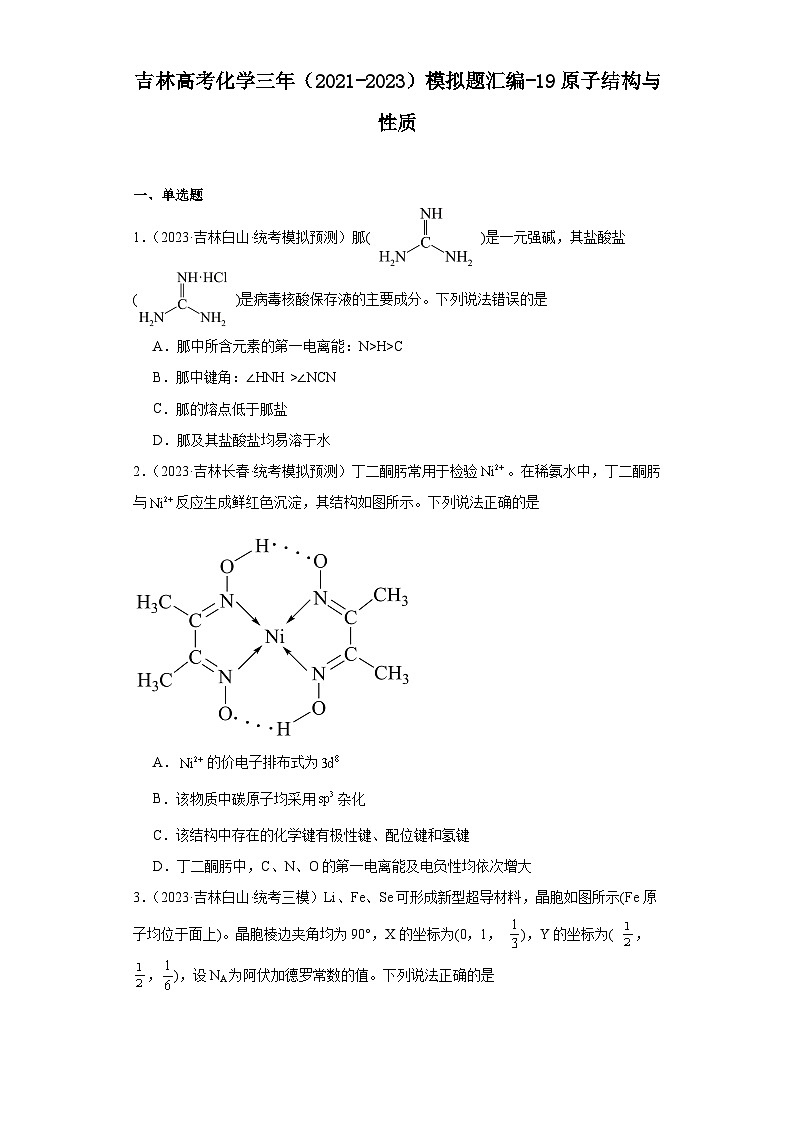
2.(2023·吉林长春·统考模拟预测)丁二酮肟常用于检验。在稀氨水中,丁二酮肟与反应生成鲜红色沉淀,其结构如图所示。下列说法正确的是
A.的价电子排布式为
B.该物质中碳原子均采用杂化
C.该结构中存在的化学键有极性键、配位键和氢键
D.丁二酮肟中,C、N、O的第一电离能及电负性均依次增大
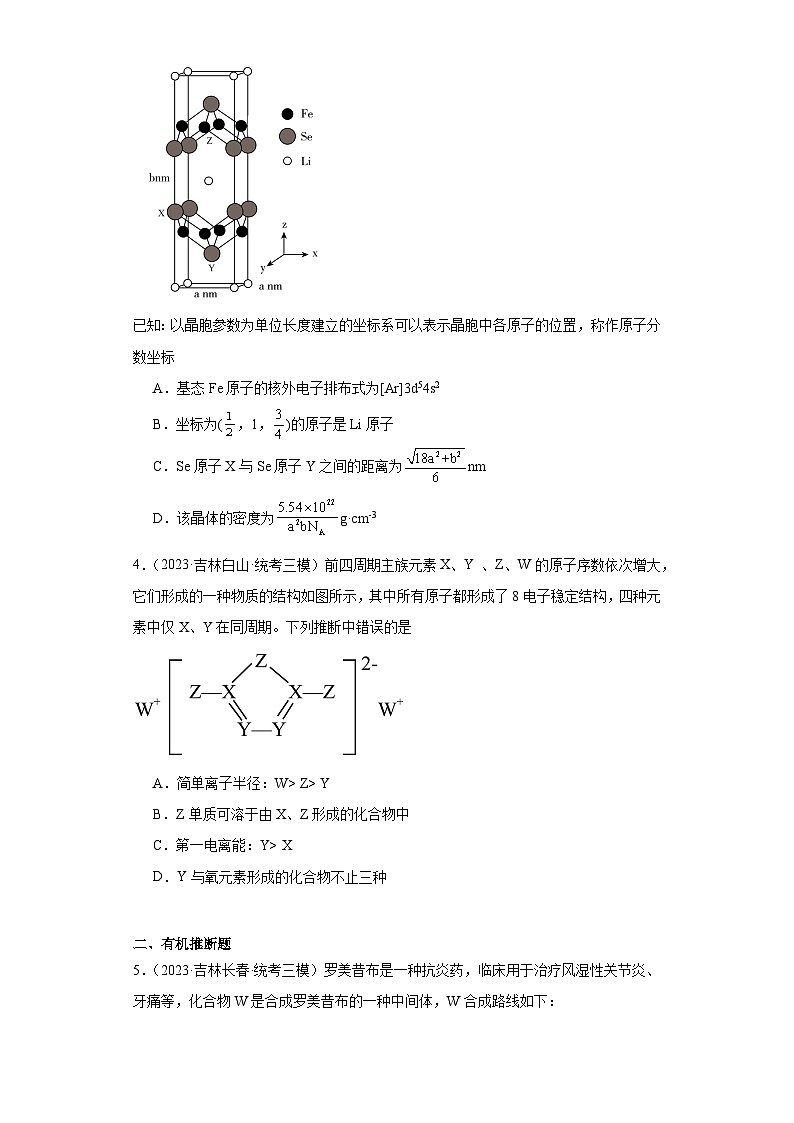
3.(2023·吉林白山·统考三模)Li、Fe、Se可形成新型超导材料,晶胞如图所示(Fe原子均位于面上)。晶胞棱边夹角均为90°,X的坐标为(0,1, ),Y的坐标为( ,,),设NA为阿伏加德罗常数的值。下列说法正确的是
已知:以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标
A.基态Fe原子的核外电子排布式为[Ar]3d54s2
B.坐标为(,1,)的原子是Li原子
C.Se原子X与Se原子Y之间的距离为nm
D.该晶体的密度为g·cm-3
4.(2023·吉林白山·统考三模)前四周期主族元素X、Y 、Z、W的原子序数依次增大,它们形成的一种物质的结构如图所示,其中所有原子都形成了8电子稳定结构,四种元素中仅X、Y在同周期。下列推断中错误的是
A.简单离子半径:W> Z> Y
B.Z单质可溶于由X、Z形成的化合物中
C.第一电离能:Y> X
D.Y与氧元素形成的化合物不止三种
二、有机推断题
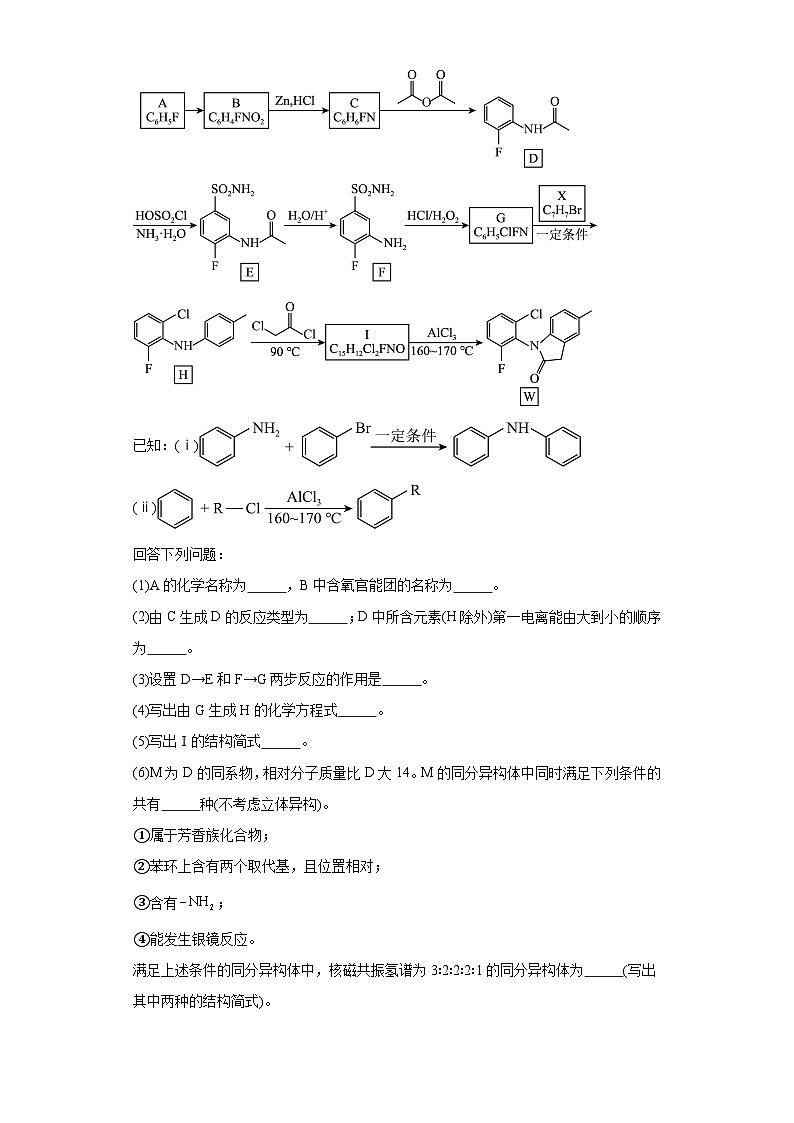
5.(2023·吉林长春·统考三模)罗美昔布是一种抗炎药,临床用于治疗风湿性关节炎、牙痛等,化合物W是合成罗美昔布的一种中间体,W合成路线如下:
已知:(ⅰ)
(ⅱ)
回答下列问题:
(1)A的化学名称为 ,B中含氧官能团的名称为 。
(2)由C生成D的反应类型为 ;D中所含元素(H除外)第一电离能由大到小的顺序为 。
(3)设置D→E和F→G两步反应的作用是 。
(4)写出由G生成H的化学方程式 。
(5)写出Ⅰ的结构简式 。
(6)M为D的同系物,相对分子质量比D大14。M的同分异构体中同时满足下列条件的共有 种(不考虑立体异构)。
①属于芳香族化合物;
②苯环上含有两个取代基,且位置相对;
③含有;
④能发生银镜反应。
满足上述条件的同分异构体中,核磁共振氢谱为3∶2∶2∶2∶1的同分异构体为 (写出其中两种的结构简式)。
三、结构与性质
6.(2022·吉林·统考模拟预测)镍钴锰酸锂是锂电池的关键三元正极材料,化学式为LiNixCoyMn1-x-yO2。其中的锰(Mn)、钴(Co)、镍(Ni)等过渡金属元素化合物的应用研究是前沿科学之一、回答下列问题:
(1)基态Ni原子的价电子排布式为 。金属锰可导电、导热,有金属光泽和延展性,这些性质都可以用“ 理论”解释。
(2)[Co(DMSO)6](ClO4)2是一种紫色晶体,其中DMSO为二甲基亚砜,化学式为SO(CH3)2。DMSO中硫原子的杂化轨道类型为 ,ClO的空间构型是 , SO(CH3)2中键角∠C—S—O CH3COCH3中键角∠C—C—O(填“>”、“<”或“=”),元素S、Cl、O的电负性由小到大的顺序为 。
(3)已知:r(Fe2+)为61pm、r(Co2+)为65pm。在隔绝空气条件下分别加热FeCO3和CoCO3,实验测得FeCO3的分解温度低于CoCO3,原因是 。
(4)La、Ni合金是较为理想的储氢材料,其晶胞结构如图所示:
①该储氢材料的化学式为 。
②已知晶胞参数边长为anm,高为bnm,设阿伏加德罗常数的值为NA,一个晶胞内可以储存18个氢原子,储氢后的晶胞密度为 g·cm-3。
7.(2022·吉林长春·校联考模拟预测)中国冶金报指出,钢铁行业作为国民经济重要的基础产业,碳排放量在国内占比13-15%,因此钢铁行业应承担起碳减排的主体责任,努力成为碳减排的先行者。已知,铁有α、γ、δ三种晶体结构,并且在一定条件下可以相互转化(如图),请回答相关的问题:
(1)铁元素在元素周期表中的位置 ,Fe2+的外围电子排布式 ,铁的三种晶体之间的转化属于 变化(填“物理”或“化学”),理由是: 。
(2)铁的α、γ、δ三种晶体结构中,Fe原子的配位数之比为: 。
(3)设α-Fe晶胞边长为a cm,δ-Fe晶胞边长为b cm, 计算确定:两种晶体的密度比为: 。(用a、b的代数式表示)
(4)Fe3C是工业炼铁生产过程中产生的一种铁的合金,在Fe3C晶体中,每个碳原子被6个位于顶角位置的铁原子所包围,成八面体结构,即碳原子配位数为6,那么,铁原子配位数为 。
(5)事实上,Fe3C是C与铁的晶体在高温下形成的间隙化合物(即碳原子填入铁晶体中的某些空隙),根据相关信息,你认为形成碳化铁的铁的三种晶体结构中,最有可能的是: ,(选填“α-Fe”、“γ-Fe”或“δ-Fe”)
(6)摩尔盐[ (NH4)2 SO4·FeSO4·6H2O]是一种复盐, 它易溶于水,不溶于乙醇,性质比一般亚铁盐稳定,不易被氧化,试分析该晶体中亚铁离子可稳定存在的原因 。
8.(2022·吉林延边·统考一模)铜是人类广泛使用的第一种金属,含铜物质在生产生活中有着广泛应用。回答下列问题:
(1)铜锰氧化物(CuMn2O4能在常温下催化氧化一氧化碳和甲醛(HCHO)。
①基态Cu原子的M层电子排布式为 。
②CO和N2互为等电子体。标准状况下V L CO分子中π键数目为 。
(2)钙铜合金可用作电解法制备金属钙的阴极电极材料。钙在元素周期表中位于 (填“s”、“p”、“d”或“ds")区。一种钙铜合金的结构如图(Ⅲ可看作是由Ⅰ、Ⅱ两种原子层交替堆积排列而形成的)。该钙铜合金中铜原子与钙原子的个数比为 。
(3)已知硫酸铜稀溶液呈蓝色,判断硫酸铜稀溶液中不存在的作用力有 (填英文字母)。
A.配位键 B.金属键 C.离子键 D.氢键 E.范德华力
(4)已知Cu2O的熔点为1235℃,Cu2S的熔点为1130℃,Cu2O熔点较高的原因是 。
(5)Cu2+可形成[Cu(X)2]2+,其中X代表CH3-HN-CH2-CH2-NH2。则1 mol [Cu(X)2]2+微粒中VSEPR模型为四面体的非金属原子共有 mol。
(6)一种含有Fe、Cu、S三种元素的矿物的晶胞(如图所示),属于四方晶系(晶胞底面为正方形),则该化合物的化学式为 ;若晶胞的底面边长为a nm,晶体的密度为p g·cm-3,阿伏加德罗常数为NA,则该晶胞的高为 nm。
9.(2022·吉林白山·统考一模)我国科学家利用生物质合成共聚酯的单体,合成时涉及多种元素,回答下列问题:
(1)基态Cu+的电子排布式为 。
(2)Cu、Zn、Al的第一电离能由大到小的顺序为 (填元素符号,下同)。
(3)H2C=CHCOOCH3中所含元素的电负性由小到大的顺序为 ,该有机物中,碳原子的杂化类型是 。
(4)区别晶体SiO2和非晶体SiO2的方法是 。
(5)有机物C和D的相对分子质量相差较小,但是D的沸点明显高于C的,其主要原因是 。
(6)我国科学家开发钙钯络合氢化物(CaPdH2)来实现乙炔高选择性合成乙烯。CaPdH2由Ca2+和[PdH2]2-(富电子)构成。CaPdH2中存在的化学键有 (填标号)。
A.离子键 B.配位键 C.非极性键 D.金属键
(7)白铜是我国使用最早的合金之一,白铜晶胞结构如图所示。已知晶体密度为dg·cm-3,设NA为阿伏加德罗常数的值。Cu和Ni之间的最短距离为 (只列计算式)nm。
10.(2022·吉林四平·统考模拟预测)X、Y、Z、M、N、Q、P为元素周期表前四周期的7种元素。其中,X原子核外的M层中只有两对成对电子,Y原子核外的L层电子数是K层的两倍,Z是地壳内含量最高的元素,M的内层电子数是最外层电子数的9倍,N的原子序数比M小1,Q在元素周期表的各元素中电负性最大。P元素的第三电子层处于全充满状态,第四电子层只有一个电子。请回答下列问题:
(1)基态X的外围电子电子排布图为 ,P元素属于 区元素。
(2)XZ2分子的空间构型是 ,YZ2分子中Y的杂化轨道类型为 ,相同条件下两者在水中的溶解度较大的是 (写分子式),理由是 。
(3)含有元素N的盐的焰色反应为 色,许多金属盐都可以发生焰色反应,其原因是 。
(4)元素M与元素Q形成晶体中,M离子与Q离子的配位数之比为 。
(5)P单质形成的晶体中,P原子采取的堆积方式为 ,P原子采取这种堆积方式的空间利用率为 (用含π表达式表示)。
11.(2021·吉林长春·统考三模)氮元素是重要的非金属元素,可形成多种铵盐、氮化物、叠氮化物及配合物等。
(1)基态氮原子价电子的轨道表达式(价电子排布图)为 ;第二周期元素原子中第一电离能大于氮原子的有 种,NH4NO3中阴离子的空间构型为 。
(2)常温下某含N化合物与甘氨酸形成的离子化合物为液态而非固态,原因是 。
(3)叠氮化钠(NaN3)用于汽车的安全气囊,结构如图甲。中的存在两个大π键可用符号表示,一个中键合电子(形成化学键的电子)总数为 。叠氮酸(HN3)结构如图乙,分子中②号N原子的杂化方式为 。
(4)含有多个配位原子的配体与同一中心离子(或原子)通过螯合配位成环而形成的配合物为螯合物。一种Fe3+配合物的结构如图丙所示,1mol该螯合物中通过螯合作用形成的配位键有 mol。
(5)某含氮的化合物晶胞结构如图丁所示,Br-作简单立方堆积,两个立方体共用的面中心存在一个Hg,NH3位于立方体的体心,相邻的Br的距离均为apm,阿伏加德罗常数的值为NA。该物质的化学式为 ,该晶体的密度为 g·cm-3。
12.(2021·吉林长春·统考二模)近年来,我国工程建设自主创新能力实现大跨越,尤其在新材料研究方面有重大突破,回答下列问题:
(1)钛是一种新兴的结构材料,比钢轻、比铝硬。基态钛原子的价电子排布式为 , 与钛同周期的元素中,基态原子的未成对电子数与钛相间的有 种;
(2)铁能与三氮唑(结构见图甲)形成多种配合物。
①l mol三氮唑中所含σ键的数目为 mol; 碳原子杂化方式是 ;
②三氮唑的沸点为260°C,与之结构相似且相对分子质量接近的环戊二烯(结构见图乙)的沸点为42.5℃,前者沸点较高的原因是 。
(3)碳化钨是耐高温耐磨材料。图丙为碳化钨晶体的部分结构,碳原子嵌入金属的晶格间隙,并不破坏原有金属的晶格,形成填隙化合物。
①在该结构中,每个钨原子周围距离其最近的碳原子有 个:
②假设该部分晶体的体积为Vcm3,碳化钨的摩尔质量为M g•mol-1,密度为d g•cm-3,则阿伏加德罗常数的值NA用上述数据表示为 。
③金属镁的晶体结构与碳化钨相似,金属镁的晶胞可用图丁表示,已知镁原子的半径为r pm,晶胞高为h pm,求晶胞中镁原子的空间利用率 (用化简后含字时π、r和h的代数式表示)
13.(2021·吉林·统考二模)据《自然·通讯》(Nature Communications)报道,我国科学家发现了硒化铜纳米催化剂在二氧化碳电化学还原法生产甲醇过程中催化效率高。我国国产洲际战略导弹其制作材料中包含了等多种元素。Cu、Se、Fe、Cr、Ni、C等元素化合物在生产、生活中应用广泛。回答下列问题:
(1)基态铜原子的价电子排布式为 。
(2)电还原法制备甲醇的原理为2CO2+4H2O2CH3OH+3O2。
①写出该反应中由极性键构成的非极性分子的结构式 ;
②写出一个与CO2互为等电子体的离子 。
(3)实验室常用KSCN溶液检验Fe3+。其中N、O、S的第一电离能由大到小的顺序为 (用元素符号表示);
(4)苯分子中6个C原子,每个C原子有一个2p轨道参与形成大π键,可记为(右下角“6”表示6个原子,右上角“6”表示6个共享电子)。已知某化合物的结构简式为,不能使溴的四氯化碳溶液褪色,由此推知,该分子中存在大π键,该大π键可表示为 ,Se的杂化方式为 。
(5)碳的一种同素异形体的晶体可采取非最密堆积,然后在空隙中插入金属离子获得超导体。如图为一种超导体的面心立方晶胞,C60分子占据顶点和面心处,K+占据的是C60分子围成的 空隙和 空隙(填几何空间构型);若C60分子的坐标参数分别为A(0,0, 0),B(,0, ),C(1,1,1)等,则距离A位置最近的阳离子的原子坐标参数为 。
(6)Ni可以形成多种氧化物,其中一种NiaO晶体晶胞结构为NaCl型,由于晶体缺陷,a的值为0. 88,且晶体中的Ni分别为Ni2+、Ni3+,则晶体中Ni2+与Ni3+的最简整数比为 ,晶胞参数为428 pm,则晶体密度为 g/cm3(NA表示阿伏加德罗常数的值,列出表达式)。
14.(2021·吉林四平·校联考模拟预测)磷是生物体中不可缺少的元素之一它能形成多种化合物。
(1)磷元素位于周期表的 区,基态磷原子价层电子排布图 。
(2)第三周期中第一电离能位于铝元素和磷元素之间的元素有 种。
(3)白磷(P4)分子是正四面体结构,磷原子杂化方式为 ,3.1g白磷中σ键的数目为 。P4易溶于二硫化碳,难溶于水,原因是 。
(4)磷酸与Fe3+可形成H3[FePO4)2],基态Fe3+的核外电子排布式为 ,Fe、P、O电负性由大到小的顺序是 。
(5)磷化硼是一种超硬耐磨涂层材料,下图为其晶胞结构,阿伏伽德罗常数为NA,磷化硼晶体的密度为ρg/cm3,B与P最近距离为 cm(列出计算式即可),估测该晶体的熔点 (填“高于”或“低于”)金刚石。
15.(2021·吉林长春·统考一模)研究发现,过量摄入铝元素能损害人的脑细胞。适当地补充碘元素可预防甲状腺肿大,但摄入过多也会导致甲状腺病变。试回答下列问题:
(1)Fe也是人体需要补充的元素之一,写出Fe3+的核外电子排布式: 。
(2)与Al同一周期的Na、Mg元素也是人体所需元素,Na、Mg、Al基态原子第一电离能由大到小的顺序是 。
(3)氯化铝的熔点是194℃,氧化铝的熔点是2054℃,但是工业上获取铝单质不是电解熔融氯化铝,而是电解熔融氧化铝,原因是 ;为降低熔点和增强导电性,电解熔融氧化铝时通常要加入Na3AlF6(冰晶石),Na3AlF6中含有的化学键类型有 (填字母)。
A.离子键 B.金属键 C.氢键 D.配位键
(4)F与I是同一主族的元素,BF3与H3O+都是由四个原子构成的粒子,两种粒子的中心原子B和O的杂化方式分别为 、 ,BF3的空间构型是 ,H3O+的空间构型是 。
(5)I2晶体的晶胞结构如图所示,该晶胞中含有I原子的数目为 ,已知该晶胞的晶胞参数为apm、bpm和cpm,则I2晶体的密度是 g/cm3。(列出最简表达式,用NA表示阿伏加德罗常数的值)
参考答案:
1.B
【详解】A.同一周期元素,其第一电离能随着原子序数增大而呈增大趋势,但第IIA族、第VA族第一电离能大于其相邻元素,但H的s轨道为半稳定结构,第一电离能比碳略大,则这几种元素第一电离能大小顺序是N>H>C,故A正确;
B.由于-NH2中存在孤电子对,而 中没有孤电子对,且孤电子对对成键电子对的排斥力大于成键电子对对成键电子对的排斥力,则胍中键角:∠HNH >∠NCN,故B错误;
C.胍为分子晶体,胍的盐酸盐为离子晶体,一般而言,离子晶体的熔沸点高于分子晶体,则胍的熔点低于胍盐,故C正确;
D.氨基为亲水基团,胍及其盐酸盐均易溶于水,故D正确;
故选:B。
2.A
【详解】A.镍为28号元素,镍原子失去2个电子形成镍离子,的价电子排布式为3d8,A正确;
B.由结构式可知,该化合物中双键的碳采取杂化,B错误;
C.由图可知,该结构中存在有碳氢、碳氮、氮氧极性键,氮镍配位键,同时分子中还存在氢键,但是氢键不是化学键,C错误;
D.同一周期随着原子序数变大,第一电离能变大,N的2p轨道为半充满稳定状态,第一电离能大于同周期相邻元素,故第一电离能为N>O>C,D错误;
故选A。
3.C
【详解】A.Fe为26号元素,基态Fe原子的核外电子排布式为[Ar]3d64s2,故A错误;
B.由晶胞结构可知坐标为(,1,)的原子是Z原子,即Fe原子,故B错误;
C.Se原子X与Se原子Y,沿x轴方向的距离为,沿y轴方向的距离为,沿z轴方向的距离为,两点间的距离为 nm,故C正确;
D.Li原子有8位于顶点,1个位于体心,个数为:,Fe有8个位于面上,个数为,Se原子8个位于棱上,2个位于体内,个数为:,晶胞的质量为:g,晶胞体积为:×10-21 cm3,密度为: g·cm-3,故D错误;
故选:C。
4.A
【分析】由阴离子的结构可知,X原子形成4个共价键、Y原子形成3个共价键、Z原子形成2个共价键,前四周期主族元素X、Y、Z、W的原子序数依次增大,化合物中所有原子都形成了8电子稳定结构,其中仅X、Y在同周期,则X为C元素、Y为N元素、Z为S元素、W为K元素。
【详解】A.电子层结构相同的离子,核电荷数越大,离子半径越小,则硫离子的离子半径大于钾离子,故A错误;
B.硫单质不溶于水、微溶于酒精,易溶于二硫化碳,故B正确;
C.N、C为同周期元素,同周期从左到右第一电离能呈增大趋势,则第一电离能:N> C,故C正确;
D.氮元素与氧元素形成的氧化物有N2O、NO、N2O4、NO2、N2O3、N2O5,不止三种,故D正确;
故选:A。
5.(1) 氟苯或1-氟苯 硝基
(2) 取代反应
(3)占位,防止副产物生成,提高目标产物的产率
(4) +HBr
(5)
(6) 16
【分析】根据A的分子式,得出A的结构为:,A发生硝化反应生成B,B的结构为: ,B在Zn、HCl条件下发生还原反应生成C,C的结构为:,C和发生取代反应生成D,D发生取代反应生成E,E在酸性条件下水解生成F,根据H的结构和G的分子式,推出G的结构为: ,X的结构为:,G和X发生已知反应ⅰ,生成H,根据W的结构简式和已知反应ⅰⅰ,I的结构为: 。
【详解】(1)A的结构为: ,化学名称为:氟苯或1-氟苯;B的结构为: ,含氧官能团为硝基;
(2)C的结构为: ,C和发生取代反应生成D;D中含有的元素为:C、H、O、N、F,除了H以外,其余几种元素位于同周期,第一电离能逐渐增大,但是N原子最高能层为,为半充满较稳定结构,第一电离能比O大,所以第一电离能的大小顺序为:;
(3)设置D→E和F→G两步反应的作用是:占位,防止副产物生成,提高目标产物的产率;
(4)根据H的结构和G的分子式,推出G的结构为:,X的结构为: ,G和X发生已知反应ⅰ,生成H的方程式为:+HBr ;
(5)根据W的结构简式和已知反应ⅰⅰ,I的结构为:;
(6)M为D的同系物,相对分子质量比D大14,多了一个,①属于芳香族化合物,含有苯环;②苯环上含有两个取代基,且位置相对;③含有;④能发生银镜反应,含有 ,M的同分异构体中同时满足下列条件的有:,F原子与,,替换位置,可得4种不同的结构;,F原子与,,替换位置,可得3种不同的结构;,F原子与,,替换位置,可得3种不同的结构;,将,位置互换,可得2种;,将F原子与互换位置,可得2种;,将F原子与互换位置,可得2种,共有16种;核磁共振氢谱为3∶2∶2∶2∶1的同分异构体为: 。
6.(1) 3d84s2 电子气
(2) sp3 正四面体 < S<Cl<O
(3)Fe2+更容易结合碳酸根离子中的氧离子或Fe2+的半径小于Co2+,FeO晶格能大于CoO,则FeCO3分解温度低于CoCO3
(4) LaNi5 ×1021
【详解】(1)镍元素的原子序数为28,基态原子的价电子排布式为3d84d2;金属晶体中原子之间存在金属键,描述金属键本质的最简单理论是电子气理论,电子气理论可解释金属晶体的熔沸点的高低,也可以解释金属的导电、导热性能,有金属光泽和延展性,则金属锰可导电、导热,有金属光泽和延展性可用电子气理论解释;
(2)二甲基亚砜中硫原子的价层电子对数为4,孤对电子对数为1,则硫原子的杂化方式为sp3杂化;高氯酸根离子中氯原子的价层电子对数为4,孤对电子对数为0,则离子的空间构型为正四面体形;丙酮中羰基碳原子的杂化方式为sp2杂化,无孤电子对,孤电子对对成键电子对的排斥作用大于成键电子对之间的排斥作用,则二甲基亚砜中键角∠C—S—O小于丙酮中键角∠C—C—O;元素的非金属性越大,电负性越大,元素非金属性的强弱顺序为O>Cl>S,则电负性的大小顺序为S<Cl<O。
(3)由题意可知,Fe2+的半径小于Co2+,FeO晶格能大于CoO,Fe2+更容易结合氧离子,FeCO3受热分解需要外界能量更少,FeCO3比CoCO3易分解,则FeCO3分解温度低于CoCO3。
(4)①根据均摊原则,晶胞中La原子数是、Ni原子数是,该储氢材料的化学式为LaNi5;②晶胞参数边长为anm,高为bnm,则晶胞体积为,设阿伏加德罗常数的值为NA,一个晶胞内可以储存18个氢原子,储氢后的晶胞密度为g·cm-3。
7.(1) 第四周期第VIII族 3d6 物理 没有新物质生成或没有化学键变化或金属键不变
(2)4:6:3
(3)2b3:a3
(4)2
(5)γ-Fe
(6)摩尔盐中的N、O、H可形成空间网络化氢键,将亚铁离子包围起来,避免其与氧化性物质接触,所以比较稳定
【详解】(1)已知铁是26号元素,则26-18=8,即铁元素在元素周期表中的位置为第4周期第八纵列即第四周期第VIII族,Fe2+的外围电子排布式3d6,铁的三种晶体之间的转化过程中没有新物质的生成,仅仅是原子的排列方式发生改变,故属于物理变化,故答案为:第四周期第VIII族;3d6;物理;没有新物质生成或没有化学键变化或金属键不变;
(2)金属晶体中离某一原子最近的等距离的原子为其配位数,由题干图示晶胞可知铁的α、γ、δ三种晶体结构中,Fe原子的配位数分别为:8,12,6,故配位数之比为:8:12:6=4:6:3,故答案为:4:6:3;
(3)由题干晶胞示意图可知,一个α-Fe晶胞含有铁原子个数为:,设α-Fe晶胞边长为a cm,则其晶胞密度为:,一个δ-Fe晶胞含有铁原子个数为:,δ-Fe晶胞边长为b cm,则该晶胞的密度为:,则两种晶体的密度比为::=2b3:a3,故答案为:2b3:a3;
(4)在Fe3C晶体中,每个碳原子被6个位于顶角位置的铁原子所包围形成八面体结构,碳原子的配位数是6,根据Fe、C比为3:1,故Fe、C配原子数目之比为1:3,则铁原子的配位数为2,故答案为:2;
(5)由于在Fe3C晶体中,每个碳原子被6个位于顶角位置的铁原子所包围形成八面体结构,则形成碳化铁的铁的三种晶体结构中,最有可能的是γ-Fe,故答案为:γ-Fe;
(6)摩尔盐[ (NH4)2 SO4·FeSO4·6H2O]中的N、O、H可形成空间网络化氢键,将亚铁离子包围起来,避免其与氧化性物质接触,所以比较稳定,故答案为:摩尔盐中的N、O、H可形成空间网络化氢键,将亚铁离子包围起来,避免其与氧化性物质接触,所以比较稳定。
8.(1) 3s23p63d10
(2) s 5:1
(3)BC
(4)两者都是离子晶体,且阴阳离子电荷数都相同,但r(O2-)<r(S2-),所以Cu2O的晶格能大,熔点较高
(5)10
(6) FeCuS2
【详解】(1)①Cu是29号元素,根据构造原理可知基态Cu原子核外电子排布式是1s22s22p63s23p63d104s1,则基态Cu原子的M层电子排布式为3s23p63d10;
②CO和N2互为等电子体。等电子体结构相似,CO分子中C、O原子之间以共价三键C≡O结合,其中含有1个σ键,2个π键。在标准状况下V L CO气体中含有气体分子物质的量是n(CO)= 则该分子中含有的π键数目N(π)=2n(CO)NA=;
(2)Ca是20号元素,Ca原子核外电子排布为2、8、8、2,所以Ca位于元素周期表第四周期第ⅡA族,属于s区元素;
由图可知:上下底面为菱形,内角为120°、60°,上下面共用4个对称的Cu原子、前后面和左右面共用1个Cu原子,体心有1个Cu原子;Ca原子为晶胞的顶点,则一个晶胞中含有Ca的数目为4×+4×==1,含有Cu的数目为8×+1=5,所以钙铜合金中铜原子与钙原子的个数比为5:1;
(3)硫酸铜在溶液中完全电离产生自由移动的离子,不存在离子键;水分子之间存在范德华力、氢键,水分子、硫酸根中原子之间形成共价键,水合铜离子中存在配位键,不存在金属键,故合理选项是BC;
(4)已知Cu2O的熔点为1235℃,Cu2S的熔点为1130℃,二者的熔点都较高,但Cu2O熔点比Cu2S高,这是由于两者都是离子晶体,且阴阳离子电荷数都相同,但离子半径:r(O2-)<r(S2-),所以Cu2O的晶格能大,熔点较高;
(5)Cu2+可形成[Cu(X)2]2+,其中X代表CH3—HN—CH2—CH2—NH2,其中的C、N原子价层电子对数都是4,VSEPR模型为四面体形,1个[Cu(X)2]2+中含有的四面体形原子有2×5=10个,则1 mol [Cu(X)2]2+微粒中VSEPR模型为四面体的非金属原子共有10 mol;
(6)根据图示可知在一个晶胞中含有的Fe原子数目为:8×+4×+1=4;含有的Cy原子数目为:4×+6×=4,含有的S原子数目是8个,n(Fe):n(Cu):n(S)=1:1:2,所以该物质化学式为FeCuS2;
假设晶胞高度为c pm,该晶胞密度ρ=,所以晶胞的高度c=nm。
9.(1)[Ar]3d10或者1s22s22p63s23p63d10
(2)I1(Zn)> I1(Cu) > I1(Al)
(3) X(H)< X(C) < X(O) sp2、sp3
(4)X射线衍射实验
(5)D分子间存在氢键,增大了分子间作用力,C分子间没有氢键
(6)ABC
(7)
【详解】(1)铜元素位于周期表第四周期ⅠB族,核电荷数为29,基态Cu+的电子排布式[Ar]3d10或者1s22s22p63s23p63d10。
(2)Cu、Zn、Al失去第一个电子分别位于4s1、4s2、3p1,4s2电子处于全满轨道较难失去,三者中第一电离能最大,3p1是单电子,铝的核电荷数比铜小很多,其第一电离能最小,故三者的第一电离能由大到小的顺序为I1(Zn)> I1(Cu) > I1(Al)。
(3)H2C=CHCOOCH3中含H、C、O三种元素,同周期元素电负性从左往右增大,故C
(5)从C和D的分子结构简式分析,两者相对分子质量相差较小,C分子间以范德华力为主,D分子间存在氢键,增大了分子间作用力,故D的沸点明显高于C的。
(6)钙钯络合氢化物(CaPdH2)以Ca2+和[PdH2]2-(富电子)构成,阴阳离子间化学键是离子键,[PdH2]2-络合离子结构中的Pd和H原子存在配位键,共用电子对偏向H一边,属于非极性键,故答案选ABC。
(7)从白铜晶胞结构图可知,Cu原子位于立方晶胞的面心位置,Ni原子位于顶点位置,一个晶胞内含有Cu原子个数 ,含有Ni原子个数 ,设该立方晶胞的边长为nm,根据题意,有,Cu和Ni之间的最短距离为面对角线的一半,为 nm,故Cu和Ni之间的最短距离为nm。
10. ds V形 sp杂化 SO2 SO2为极性分子,CO2为非极性分子,H2O为极性溶剂,极性分子易溶于极性溶剂,故SO2的溶解度较大 紫 电子由较高能级跃迁到较低能级时,以光的形式释放能量 2∶1 面心立方最密堆积
【分析】X、Y、Z、M、N、Q、P为元素周期表前四周期的7种元素,X原子核外的M层中只有两对成对电子,核外电子排布应为1s22s22p63s23p4,X为S元素;Y原子核外的L层电子数是K层的两倍,Y有2个电子层,最外层电子数为4,则Y为C元素;Z是地壳内含量最高的元素,为O元素;M的内层电子数是最外层电子数的9倍,M只能处于第四周期,最外层电子数只能为2,内层电子总数为18,核外电子总数为20,M为Ca元素;N的原子序数比M小1,则N为K元素;Q在元素周期表的各元素中电负性最大,Q为F元素;P元素的第三电子层处于全充满状态,第四电子层只有一个电子,原子核外电子数=2+8+18+1=29,则P为Cu元素,据此解答。
【详解】X为S元素,Y为C元素,Z为O元素,M为Ca元素,N为K元素,Q为F元素,P为Cu元素。
(1)X为S元素,元素在周期表中的位置是:第三周期ⅥA族,外围电子排布为3s23p4,它的外围电子的电子排布图为,P元素为Cu,属于ds区元素;
(2)SO2分子中S原子价层电子对数2+=3,S原子含有1对孤电子对,所以其立体结构是V形,CO2分子C原子呈2个σ键、没有孤电子对,C的杂化轨道类型为sp杂化,SO2为极性分子,CO2为非极性分子,H2O为极性溶剂,极性分子易溶于极性溶剂,故SO2的溶解度较大;
(3)含有K元素的盐的焰色反应为紫色,许多金属盐都可以发生焰色反应,其原因是电子由较高能级跃迁到较低能级时,以光的形式释放能量;
(4)元素M与Q分别为Ca和F,形成的晶体为CaF2,Ca2+作面心立方最密堆积,F-做四面体填隙,Ca2+的配位数为8,F-的配位数为4,所以M离子与Q离子的配位数之比为2∶1;
(5)P为Cu,P单质形成的晶体中,原子采取的堆积方式为面心立方最密堆积,一个晶胞中有Cu的个数为8×个,设Cu的半径为r,则V球=4×=,根据几何关系,晶胞边长为a=2r,所以晶胞的体积V晶胞=a3=16r3,所以空间利用率为×100%。
【点睛】本题是对物质结构的考查,涉及核外电子的排布、化学键、杂化方式与空间构型、分子结构与性质、晶胞计算等,(4)中注意利用均摊法计算晶胞的质量,涉及球、立方体的体积的计算等,难度中等。
11. 2 平面三角形 阴阳离子半径大,离子所带电荷少,形成的离子晶体晶格能小,熔点低 12 sp 3 HgBr2·2NH3或Hg(NH3)2Br2或HgBr2(NH3)2
【详解】(1)N为7号元素,核外电子排布式为1s22s22p3,价电子排布式为2s22p3,所以价电子的轨道表达式为 ;同周期元素自左至右第一电离能呈增大趋势,但N原子2p轨道半满更稳定,第一电离能大于O,所以第二周期第一电离能大于N的有F、Ne两种元素;NH4NO3中阴离子为NO,中心原子的价层电子对数为=3,不含孤电子对数,所以空间构型为平面三角形;
(2)根据该物质的结构可知阴阳离子半径大,离子所带电荷少,形成的离子晶体晶格能小,熔点低;
(3)根据结构可知,有4+4=8个电子形成大π键,中心N原子与两侧的N原子分别形成一个σ键,有4个电子参与成键,所以键合电子总数为8+4=12;根据结构可知,②号N原子形成两个σ键,没有孤电子对,所以价层电子对数为2,为sp杂化;
(4)据图可知三个N原子与Fe3+通过螯合配位成环,所以1mol该螯合物中通过螯合作用形成的配位键有3mol;
(5)根据均摊法,该物质中含有2个NH3分子,一个Hg2+,=2个Br-,所以该物质的化学式为HgBr2·2NH3或Hg(NH3)2Br2或HgBr2(NH3)2;相邻的Br的距离均为apm,即晶胞底面的边长为a pm,晶胞的高为2a pm,则晶胞的体积为2a3pm3=2a3×10-30 cm3,晶胞的质量为为g=g,则密度为g·cm3。
12. 3d24s2 3 8 sp2 三氮唑分子间可形成氢键,而环戊二烯分子间不能形成氢键 6 或
【详解】(1) 钛元素的原子序数为22,位于元素周期表第四周期ⅣB族,基态原子的价电子排布式3d24s2;钛原子核外有2个未成对电子,第四周期有2个未成对电子的原子含有Ni、Ge、Se三种元素,故答案为:3d24s2;3;
(2) ①共价化合物中成键原子之间只能形成一个σ键,由三氮唑的结构简式可知分子中含有8个σ键,则l mol三氮唑分子中所含σ键的数目为8mol;氮唑分子中只含有双键碳原子,则碳原子的杂化方式为sp2杂化,故答案为:8;sp2;
②三氮唑分子中含有原子半径小、非金属性强的N原子,三氮唑分子间可形成氢键,而环戊二烯分子中不含有N原子,分子间不能形成氢键,则三氮唑的沸点高于环戊二烯,故答案为:三氮唑分子间可形成氢键,而环戊二烯分子间不能形成氢键;
(3) ①由晶胞结构可知,晶胞中每个钨原子周围距离其最近的碳原子有6个,故答案为:6;
②由晶胞结构可知,晶胞中钨原子的个数为1+2×+12×+6×=6个,由质量公式可得:,解得阿伏加德罗常数的值NA为,故答案为:;
③由晶胞结构可知,晶胞中镁原子的个数为1+8×=2,则晶胞中镁原子的体积为2× pm3;晶胞丁中虚线所标的四个硬球关系为正四面体关系,晶胞的体对角线为镁原子的原子半径的4倍,则晶胞的边长为2r pm,由晶胞高为h pm可知,晶胞体积为(2r)2h sin60 º pm3=2r2h,则晶胞中镁原子的空间利用率为==,故答案为:或。
13. 3d104s1 O=C=O 或CNO-或SCN- N>O>S sp2 正四面体 正八面体 (,,) 8:3
【分析】(1)Cu是29号元素,原子核外电子数为29,根据核外电子排布规律书写铜的基态原子价电子排布式;
(2)①该反应中CO2结构对称,CO2是由极性键构成的非极性分子;
②等电子体是原子数相同、价电子数也相同的微粒;
(3)同周期ⅤA族元素第一电离能大于ⅥA族元素,同主族元素从上到下第一电离能减小;
(4)分子中存在大π键,说明是平面结构,Se的杂化方式为sp2;
(5)根据晶胞图分析;
(6)根据电荷守恒计算Ni2+与Ni3+的最简整数比;
【详解】(1)Cu是29号元素,原子核外电子数为29,根据核外电子排布规律,铜的基态原子核外电子排布式是1s22s22p63s23p63d104s1 ,价电子排布式是3d104s1;
(2)①该反应中CO2结构对称,CO2是由极性键构成的非极性分子,CO2的结构式是O=C=O;
②、CNO-、SCN-、CO2价电子数都是16,与CO2互为等电子体的离子是或CNO-或SCN-;
(3)同周期ⅤA族元素第一电离能大于ⅥA族元素,同主族元素从上到下第一电离能减小,所以N、O、S的第一电离能由大到小的顺序为N>O>S;
(4)分子中存在大π键,说明是平面结构,Se的杂化方式为为sp2,Se未参与杂化p轨道中有2个电子,所以该大π键可表示为;
(5)由晶胞图可知,K+占据的是C60分子围成的正四面体空隙和正八面体空隙;
根据A、B、C的位置,建立坐标系如图,;距离A位置最近的阳离子(红圈标出)的原子坐标是(,,);
(6) 设Ni2+个数为X,则Ni3+个数是0.88-X,根据电荷守恒,2X+3(0.88-x)=2,解得x=0.64,Ni2+与Ni3+的最简整数比为0.64:(0.88-0.64)=8:3;1个氯化钠晶胞中含有4个Cl-,则1个NiaO晶体晶胞中含有4个O、4×0.88个Ni;所以密度是 。
【点睛】本题考查物质结构与性质,熟悉核外电子排布、同周期元素第一电离能的变化规律、晶胞计算是解题关键,注意根据“均摊原则”计算1个晶胞内含有原子数。
14. p 3
sp3 0.15NA P4和CS2是非极性分子,H2O是极性分子,根据相似相溶的原理,P4易溶于CS2,难溶于水 1s22s22p63s23p63d5 O>P>Fe 低于
【详解】(1)P原子核外有15个电子,分三层排布,即有三个能层,所以电子占据的最高能层符号为M;最外层为3s2p3,则磷元素位于周期表的p区,基态磷原子价层电子排布图为,故答案为p;;
(2)同一周期元素自左而右第一电离能呈增大趋势,但P元素原子3p能级是半满稳定状态,能量较低,第一电离能高于同周期相邻元素,故铝到磷元素的第一电离能P>S>Si>Al,所以第三周期中第一电离能位于铝元素和磷元素之间的有2种,同时Mg的第一电离能也大于Al,故答案为3;
(3)P4分子为正四面体构型,键角为60°,P4分子中每个P原子与相邻的3个P原子形成3个σ键、含有1对孤对电子,杂化轨道数目为4,则P原子采取sp3杂化;因为P4分子中每个P原子与相邻的3个P原子形成3个σ键,则平均每个P原子形成1.5个σ键,所以3.1g白磷中σ键的数目为×1.5=0.15mol,数目为0.15NA;相似相溶原理是指由于极性分子间的电性作用,使得极性分子组成的溶质易溶于极性分子组成的溶剂,难溶于非极性分子组成的溶剂;非极性分子组成的溶质易溶于非极性分子组成的溶剂,难溶于极性分子组成的溶剂,P4和CO2是非极性分子,H2O是极性分子,根据相似相溶的原理,P4易溶于CO2,难溶于水,故答案为sp3;0.15 NA;P4和CO2是非极性分子,H2O是极性分子,根据相似相溶的原理,P4易溶于CO2,难溶于水;
(4)Fe原子核外有26个电子,核外电子排布为1s22s22p63s23p63d64s2,Fe原子失去4s能级2个电子、3d能级1个电子形成Fe3+,Fe3+电子排布式为1s22s22p63s23p63d5;同周期元素从左到右元素的电负性逐渐增强,则电负性:S>P,同主族元素从上到下电负性逐渐减弱,则电负性:O>S,所以电负性O>P,又Fe为金属元素,则电负性由大到小的顺序是O>P>Fe,故答案为1s22s22p63s23p63d5;O>P>Fe;
(5)该晶胞中P原子个数=8×+6×=4,B原子个数为4,化学式为BP,设晶胞边长=acm,则晶胞的体积V=(acm)3,ρ==g•cm3,解得a=cm,根据图象,B与P最近距离为体对角线的,则B与P最近距离=××cm=×cm;P-B的键长比C-C键长大,熔点比金刚石低,故答案为×;低于。
15.(1)1s22s22p63s23p63d5
(2)Na<Al<Mg
(3) 氯化铝是分子晶体,熔融状态下不存在离子,不能导电 AD
(4) sp2 sp3 平面三角形 三角锥形
(5) 8
【详解】(1)铁元素为26号元素,其核外电子排布为1s22s22p63s23p63d6 4s2,铁一中失去最外层2个电子后,再失去一个3d电子就形成Fe3+,故Fe3+的核外电子排布为:1s22s22p63s23p63d5。
(2)同一周期元素第一电离能随着原子序数增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于其相邻元素,故Na、Mg、Al基态原子第一电离能的大小关系是 Na<Al<Mg。
(3)氯化铝的熔点是194℃,熔点较低,是分子晶体,由分子构成,熔融状态不存在离子,不能导电,故不能用电解其来制备单质;Al和F之间是配位键,Na+和AlF是离子键,故选:AD。
(4)BF3中的中心B原子的价层电子对数=3+=3,没有孤电子对,故B原子杂化类型为sp2杂化,分子的空间构型是平面三角形;H3O+的中心O原子的价层电子对数为=3+ =4,其VSEPR模型名称为正四面体,但O原子上有一对孤对电子对,故该O原子的杂化类型为sp3,其空间构型为三角锥形。
(5)根据均摊法,I2分子分布在顶点和面心,即有,碘原子数为4×2=8;I2晶体的质量是,体积为,故该晶体的密度是。
新疆高考化学三年(2021-2023)模拟题汇编-19原子结构与性质: 这是一份新疆高考化学三年(2021-2023)模拟题汇编-19原子结构与性质,共28页。试卷主要包含了单选题,结构与性质,填空题等内容,欢迎下载使用。
山西高考化学三年(2021-2023)模拟题汇编-19原子结构与性质: 这是一份山西高考化学三年(2021-2023)模拟题汇编-19原子结构与性质,共31页。试卷主要包含了单选题,工业流程题,结构与性质等内容,欢迎下载使用。
山西高考化学三年(2021-2023)模拟题汇编-19原子结构与性质: 这是一份山西高考化学三年(2021-2023)模拟题汇编-19原子结构与性质,共31页。试卷主要包含了单选题,工业流程题,结构与性质等内容,欢迎下载使用。












