
山西高考化学三年(2021-2023)模拟题汇编-19原子结构与性质
展开山西高考化学三年(2021-2023)模拟题汇编-19原子结构与性质
一、单选题
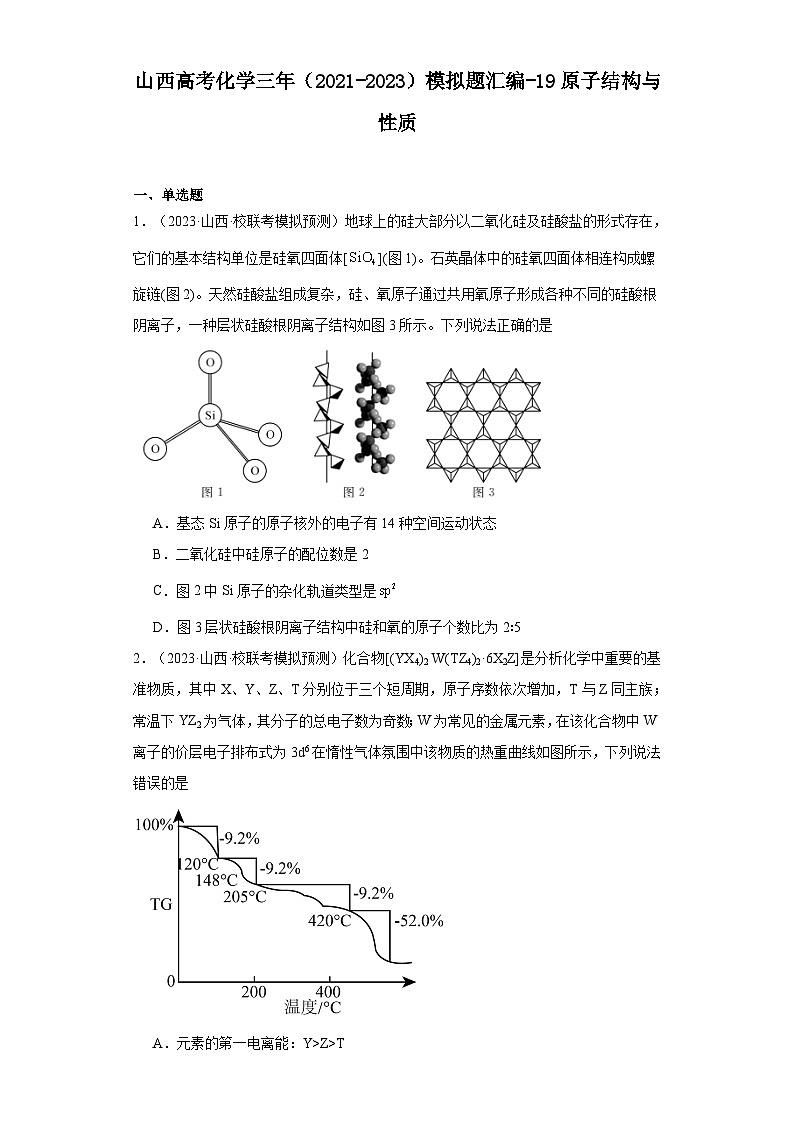
1.(2023·山西·校联考模拟预测)地球上的硅大部分以二氧化硅及硅酸盐的形式存在,它们的基本结构单位是硅氧四面体[](图1)。石英晶体中的硅氧四面体相连构成螺旋链(图2)。天然硅酸盐组成复杂,硅、氧原子通过共用氧原子形成各种不同的硅酸根阴离子,一种层状硅酸根阴离子结构如图3所示。下列说法正确的是
A.基态Si原子的原子核外的电子有14种空间运动状态
B.二氧化硅中硅原子的配位数是2
C.图2中Si原子的杂化轨道类型是
D.图3层状硅酸根阴离子结构中硅和氧的原子个数比为2∶5
2.(2023·山西·校联考模拟预测)化合物[(YX4)2 W(TZ4)2·6X2Z]是分析化学中重要的基准物质,其中X、Y、Z、T分别位于三个短周期,原子序数依次增加,T与Z同主族;常温下YZ2为气体,其分子的总电子数为奇数;W为常见的金属元素,在该化合物中W离子的价层电子排布式为3d6在惰性气体氛围中该物质的热重曲线如图所示,下列说法错误的是
A.元素的第一电离能:Y>Z>T
B.W元素位于元素周期表的d区
C.580℃热分解后得到的固体化合物是WZ
D.简单气态氢化物的稳定性:Z>Y
3.(2023·山西晋城·统考三模)有机物M是来源于植物的化合物,具有很强的生理活性,可用于治疗感冒和咳喘,结构式如图所示,其中短周期主族元素X、Y、Z、R的原子序数依次增大,Z和R的常见单质均为无色无味的气体。下列说法正确的是
A.第一电离能:
B.由X、Y、Z、R四种元素组成的化合物可能为离子化合物
C.有机物M中,各原子均满足8电子稳定结构
D.元素Y、Z、R的p电子总数均小于s电子总数
4.(2023·山西运城·统考二模)有机物M(结构简式为( )是合成花椒毒素的重要中间体,下列说法错误的是
A.电负性:F>O>N>C B.第一电离能:N>O>C
C.M中碳原子的杂化方式有2种 D.M可以形成分子间氢键
5.(2023·山西太原·统考一模)某抗氧化剂Z可由如图反应制得:
下列关于X、Y、Z的说法正确的是
A.Y中含有3个手性碳原子
B.X能在分子间形成氢键
C.Z中第一电离能最大的元素为氧
D.一定条件下,1 mol X分别与Br2、H2反应,最多消耗3 mol Br2、5 mol H2
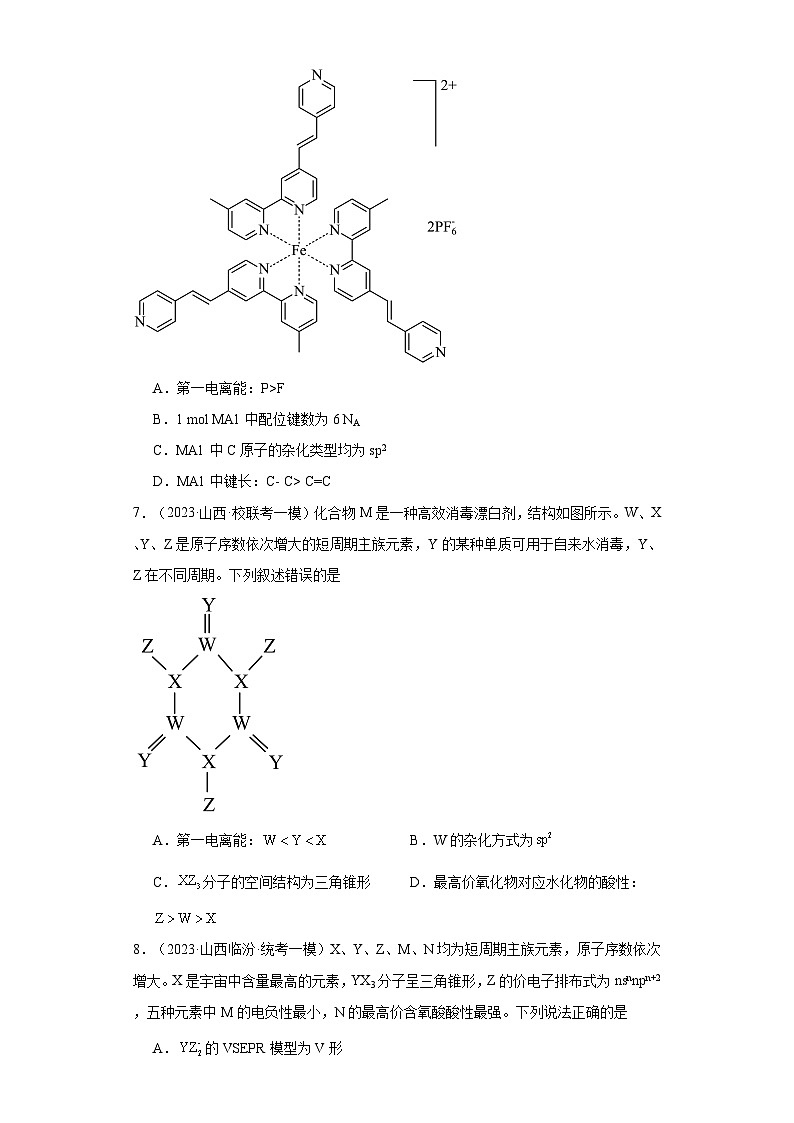
6.(2023·山西·统考一模)配合物MA1(结构如图)呈紫色,施加-2.7~2.5 V电压时,可呈现紫色到无色的可逆颜色变化。下列说法正确的是
A.第一电离能:P>F
B.1 mol MA1中配位键数为6 NA
C.MA1中C原子的杂化类型均为sp2
D.MA1中键长:C- C> C=C
7.(2023·山西·校联考一模)化合物M是一种高效消毒漂白剂,结构如图所示。W、X、Y、Z是原子序数依次增大的短周期主族元素,Y的某种单质可用于自来水消毒,Y、Z在不同周期。下列叙述错误的是
A.第一电离能: B.W的杂化方式为
C.分子的空间结构为三角锥形 D.最高价氧化物对应水化物的酸性:
8.(2023·山西临汾·统考一模)X、Y、Z、M、N均为短周期主族元素,原子序数依次增大。X是宇宙中含量最高的元素,YX3分子呈三角锥形,Z的价电子排布式为nsnnpn+2,五种元素中M的电负性最小,N的最高价含氧酸酸性最强。下列说法正确的是
A.的VSEPR模型为V形
B.由X、Y、Z三种元素组成的化合物的水溶液均显酸性
C.同周期中第一电离能大于Z的元素有3种
D.MN晶体中M离子的配位数为8
二、工业流程题
9.(2023·山西·校联考一模)主要用于电镀工业、生产镍镉电池,用作油脂加氢催化剂、媒染剂等。某兴趣小组用含镍废催化剂(主要含有,还含有、、及其他不溶于酸、碱的杂质)制备,其流程如下:
已知:①常温下,部分金属化合物的近似值如表所示:
化学式
近似值
②金属活泼性:。
③。
回答下列问题:
(1)元素在元素周期表中的位置为 ,其基态原子的价层电子排布式为 。
(2)“滤液1”中的主要溶质为、 。
(3)加入硫酸时,发生反应的离子方程式为 。
(4)加入的目的是将氧化为,该步骤 (填“能”或“不能”)用适量稀硝酸代替,理由是 。然后调节溶液的,则此时应调节溶液的至少为 (保留3位有效数字,离子浓度小于或等于时认为沉淀完全),检验“滤液3”中杂质金属离子已除尽的操作和现象是 。
(5)用配位滴定法测定粗品中的纯度。取粗品溶于水(滴加几滴稀硫酸)配成溶液,取溶液于锥形瓶中,滴入几滴紫脲酸胺指示剂(紫色试剂,遇显橙黄色),用浓度为的标准液滴定,平均消耗标准液。已知:。粗品中的纯度是 %;下列操作会使测定结果偏低的是 (填标号)。
A.锥形瓶中溶液颜色由橙黄色局部变为紫色后立即停止滴定
B.滴定前滴定管尖嘴内有气泡,滴定后尖嘴内无气泡
C.滴定前平视读数,滴定后仰视读数
10.(2023·山西临汾·统考一模)镍、钴元素在锂电池材料和国防工业方面应用广泛。一种利用酸浸出法从冶金厂废炉渣(含Ni、Co及少量Cu、Mg、Ca的化合物)中提取镍和钴的工艺流程如图:
已知:i.Ksp(CaF2)=1.0×10-10,Ksp(MgF2)=7.5×10-11;
ii.NiSO4在水中的溶解度随温度升高明显增大,不溶于乙醇和苯。
回答下列问题:
(1)“酸浸渣”主要成分的名称为 。
(2)基态Co原子的核外M层电子排布式为 。Co的核电荷数比Ni小1,但Co的相对原子质量比却Ni的略大,原因是 。
(3)“除铁”的离子方程式为 。
(4)“除钙镁”时,pH不宜过低的原因是 。Ca2+和Mg2+沉淀完全。时,溶液中c(F-)最小为 mol·L-1
(5)“萃取”原理为Co2+(aq)+2HA(有机相)⇌Co(A)2(有机相)+2H+(aq)。“反萃取”时为促进Co2+的转移,应选择的实验条件或采取的实验操作有① ;②多次萃取。
(6)获得NiSO4(s)的“一系列操作”中洗涤产品可选用 (填字母标号)试剂。
a.冷水 b.乙醇 c.苯
三、结构与性质
11.(2022·山西晋城·统考二模)目前已经确认了16种元素是植物生长所必需的,其中硼、铁、铜、钼等7种元素为必需的微量元素。回答下列问题:
(1)钼位于第5周期与Cr同族,试写出钼的基态价电子排布式 ,钼位于周期表第 纵行。
(2)铁元素能与多种分子或离子形成配位键,如[FeCl2(H2O)4]+、Fe(CO)5。
①[FeCl2(H2O)4]+中每个H2O的O周围σ键电子对有 对,游离态的水中H-O-H的键角比该配离子中H-O-H的键角小,其原因是 。
②CO分子中C原子和O原子,上均存在孤电子对,在Fe(CO)5中 (填元素符号)更容易为Fe提供孤电子对。
(3)硼氢化钠(NaBH4)具有很强的还原性,常用于有机合成,的VSEPR模型为 与其互为等电子体的阳离子有 (写一种)。
(4)一种铜的溴化物立方晶胞如图所示。
该化合物的化学式为 ,在晶体中与Br紧邻的Br有 个,若Cu原子与最近的Br原子的核间距为apm,则该晶体的密度计算表达式为 g·cm-3(用NA表示阿伏加德罗常数的值)。
12.(2022·山西运城·统考模拟预测)钛及其化合物在科技、生物、材料领域均有广泛应用。回答下列问题:
(1)基态钛原子核外s能级和p能级的电子数之比为 ;钛元素处于元素周期表的 区。
(2)含钛新型正极材料KTiPO4F具有高化学电位。
①PO的立体构型为 。与PO互为等电子体的分子为 (任写一种,填化学式)。
②KTiPO4F中所含元素的第一电离能由大到小的顺序为 (用元素符号表示)。
③一些氢化物的沸点如表所示:
氢化物
PH3
H2O
HF
沸点/℃
-87.5
100
19.5
解释表中氢化物之间沸点存在差异的原因: 。
(3)Ti(IV)在酸溶液中可形成多种离子。其中如图1所示结构的离子符号为 ;[Ti(OH)2(H2O)4]2+中配位键的数目为 。
(4)CaTiO3晶体中Ca、O原子在立方晶胞中的位置如图2所示,其中Ti原子填充在O原子围成的 (填“正八面体”或“正四面体”)空隙中;若阿伏加德罗常数的值为NA,晶体密度为ρg·cm-3,则O原子间的最近距离为 pm(用含NA、ρ的代数式表示)。
13.(2022·山西太原·统考三模)我国科学家开发了一种高电化学活性和水氧稳定的方酸锂可作为电池电解质的锂补偿剂和锂源。回答下列问题:
(1)方酸可用作合成有机光导体、液晶显示材料等的中间体,其结构如图所示。
①1 mol方酸中含有的σ键数目为 ,其中 C的杂化轨道类型是 。
②羧基中的羟基极性越大,越易电离出H+。三氟乙酸(CF3COOH)的酸性大于三氯乙酸(CCl3COOH),试从键的极性分析其原因可能是 。
(2)LiClO4 、LiBF4、LiPF4等离子液体也常作为锂离子电池的电解质。
①LiClO4中阴离子的空间结构名称是 。
②是一种配离子,请从配位键来解释其形成过程: 。
③LiPF6在一定条件下可分解生成PF5比较PF5和PCl5的热分解温度高低,利用键参数说明理由: 。
(3)1975年,锂键首次被实验证实,即X…Li-Y(X代表NH3, , H2O,CH3OCH3;Y代表Cl,Br)。锂键和氢键类似,但也有不同,下列有关说法错误的是___________(填字母)。
A.形成氢键(X-H…Y)三原子不一定在一条直线上。
B.氢键具有部分共价键的性质,锂键可能具有部分离子键的性质
C.电负性:Cl>Br;第一电离能:Cl>Br
D.分子间能形成氢键, CH3OCH3分子间不能形成氢键
(4)磷酸亚铁锂是一种锂离子电池的正极材料,其晶胞结构示意图如图(a)所示,其中O围绕Fe和P分别形成正八面体和正四面体,它们通过共顶点、共棱形成空间链结构。每个晶胞中含有LiFePO4的单元数有 个,电池充电时,LiFePO4脱出部分Li+ ,形成Li1-xFePO4,结构示意图如图(b)所示,则x= 。
(5)用于制造激光器的KH2PO4大晶体是由水溶液结晶出来的。分别用、●表示和K+,KH2PO4晶体的四方晶胞如图(a)所示,图(b)、图(c)分别显示的是、K+在晶胞xz面、yz面上的位置,则晶胞在x轴方向上的投影图为 (填字母)。
14.(2022·山西临汾·统考三模)总订单数已经超过1000架的国产大飞机C919预定在今年交付,其制造使用了较多含硼材料(如硼纤维、氮化硼等),多项技术打破了外国垄断。
(1)原子的能量由核电荷数、电子数、 三个因素共同决定;基态B原子的核外电子填充在 个轨道中。
(2)耐高温材料立方BN制备流程中用到NH3、BCl3和触媒剂Ca3B2N4。
①Ca、B、N三种元素电负性从大到小的顺序为 。
②BCl3中B原子的 轨道与Cl原子的 轨道形成σ键;形成BCl3过程中基态B原子价电子层电子先激发,再杂化,激发后B原子的价电子排布图为 。
③BCl3在四氯化碳中的溶解度远大于NH3,原因是 。
(3)硼砂是非常重要的含硼矿物。一种硼砂阴离子的结构如图1所示,则1mol该阴离子存在的配位键物质的量为 ,n= 。
(4)制造硼合金的原料硼化钙(CaB6)晶胞结构如图2所示,硼原子全部组成B6正八面体,各个顶点通过B-B键互相连接成三维骨架。已知该晶体晶胞参数为apm,B6八面体中B-B键的键长为dpm,M点原子的坐标参数为(,,),则N点原子的坐标参数为(___,1,0)。
15.(2022·山西·统考一模)碳元素在自然界中分布很广,是存在形式最复杂的元素。实验室可用邻二氮菲()与Fe2+形成的红色配合物(如下图)测定铁的含量。
回答下列问题:
(1)基态Fe原子核外电子的空间运动状态有 种。
(2)红色配合物中H、C、N、Fe四种元素的电负性从大到小的顺序为 。
(3)邻二氮菲分子中C、N两种元素原子的杂化方式分别为 、 。
(4)红色配离子的中心原子的配位数为 。
(5)红色配离子中不存在的作用力有 。
A. σ键 B.π键 C.离子键 D.氢键 E.配位键
(6)临床建议服用维生素C促进“亚铁”的吸收,避免生成Fe3+,从结构角度来看,Fe2+易被氧化成Fe3+的原因是 。
(7)三甲胺[N(CH3)3]和乙二胺(H2N-CH2-CH2-NH2)均属于胺,但三甲胺比乙二胺的沸点低得多,原因是 。
(8)汽车安全气囊产生气体的功臣是叠氮化钠(NaN3),N的空间构型为 。
(9)钨和碳能形成耐高温、耐磨材料碳化钨,其晶体结构如下图所示,六棱柱的底边长为apm,高为bpm,设阿伏加德罗常数的值为NA,则碳化钨晶体的密度是 g·cm-3(列出计算表达式)。
16.(2022·山西晋中·统考一模)2021年全世界前沿新材料领域取得新的进展,推动了高技术产业变革,钛(Ti)被称为“未来世界的金属”,广泛应用于国防、航空航天、生物材料等领域。请回答下列问题:
(1)基态Ti2+的价电子的电子排布图为 。与钛同周期的过渡元素中,基态原子未成对电子数最多的元素为 (写元素名称)。
(2)TiCl4分子中4个氯原子不在同一平面上,则TiCl4的立体构型为 。
(3)钙钛矿(CaTiO3)型化合物是一类可用于生产太阳能电池、传感器、固体电阻器等的功能材料。CaTiO3的晶胞如图(a)所示,其组成元素的电负性大小顺序是 。
(4)钛酸钙的阴、阳离子均可被半径相近的其他离子替代,从而衍生出多种钙钛矿型化合物。通过离子替代可获得具有优异光电性能的有机钙钛矿型化合物CH3NH3PbI3,其中有机阳离子CH3NH可由甲胺(CH3NH2)制得。其晶胞如图(b)所示。
①其中Pb2+与图(a)中 的空间位置相同。
②有机阳离子CH3NH中,N原子的杂化轨道类型是 ;请从化学键的角度解释由甲胺形成CH3NH的过程: 。
(5)将金属元素Al掺杂到TiN多层膜中,能有效地改善纳米多层膜的耐磨性。其晶胞结构如图所示,距离Ti最近的Al有 个。已知掺杂后的晶体密度为ρg·cm-3,阿伏加德罗常数的值为NA,原子①与原子②距离为 nm。
17.(2021·山西晋中·统考三模)云南师范大学杨智教授合成了一种以醚键桥联型双吡啶羧酸为配体的金属镍配合物(分子式为C12H10N2NiO7·2H2O)。本配合物具有一定的光催化效果,在光催化还原二氧化碳方面具有潜在的应用价值。
(1)基态Ni原子的电子排布式为 ,元素周期表中与镍位置相邻的某元素原子的最外层只有一个电子,则该元素位于元素周期表的 区,此区元素的价电子层结构特点是(n-1)d ns 。
(2)该配合物的配位原子为 ,配位原子轨道杂化类型为 。
(3)NH3、PH3、AsH3的沸点由高到低的顺序为 ,用物质结构理论加以解释: 。NH3、PH3、AsH3分子的键角分别为107.3°、93.3°、91.8°,其键角逐渐减小的原因是 。
(4)NiO晶体的结构与NaCl相同,已知NiO晶体的密度约为6.7 g·cm-3,则可计算出Ni2+与最邻近的O2-的距离为 cm(写出计算式,无需化简)。
18.(2021·山西太原·统考一模)据报道,我国化学研究人员用Ni(NO3)2和Tb(CH3COO)3等合成了一个镍的一维链状配位化合物(如图a所示),对镍配合物在磁性、电化学性质等方面的研究提出了理论指导。
请回答下列问题:
(1)基态Ni原子的价电子轨道表示式为 ,图a中1mol配合物含σ键数目为 。
(2)C、N、O三种元素中电负性最小的是 (填元素符号),C在形成化合物时,其键型以共价键为主,原因是 。
(3)Ni(NO3)2中阴离子的空间构型是 ,写出与该阴离子互为等电子体的一种分子的化学式: 。
(4)图a配合物中,碳原子的杂化类型是 。已知:常压下CH3COOH的沸点为117.9℃,甲酸甲酯(HCOOCH3)的沸点为32℃,CH3COOH的沸点高于HCOOCH3的主要原因是 。
(5)已知:氧化镍的晶胞结构如图b所示。
①若NA为阿伏加德罗常数的值,晶体密度为ρg·cm-3,则该晶胞中最近的两个O2-之间的距离为 pm(用含ρ、NA的代数式表示)。
②一定温度下,NiO晶体可以自发地分散并形成“单分子层”,可以认为O2-作密置单层排列,Ni2+填充其中,如图c所示。已知O2-的半径为am,阿伏加德罗常数的值为NA,则每平方米上分散的该晶体的质量为 g。(用含a、NA、的代数式表示,图中大白球表示O2-,小黑球表示Ni2+)
19.(2021·山西阳泉·统考三模)钛(Ti)及其化合物的应用研究是目前前沿科学之一,请回答下列问题:
(1)基态钛原子的电子排布式为 ,核外电子占据的轨道数为 。
(2)与钛位于同一周期且基态原子单电子数与钛相同的元素,第一电离能由大到小的顺序为 (用元素符号填空)。
(3)TiCl4常温下为无色液体,熔点250K,沸点409K,则TiCl4属于 晶体。TiCl4在水中或空气中极易水解,露置于空气中形成白色烟雾,烟雾中的固体成分可用TiO2·nH2O表示,请写出TiCl4在空气中产生烟雾的化学方程式: 。
(4)TiO2作光催化剂可将甲醛、苯等有害气体转化为CO2和H2O。
①上述含碳原子的分子中,碳原子的杂化方式为sp2的是 (填名称,下同),属于极性分子的是 。
②下列各组微粒互为等电子体的是 (填字母标号)。
A.H2O与SO2 B.CO2与N2O C.CH2O与BF3 D.C6H6与B3N3H6
(5)金红石(TiO2)的晶胞结构如图所示,晶胞内均摊的氧原子数为 ;设NA为阿伏加德罗常数的值,则该晶体的密度为 g·cm-3(用含相关字母和符号的代数式表示)。
参考答案:
1.D
【详解】A.1个原子轨道称为1种空间运动状态,基态Si原子的电子排布式为,原子核外的电子的空间运动状态数目为,即有8种空间运动状态,A错误;
B.二氧化硅中硅原子的配位数是4,B错误;
C.晶体的结构中有顶角相连的硅氧四面体,所以Si原子的杂化轨道类型是,C错误;
D.由图3可知,每个硅氧四面体分别以三个顶角氧和其他相邻的三个硅氧四面体共享,根据均摊法,每个硅氧四面体含有的氧原子数为,含有的硅原子数为1,则硅和氧的原子个数比为,D正确;
故选D。
2.C
【分析】W为常见的金属元素,离子的价层电子排布式为3d6,则W为Fe元素;X、Y、Z、T分别位于三个短周期,原子序数依次增加,则X为H元素;常温下YZ2为气体,其分子的总电子数为奇数,则YZ2为二氧化氮、Y为N元素、Z为O元素;T与Z同主族,则T为S元素。
【详解】A.同主族元素,从上到下第一电离能依次减小,同周期元素,从左到右第一电离能呈增大趋势,氮原子的2p轨道为稳定的半充满结构,元素的第一电离能大于相邻元素,则第一电离能由大到小的顺序为N>O>S,故A正确;
B.铁元素的原子序数为26,基态原子的价电子排布式为3d64s2,则铁元素位于元素周期表的d区,故B正确;
C.由题意可知,化合物的化学式为(NH4)2Fe(SO4)2⋅6H2O,相对分子质量为392,取1mol该物质进行热重分析,由热重曲线可知,580℃热分解后得到固体的质量为392g×(100%−9.2%−9.2%−9.2%−52.0%)≈80g,则固体化合物为0.5mol氧化铁,故C错误;
D.同周期元素,从左到右元素的非金属性依次增强,简单氢化物的稳定性依次增强,则水分子的稳定性强于氨分子,故D正确;
故选C。
3.B
【分析】短周期主族元素X、Y、Z、R的原子序数依次增大,有机物M结构中X形成1条共价键, Y形成4条共价键,则X为H;Y为C;Z形成3条共价键,R形成2条共价键,且Z和R的常见单质均为无色无味的气体,则Z为N;R为O;综合以上分析,X、Y、Z、R依次为H、C、N、O,据此分析解答。
【详解】A.同一周期元素从左到右第一电离能有增大趋势,但N的2p轨道处于半充满状态,第一电离能相对较高,第一电离能:,A项错误;
B.由H、C、N、O四种元素组成的化合物可能为离子化合物,如(NH4)2CO3、NH4HCO3均为离子化合物,B项正确;
C.有机物M中H的最外层仅有两个电子,不是8电子稳定结构,C项错误;
D.元素C、N、O电子排布式分别为1s22s22p2、1s22s22p3、1s22s22p4,s电子总数都是4,p电子总数分别为2、3、4,由此可知,O元素的p电子总数等于s电子总数,D项错误;
答案选B。
4.C
【详解】A.同周期元素(惰性气体元素除外)从左到右电负性逐渐增大,所以电负性:F>O>N>C,故A正确;
B.同周期随原子序数增大,元素第一电离能呈增大趋势,但N元素原子2p能级为半满稳定状态,能量较低,第一电离能高于同周期相邻元素的,第一电离能:N>O>C,故B正确;
C.M中存在羰基、-C≡N和-CH3,M中碳原子的杂化方式有sp、sp2、sp3共3种,故C错误;
D.M中含有亚氨基(-NH-),可以形成分子间氢键,故D正确;
故选C。
5.B
【详解】A.手性碳原子是指与四个各不相同原子或基团相连的碳原子,Y中含有1个手性碳原子,位置为,故A错误;
B.X中含有羟基和羧基,能在分子间形成氢键,故B正确;
C.Z中含有C、H、O、N四种元素,N位于IVA族,最外层电子半充满,第一电离能大于O,则电离能最大的元素为N,故C错误;
D.X中含有苯环、碳碳双键可以和H2发生加成反应,碳碳双键可以和Br2发生加成反应,1 mol X分别与Br2、H2反应,最多消耗1mol Br2、4 mol H2,故D错误;
故选B。
6.D
【详解】A.第一电离能同周期从左往右依次增大:P
B.该物质中除了N与Fe之间有配位键, P与F之间也有配位键,1 mol MA1中配位键数大于6 NA,B项错误;
C.苯环上的-CH3的C为sp3杂化,C项错误;
D.C=C中作用力比C-C强,键长C-C>C=C,D项正确;
故选D。
7.D
【分析】W、X、Y、Z是原子序数依次增大的短周期主族元素,Y的某种单质可用于自来水消毒,结合图示结构式可知,Y形成2个共用电子对,则说明Y最外层有6个 ,推知Y为O元素,臭氧可用于自来水消毒; W形成4个共用电子对,则推知W为C,X形成三个共用电子对达到稳定结构,则X为N元素,Z形成1个共用电子对,且与Y不同周期,则说明Z为Cl元素,据此分析。
【详解】根据上述分析可知,W、X、Y、Z分别是C、N、O和Cl,则
A.同周期元素第一电离能呈增大趋势,因VA族最高能级电子处于半充满稳定结构,所以第一电离能反常比第VIA族的大,所以第一电离能:,A正确;
B.上述分子中,C原子形成碳氧双键,杂化方式为sp2,B正确;
C.(NCl3)分子的价层电子对数=3+=4,所以其分子空间结构为三角锥形,C正确;
D.非金属越强,最高价氧化物对应水化物的酸性越强,因非金属性:Cl>N>C,所以其最高价氧化物对应水化物的酸性:,D错误;
故选D。
8.C
【分析】X、Y、Z、M、N均为短周期主族元素,原子序数依次增大;X是宇宙中含量最高的元素,则X为H;Z的价电子排布式为nsnnpn+2,则n=2,故Z为O;YX3分子呈三角锥形,则Y为N;M的电负性最小,则M为Na;N的最高价含氧酸酸性最强,则N为Cl。
【详解】A.由分析可知,Y为N,Z为O,的中心原子的价层电子对数为2+=2+1=3,含有一对孤对电子,其VSEPR模型为平面三角形,A错误;
B.由分析可知,X为H,Y为N,Z为O,由这三种元素组成的化合物的水溶液不一定显酸性,比如NH3∙H2O,B错误;
C.由分析可知,Z为O,同一周期,从左到右,元素的第一电离能逐渐增大,其中IIA族和VA族的元素的第一电离能高于与其相邻的元素,故第二周期中,第一电离能大于O的有N、F、Ne,C正确;
D.由分析可知,M为Na,N为Cl,在NaCl晶体中,Na+周围有6个Cl-,则Na+的配位数为6,D错误;
故选C。
9.(1) 第四周期VIII族
(2)
(3)
(4) 不能 硝酸与反应会产生污染环境的有毒气体,且会引入杂质 2.83 取少量滤液于试管中,滴加几滴溶液,若溶液不变红,则已除尽
(5) A
【分析】废氢镍催化剂进行碱浸后,氧化铝、铝均能与碱反应,得到的滤液1为过量的氢氧化钠、偏铝酸钠,滤渣1为Ni、Fe、Fe2O3和其他不溶性杂质等;进行酸浸后,滤渣2为不溶性杂质,滤液2为Ni2+、Fe2+、Fe3+等,加入双氧水后,亚铁离子被氧化为铁离子,再调溶液的pH,使得铁离子变为氢氧化铁沉淀而除去,得到滤渣3,滤液2为含有Ni2+的溶液,控制pH进行一系列操作后得到硫酸镍晶体,据以上分析进行解答。
【详解】(1)Ni的原子序数为28,在元素周期表的位置为第四周期VIII族;其基态原子的价层电子排布式为;
(2)根据上述分析可知,滤液1主要为过量的NaOH和;
(3)因为金属活泼性:,可知加入硫酸后,Ni会与硫酸发生反应生成NiSO4和氢气,其离子方程式为:;
(4)加入的目的是将氧化为,偏于后续沉铁,硝酸虽然也具有氧化性,但与反应会产生污染环境的有毒气体,且会引入杂质,所以不能用适量稀硝酸代替过氧化氢;
根据Ksp近似值可知,铁离子沉淀时溶液中氢氧根离子浓度为,所以溶液中的氢离子浓度为,即pH=-lgc(H+)=;
杂质除尽后不含铁离子,因此使用KSCN溶液作为试剂,可检测是否已除尽,具体操作和现象为:取少量滤液于试管中,滴加几滴溶液,若溶液不变红,则已除尽;
(5)根据滴定方程式可知,恰好滴定到终点时,n(Ni2+)=n()=mol,滴定取了25mL粗品溶液,则100mL该溶液中含Ni2+的物质的量为mol,即NiSO4的物质的量为mol,则其纯度=;
A.锥形瓶中溶液颜色由橙黄色局部变为紫色后,需半分钟之内不褪色,再停止滴定操作,若立刻停止滴定,则滴入的标准液体积偏小,最终会使测定结果偏低,A符合题意;
B.滴定前滴定管尖嘴内有气泡,滴定后尖嘴内无气泡,滴入的标准液体积偏大,最终会使测定结果偏高,B不符合题意;
C.滴定前平视读数,滴定后仰视读数,所测的标准液体积偏大,最终会使测定结果偏高,C不符合题意;
故选A。
10.(1)硫酸钙
(2) 3s23p63d7 Co 的质量较大的同位素在自然界中丰度较高
(3) +6Fe2++ 15H2O =Cl- +6Fe(OH)3↓+12H+
(4) c(H+)过高,c(F-)减小, 不利于钙镁沉淀完全 10-2.5或3.1610-3
(5)酸性条件
(6)ab
【分析】废炉渣(含Ni、Co及少量Cu、Mg、Ca的化合物),加入硫酸酸浸后,酸浸渣主要成分为硫酸钙;滤液中主要含有硫酸镍、硫酸钴、硫酸铜、硫酸镁等,加入过量铁粉还原除铜得到铜,滤液再加入氯酸钠氧化除铁,得到氢氧化铁,再加入NaF除钙镁,滤渣为CaF2、MgF2;加入萃取剂HA萃取得到含有NiSO4溶液,一系列操作后得到NiSO4晶体,故为蒸发浓缩、冷却结晶,过滤、洗涤干燥等;有机相加入硫酸反萃取,得到CoSO4溶液;
【详解】(1)酸浸时用硫酸,产生的硫酸钙微溶,故“酸浸渣”主要成分的名称为硫酸钙;
(2)Co是27号元素,基态Co原子的核外电子排布式为[Ar]3d74s2或1s22s22p63s23p63d74s2,故其M层电子排布式为3s23p63d7;
Co 的质量较大的同位素在自然界中丰度较高,故虽然Co的核电荷数比Ni小1,但Co的相对原子质量比却Ni的略大;
(3)“除铁”时加入的氯酸钠将亚铁离子氧化,反应生成氢氧化铁,反应的离子方程式为 +6Fe2++ 15H2O =Cl- +6Fe(OH)3↓+12H+;
(4)“除钙镁”时,随着pH的降低,溶液中的H+增加,H++F-HF的平衡正向移动,溶液中c(F-)减小,为使CaF2和MgF2的溶解平衡逆向移动,NaF用量更多;已知离子浓度≤10-5 mol/L时,认为该离子沉淀完全,且Ksp(CaF2)=1.010-10,Ksp (MgF2)=7.510-11,钙离子沉淀完全时镁离子已沉淀完全,c(F- )== 10-2.5( mol/L)= 3.1610-3( mol/L),所以为使Ca2+和Mg2+沉淀完全,溶液中c(F- )最小为10-2.5 或3.16×10-3;答案为c(H+)过高,c(F-)减小, 不利于钙镁沉淀完全;10-2.5 或3.16×10-3;
(5)“反萃取”时为促进Co2+的转移,应选择的实验条件或采取的实验操作有①酸性条件;②多次萃取;
(6)获得NiSO4(s)的“一系列操作”中洗涤产品使其溶解度降低而晶体析出,故可选用冷水或乙醇,答案选ab。
11.(1) 4d55s1 6
(2) 3 游离态的水分子中O原子孤电子对对σ键的斥力比该配离子水分子中O原子的σ键之间的斥力大,造成H—O—H键角减小 C
(3) 正四面体
(4) CuBr 12
【详解】(1)钼与Cr元素同族,故其价电子层电子相同,Cr的价电子排布式是3d54s1,所以钼元素的价电子排布式是“4d55s1”;Cr元素位于元素周期表第四周期IVB族,在元素周期表第6纵行,所以钼元素也位于元素周期表第6纵行;
(2)在配离子[FeCl2(H2O)4]+中,水分子中有自身形成的两个H—O σ键,同时O原子与中心离子Fe3+之间还形成一条配位键σ键,所以每个水分子共有“3”条σ键;孤电子对对σ键的斥力大于σ键之间的斥力,所以本问第二空应填“游离态的水分子中O原子孤电子对对σ键的斥力比该配离子水分子中O原子的σ键之间的斥力大,造成H—O—H键角减小”;在Fe(CO)5中配位体CO中,C元素非极性更弱一些,其孤电子对更容易作为共用电子对提供给Fe;
(3)离子中B原子与周围四个H原子之间有4条σ键,所以该离子中心原子B价层电子对数为4,其VSEPR模型对应是“正四面体”;离子中有五个原子,共8个价电子,故与其属于等电子体的应该也是五个原子,8个价电子的微粒,所以可以是CH4、、SiH4等多个微粒;
(4)该晶胞中有4个Cu原子位于晶胞内部,故晶胞Cu原子数为4,有8个Br原子位于顶点,6个Br原子位于面心,故晶胞Br原子数为,Cu与Br原子个数比为4﹕4=1﹕1,所以该晶胞对应化合物的化学式为“CuBr”;以晶胞中一个顶点的Br原子为参照点,与其距离相等且最近的是共同拥有该顶点的三个面上面心的Br原子,该顶点为8个晶胞所共有,每个面心上的Br原子为两个晶胞共用,所以在晶体中与Br紧邻的Br有个;若将该晶胞再均分为8块,则有Cu原子的小立方体中Cu原子正好位于立方体体心,Br原子到Cu原子的最短距离为apm,则小立方体的体对角线为2apm,则晶胞的体对角线为4apm,设晶胞棱长为x,根据勾股定理有,解之得,根据之前的分析,每个晶胞中有4个Cu原子和4个Br,所以该晶胞的质量为,晶胞体积为(1pm=10-10cm),所以该晶体的密度计算式为,整理后本问第三空应填“ ”。
12.(1) 2:3 d
(2) 正四面体形 CCl4 F>O>P>Ti>K 三种物质均为分子晶体,H2O和HF分子间均能形成氢键,等物质的量的H2O分子间比HF分子间氢键数目多,PH3分子间不能形成氢键
(3) TiO2+ 6
(4) 正八面体 ××1010
【详解】(1)①钛元素的原子序数为22,基态钛原子核外电子排布式为,s能级的电子数为8,p能级的电子数为12,则s能级和p能级的电子数之比为2:3;
②钛元素的原子序数为22,为第四周期ⅣB族元素,所在元素周期表的d区;
(2)①PO根据杂化轨道理论P的价层电子对数(5+3×0+3)/2=4,孤电子对数为0,为sp3杂化,则O的立体构型为正四面体;
PO互为等电子体的分子为CCl4;
②KTiPO4F中所含元素为F、O、P、K、Ti,同周期元素从左往右第一电离能增大,同周期第一电离能最小的是碱金属元素,同主族元素从上往下第一电离能减小,则第一电离能由大到小的顺序为:F>O>P>Ti>K;
③影响熔沸点的主要因素为分子间作用力,氢键为较强的分子间作用力,H2O和HF中存在氢键,三种物质均为分子晶体,H2O和HF分子间均能形成氢键,等物质的量的H2O分子间比HF分子间氢键数目多,PH3分子间不能形成氢键;
(3)由图可知,1个Ti原子实际占用1个O原子,有Ti的化合价推知,离子符号为;
[Ti(OH)2(H2O)4]2+中与H2O分子与形成配位键,故配位键的数目为6;
(4)①CaTiO3晶体中Ca、Ti、O原子个数比为1:1:3,由晶胞结构可知,Ti原子填充在O原子周围形成正八面体空隙中;
②每个晶胞含有个Ca,有个O,有1个Ti,设晶胞参数为acm,则,解得,O原子间最近的距离为晶胞对角线长度的一半,则为××1010。
13.(1) 10NA sp2 氟的电负性比氯的大,使得F-C的极性大于Cl-C,使得F3C-的极性大于Cl3C-的极性,导致三氟乙酸的羧基中的羟基的极性更大,更易电离出氢离子
(2) 正四面体 F-提供孤电子对,BF3接受孤电子对(或其他合理答案) PF5的热分解温度高于PCl5,因为P-F键的键长小于P-Cl键的键长,P-F 键的键能大于P-Cl键的键能
(3)D
(4) 4 0.1875或
(5)B
【详解】(1)①单键均为σ键,双键中有一条σ键一条Π键,由结构简式可知,1mol该物质中含有10NAσ键;该结构中C原子均形成双键,采用sp2,故答案为:10NA;sp2;
②F和Cl为同主族元素,F分电负性大于Cl,电负性越大形成的共价键极性越强,因此F-C的极性大于Cl-C,从而使得F3C-的极性大于Cl3C-的极性,导致三氟乙酸的羧基中的羟基的极性更大,更易电离出氢离子,故答案为:氟的电负性比氯的大,使得F-C的极性大于Cl-C,使得F3C-的极性大于Cl3C-的极性,导致三氟乙酸的羧基中的羟基的极性更大,更易电离出氢离子;
(2)①LiClO4中阴离子的,其中心Cl原子的价层电子对数为,无孤电子对,为正四面体结构,故答案为:正四面体;
②是一种配离子,其由BF3和F-结合形成,中心B原子存在空轨道,F-离子存在孤电子对,两者结合时提供空轨道,F-离子提供孤电子对,形成配位键,故答案为:F-提供孤电子对,BF3接受孤电子对;
③和中,F原子的电负性大于Cl,P-F键的键长比P-Cl键的键长短,键长越短,键能越大,形成的物质越稳定,因此的分解温度高于,故答案为:PF5的热分解温度高于PCl5,因为P-F键的键长小于P-Cl键的键长,P-F 键的键能大于P-Cl键的键能;
(3)形成氢键(X-H…Y)三原子可能共线,也可能不在同一直线上,故A正确;
B. 氢键为两个非金属原子之间的作用力具有部分共价键的性质,锂键是离子与其他原子之间形成的特殊作用力,可能具有部分离子键的性质,故B正确;
C. 氯、溴为同主族元素,从上到下同主族元素的电负性减弱,第一电离能减弱,故电负性:Cl>Br;第一电离能:Cl>Br,故C正确;
D. CH3OCH3分子中存在非金属性较强的O原子,也能形成分子间氢键,故D错误;
故答案为:D;
(4)由晶胞结构可知每个晶胞中含有LiFePO4的单元数有4个,充电前锂离子有8个在顶点个数为:、4个在棱心个数为,4个在面心个数为,一个晶胞中锂离子个数为4个,充电后锂离子部分损失,有8个在顶点个数为:、3个在棱心个数为,3个在面心个数为,个数为,此时该晶胞对应的化学式为:,即1-x=,x=,故答案为:0.1875或;
(5)晶胞顶点的投影到正方形的四个顶点,上面面心的●投影到正方形的上下棱心,体心都应到面心,体内的令另两个投影到体心靠下处,两侧面山的投影到距离正方形上顶点处,两侧棱上心上的●投影到正方形的两侧边的中心上,两侧面上的●投影到正方形的两侧边的距下顶点处,晶胞体内的两个●投影到正方形面内距离上边长处,由此可知B符合题意,故答案为:B;
14.(1) 电子(运动)状态 3
(2) N>B>Ca sp2杂化 3p BCl3和四氯化碳均为非极性分子,而氨气属于极性分子,相似相溶
(3) 2mol 2
(4)
【详解】(1)整个原子的能量由核电荷数、电子数和电子(运动)状态三个因素共同决定;基态B原子的电子排布式为:1s22s22p1,故其核外电子填充在1s,2s,2p三个轨道中;
(2)①金属的电负性较小,另外,同周期元素电负性从左向右在增大,故Ca、B、N三种元素电负性从大到小的顺序为:N>B>Ca;
②BCl3中B原子的价层电子对数为3,其杂化方式为sp2,故BCl3中B原子的sp2杂化轨道与Cl原子的3p轨道形成σ键;基态B原子价电子层上的电子先进行激发,再进行杂化,说明B原子激发后的三个轨道能量相同,故激发时B原子的价电子排布图为: ;
③极性相似的物质溶解度较大,BCl3和四氯化碳为非极性分子,氨气为极性分子,故原因是:BCl3和四氯化碳均为非极性分子,而氨气属于极性分子,相似相溶;
(3)由图1可知,图中连有羟基的B原子含有配位键,故1mol该阴离子存在的配位键物质的量为2mol,在该阴离子中B显+3价,O显-2价,H显+1价,根据化合价的关系可知,n=2;
(4)将8个正八面体的中心连接呈晶胞的立方晶系图,由M点坐标知该原子位于晶胞的中心,且每个坐标系的单位长度都记为1,已知B6八面体中B -B键的键长为d pm,晶胞参数为a pm,则八面体中心到顶点的距离为:,则N点在棱的处,其坐标为(,1,0)。
15.(1)15
(2)N > C > H > Fe
(3) sp2 sp2
(4)6
(5)CD
(6)Fe3+的 3d5半充满状态更稳定
(7)都属于分子晶体,乙二胺分子间可以形成氢键,三甲胺分子间不能形成氢键
(8)直线形
(9)
【分析】(1)Fe为26号元素,分析其在元素周期表中的位置;
(2)电负性为元素的原子在化合物中吸引电子的能力,电负性大的元素呈负价,电负性小的元素呈正价,非金属性越强,电负性越大;根据电负性的变化规律比较电负性大小;
(3)根据σ和π键的数目可知杂化方式;
(4)N原子含有1对孤对电子,与Fe2+形成配位键;
(5)邻二氮菲中含有C= C双键和C= N双键,邻二氮菲与Fe2+通过配位键形成配离子;
(6)Fe2+很容易失去1个电子形成3d5的半满结构;
(7)氢键的存在能够显著提高物质的熔沸点
(8)根据等电子体知识,来判断构型;
(9)根据晶胞图所示结构计算晶体密度,密度公式为ρ=;
【详解】(1)基态Fe的电子排布式为1s22s2sp63s23p63d64s2,s轨道有一种空间运动状态, p轨道有三种空间运动状态,d道有五种空间运动状态,3d轨道有6个电子,有5种空间运动状态,因此基态Fe原子的核外电子的空间运动状态有15种;
(2)在元素周期表中同一周期从左到右元素的电负性逐渐增强,同一主族从上到下元素的电负性逐渐减弱,Fe为金属电负性最小,可知电负性强弱顺序N > C > H > Fe;
(3)根据邻二氮菲C周围的键为3个σ和1π,故C的杂化为sp2,N周围的键为3个σ和1π,故N的杂化为sp2;
(4)由图1可知,该配离子中Fe2+与氮原子形成配位键共有6个,N原子含有1对孤对电子,与Fe2+形成配位键
(5)该离子为配离子,不存在离子键,但含有配位键,并且邻二氮菲中含有碳碳或碳氮双键,所以含有π键和σ键,氢键不存在,CD符合题意;
故选CD。
(6)Fe2+的核外价电子排布为3d5,很容易失去1个电子形成3d5的半满结构;
(7)氢键的存在能够显著提高物质的熔沸点,乙二胺分子间可以形成氢键,三甲胺分子间不能形成氢键,所以乙二胺( H2NCH2CH2NH2)和三甲胺[N(CH3)2]均属于胺,但乙二胺比三甲胺的沸点高得多;
(8)原子数相同,价电子数相同的微粒互为等电子体,则与N互为等电子体的微粒有CO2,CO2为直线形,故N的结构为直线形;
(9)根据晶胞的图可知中含有W的数目为12×+2×+6×+1=6个,含有C的数目为6个,晶胞的质量为m=nM=,晶胞的体积为6××a×a×sin60°×b×10-30cm3=×10-30cm3,晶胞的密度为:ρ===g/cm3。
16.(1) 铬
(2)正四面体
(3)O>Ti>Ca
(4) Ti4+ sp3 氨分子中的一个氢原子被甲基取代后,所得甲胺(CH3NH2 )的性质与氨相似,其中的N原子有一对孤电子,可以通过配位键再结合一个H+形成CH3NH
(5) 4
【详解】(1)基态Ti2+的价电子排布式为3d2, 则价电子的电子排布图为 ;与钛同周期的过渡元素中,基态原子未成对电子数最多的元素为铬,其价电子排布式为: 3d5 4s1;
(2)TiCl4分子中4个氯原子不在同一平面上,则TiCl4的立体构型为正四面体;
(3)Ca和Ti为同周期的金属元素,Ca在Ti的左边,同周期从左向右元素的电负性依次增大,所以电负性:Ti>Ca,O为非金属元素,得电子能力强,电负性最大,即CaTiO3中组成元素的电负性大小顺序是O> Ti> Ca;
(4)观察晶胞(a)(b),将图(b)周围紧邻的八个晶胞的体心连接,就能变成图(a)所示晶胞,图(b)体心上的Pb2+就是8个顶点,即图(a)中的Ti4+,图(b)顶点上的就为体心,即图(a)的Ca2+的位置,图(b)面心上的I就是棱心,即图(a)中的O2-的位置,所以图(b)中Pb2+与图(a)中Ti4+的空间位置相同;
②CH3NH中以N原子为中心原子,价层电子对数为4,孤电子对为0,N的杂化方式为sp3杂化;
从化学键的角度解释由甲胺形成的过程氨分子中的一个氢原子被甲基取代后,所得甲胺(CH3NH2 )的性质与氨相似,其中的N原子有一对孤电子,可以通过配位键再结合一个H+形成,
故答案为:氨分子中的一个氢原子被甲基取代后,所得甲胺(CH3NH2 )的性质与氨相似,其中的N原子有一对孤电子,可以通过配位键再结合一个H+形成;
(5)用Al掺杂TiN后(晶胞结构中只是铝原子部分代替钛原子),其晶胞结构如图所示可知,TiN晶胞中顶点和面心为N原子,棱心和体心上为Ti,现在是将体心上的Ti换为了Al,故距离Ti最近的Al有4个;
已知掺杂后的晶体密度为ρg·cm-3,则晶胞的边长为xcm,阿伏加德罗常数的值为NA,则有:(3,解得,原子①与原子②距离为=。
17. [Ar]3d84s2 ds 10 1或2(1~2也可) N和O sp2、sp3 NH3>AsH3>PH3 结构相似,相对分子质量越大,范德华力越大,沸点越高。NH3、PH3和AsH3相对分子质量依次增大,但NH3和NH3之间存在氢键,则其沸点最高 中心原子电负性越大,相应的键角就越大
【详解】(1)Ni位于4周期Ⅷ族,基态Ni原子的电子排布式为[Ar]3d84s2;与之相邻且最外层只有1个电子的元素只有Cu,Cu位于4周期ⅠB族,故属ds区,此区特点次外层d轨道全充满,最外层s轨道1或2电子;
(2)N和O提供孤电子对,都是配位原子,价层电子对数分别是3和4,故N和O的轨道杂化类型分别是sp2和sp3;
(3)NH3、AsH3和PH3均为分子晶体,且结构相似,但NH3分子之间存在氢键,则其沸点最高,故NH3、PH3、AsH3的沸点由高到低的顺序为NH3>AsH3>PH3;
NH3、PH3、AsH3分子均为三角锥形,结构相似,中心原子电负性越大,中心原子周围电子云密度越大,化学键之间的相互排斥作用越大,相应的键角就越大;
(4)
在NiO晶胞中含镍原子数为8×+6×=4,氧原子数为1+12×=4,NiO的摩尔质量为75 g•mol-1,所以晶胞的质量为300g,所以晶胞的边长为,故Ni2+与最邻近的O2-的距离,即为晶胞的棱长的,即为。
【点睛】本题围绕金属镍的配合物(分子式为C12H10N2NiO7·2H2O)考查了电子排布式、元素周期表的分区及原子结构特点、配合物的基本概念、中心原子的轨道杂化,从微观上考查了气态氢化物分子的键角比较,从宏观上考查了气态氢化物的沸点比较。另外,还借NiO考查了NaCl晶胞结构及计算。
18. 42NA C C有4个价电子,处于易得和易失电子的中间位置 平面三角形 SO3 sp2、sp3 CH3COOH分子间存在氢键、而HCOOCH3分子之间没有氢键
【分析】按等电子体理论、根据价层电子对互斥理论计算硝酸根离子中的价层电子对数、并确定其等电子体;用均摊法计算晶胞的质量、按密度ρ=计算晶胞的边长、求出2个离子之间的距离;
【详解】(1)Ni原子序数为28,基态Ni原子价层电子的排布式为3d84s2,由泡利原理、洪特规则,可得的价电子轨道表示式为;单键全部是σ键、双键中有1个σ键、1个π键,则由图a的结构简式可知:不饱和五元环的σ键有2×7+2×3+2=22个,每个五元环内有1个CH2、1个N、3个CH,2个五元环内共有2×10=20个σ键,则1个配合物分子含σ键42个,1mol配合物含σ键数目为42NA。
(2)C、N、O三种元素位于第二周期,同一周期元素的电负性随原子序数的增大而增大,所以电负性 ,电负性最小的是C,C在形成化合物时,其键型以共价键为主,原因是碳原子最外层有4个电子,处于易得和易失电子的中间位置,不容易得或失电子形成稳定结构。
(3)Ni(NO3)2中阴离子为硝酸根离子,中心原子N的孤电子对数为、 价层电子对数为3+0=3,故其空间构型是平面三角形;硝酸根离子为4原子的微粒、价电子总数为24,与之互为等电子体的一种分子的化学式:SO3(或BF3)。
(4)图a配合物中,碳原子有饱和碳原子,有不饱和的双键碳原子:碳碳双键、碳氮双键、碳氧双键,故碳原子的杂化类型是sp3、sp2。CH3COOH和甲酸甲酯(HCOOCH3)互为同分异构体,常压下CH3COOH的沸点高于HCOOCH3的主要原因是:CH3COOH分子间存在氢键、而HCOOCH3分子之间没有氢键。
(5)①由晶胞结构知,氧离子位于棱边的中点和体心,数目为 ,镍离子位于面心和顶点,则数目为,晶胞的质量为 ,晶体密度为ρg·cm-3,设晶胞边长为acm,晶胞的体积 ,则 ,该晶胞中最近的两个O2-之间的距离为 。
②平面NiO基本结构单元为,每个结构单元含有1个“NiO“,每个氧化镍所占的面积=(2am)×(2am×sin60°)=2a2m2,则每平方米含有的氧化镍个数 ,每个氧化镍的质量 ,所以每平方米含有的氧化镍质量 g。
19. 1s22s22p63s23p63d24s2或[Ar]3d24s2 12 Se>Ge>Ni 分子 TiCl4+2H2O=TiO2+4HCl 甲醛、苯 水 BD 4
【详解】(1)基态钛为22号元素,其电子排布式为1s22s22p63s23p63d24s2或[Ar]3d24s2,故占有1s(1)、2s(1)、2p(3)、3s(1)、3p(3)、3d(2)、4s(1)共占据12个轨道;
(2)Ti的单电子数为2(即3d上的2个),与Ti同周期且含有2个单电子的是Ni、Ge、Se;同一周期元素,核电荷数越大,第一电离能越大,故第一电离能大小顺序为Se>Ge>Ni;
(3)TiCl4为分子晶体(熔沸点较低),TiCl4在空气中生成烟雾:TiCl4+2H2O=TiO2+4HCl;
(4) ①含C原子的分子有甲醛、苯、二氧化碳,其中C原子为sp2杂化的分子为甲醛和苯;极性分子为正负电中心不重合,水的两个正电中心H,一个负电中心O不重合,故属于极性分子为水;
②A.水的价电子数为8,二氧化硫的价电子数为18,不属于等电子体,A错误;
B.二氧化碳和N2O价电子数均为16,原子数均为3,属于等电子体,B正确;
C.CH2O的价电子数为12,BF3 的价电子数为24,不属于等电子体,C错误;
D.C6H6与B3N3H6中价电子数均为30,原子数均为12,属于等电子体,D正确;
答案选BD;
(5)由图可知,黑色球代表O,共有上下两面的4个和体内的2个,即个,则晶胞中含有2个TiO2,,故,,底为平行四边形,。
新疆高考化学三年(2021-2023)模拟题汇编-19原子结构与性质: 这是一份新疆高考化学三年(2021-2023)模拟题汇编-19原子结构与性质,共28页。试卷主要包含了单选题,结构与性质,填空题等内容,欢迎下载使用。
河南高考化学三年(2021-2023)模拟题汇编-31原子结构与性质: 这是一份河南高考化学三年(2021-2023)模拟题汇编-31原子结构与性质,共50页。试卷主要包含了结构与性质等内容,欢迎下载使用。
山西高考化学三年(2021-2023)模拟题汇编-19原子结构与性质: 这是一份山西高考化学三年(2021-2023)模拟题汇编-19原子结构与性质,共31页。试卷主要包含了单选题,工业流程题,结构与性质等内容,欢迎下载使用。












