




高中化学第一节 化学反应速率评课ppt课件
展开我们知道,相同条件下,不同的化学反应会有不同的速率。
这表明反应速率首先是由反应物的组成、结构和性质等内部因素决定。
其次,同一反应,在不同条件下的化学反应速率也是不同的,受外部因素浓度、压强、温度及催化剂等影响。
【思考】这些因素是如何影响化学反应速率的?
1、通过实验探究,学会运用变量控制的方法研究化学反应速率;2、认识反应条件对化学反应速率影响的一般规律,能运用规律解释生产、生活和科学实验中的实际问题。3、能用简单碰撞理论说明反应条件对化学反应速率的影响。
一、影响化学反应速率的因素
1、定性研究影响化学反应速率的因素
【实验探究】浓度对化学反应速率的影响
Na2S2O3 + H2SO4 = Na2SO4 + SO2↑ + S↓ + H2O
其他条件相同时,增大反应物浓度,化学反应速率加快。
【实验探究】温度对化学反应速率的影响
其他条件相同时,升高反应体系的温度,化学反应速率加快。
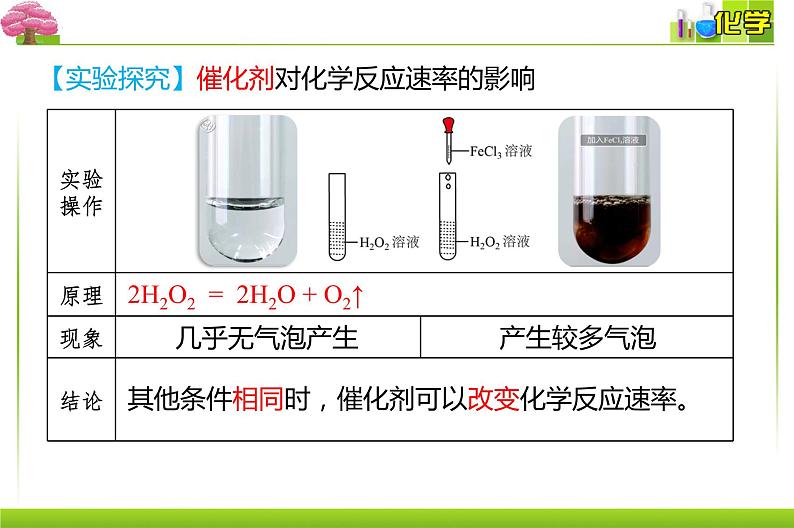
【实验探究】催化剂对化学反应速率的影响
2H2O2 = 2H2O + O2↑
其他条件相同时,催化剂可以改变化学反应速率。
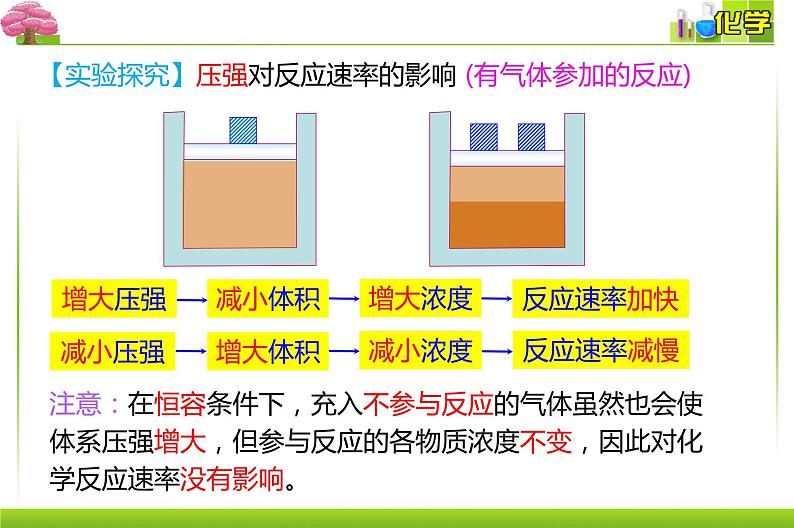
【实验探究】压强对反应速率的影响 (有气体参加的反应)
注意:在恒容条件下,充入不参与反应的气体虽然也会使体系压强增大,但参与反应的各物质浓度不变,因此对化学反应速率没有影响。
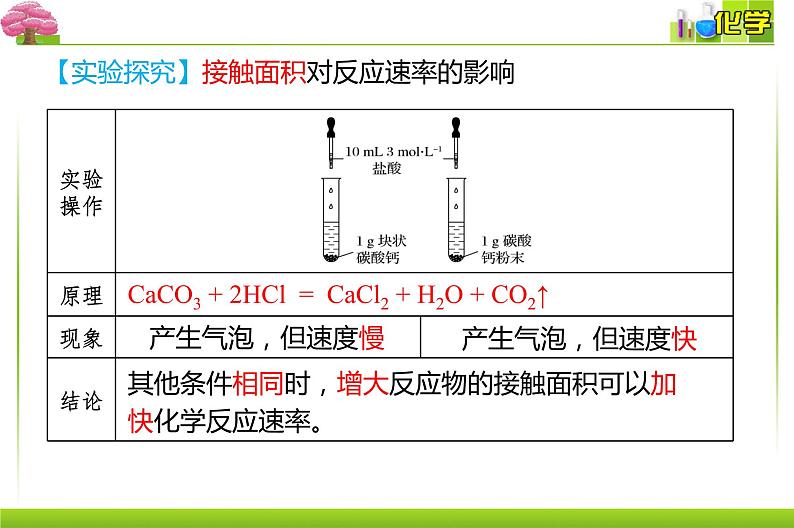
CaCO3 + 2HCl = CaCl2 + H2O + CO2↑
其他条件相同时,增大反应物的接触面积可以加快化学反应速率。
【实验探究】接触面积对反应速率的影响
2、定量研究影响化学反应速率的因素
Zn + H2SO4 = ZnSO4 + H2↑
1、下列做法的目的与反应速率无关的是( ) A. 将煤块粉碎后燃烧 B. 食盐中添加碘酸钾 C. 合成氨反应中加催化剂Fe D. 医护人员冷藏存放“新冠”疫苗
2、下列各组反应(表中物质均为反应物)刚开始时,放出H2速率最快的是( )
4、足量块状铁与100mL 0.01ml/L的稀硫酸反应,反应速率太慢。为了加快此反应速率而不改变H2的产量,可以使用如下方法中的( )①加NaCl溶液 ②加NaOH固体 ③加CH3COONa固体④升高温度 ⑤将块状铁改为铁粉 ⑥改用的98%浓硫酸 A. ①②③ B. ③④⑥ C. ④⑤ D. ④⑤⑥
【思考】如何解释浓度、压强、温度及催化剂等因素对化学反应速率产生的影响呢?
要解释浓度、压强、温度及催化剂等因素对化学反应速率产生的影响,就必须清楚分子间发生化学反应的必要条件。
【思考】那分子间发生化学反应的必要条件是什么呢?
实际上,大多数化学反应并不是经过简单碰撞一次就能完成的,更多的化学反应过程要分为多步进行。
【例如】 2HI = H2 + I2,实际上是经过下列两步反应完成的:
1、基元反应:通过一次碰撞就直接转化为产物的反应
【例如】NO2 + CO = NO + CO2
基元反应发生的先决条件:反应物的分子必须发生碰撞
自由基:带有单电子的原子或原子团
【思考】是不是反应物的分子每一次碰撞都能发生反应?
2、有效碰撞:能够发生化学反应的碰撞
【思考】反应物的分子要发生有效碰撞需满足什么条件?
(1)发生碰撞的分子必须有足够的能量;
(2)分子发生碰撞时必须有合适的取向。
4、活化分子:具有足够能量能发生有效碰撞的分子
5、活化能:反应物中的普通分子转化为活化分子所需的能量
活化分子变成生成物分子放出的能量
【思考】活化能与反应热有关吗?
反应热∆H = E1 - E2
③有效碰撞的次数与单位体积内反应物中活化分子的数目(即活化分子百分数)有关。
①能发生有效碰撞的分子一定是活化分子;
②活化分子的碰撞不一定是有效碰撞;(由于取向问题)
④其他条件不变时,同一反应活化分子在反应物中所占的百分数是一定的。
1、浓度、压强对反应速率的影响
二、碰撞理论解释化学反应速率的影响因素
2、温度、催化剂对反应速率的影响
催化剂作用:降低反应所需的活化能
结论:只有升高温度或加入催化剂能增加单位体积内的活化分子百分数 。
化学第二章 化学反应速率与化学平衡第一节 化学反应速率公开课课件ppt: 这是一份化学第二章 化学反应速率与化学平衡第一节 化学反应速率公开课课件ppt,文件包含新人教版化学选择性必修一212影响化学反应速率的因素活化能课件pptx、新人教版化学选择性必修一212影响化学反应速率的因素活化能针对练习含解析docx、新人教版化学选择性必修一212影响化学反应速率的因素活化能教案doc等3份课件配套教学资源,其中PPT共28页, 欢迎下载使用。
高中化学人教版 (2019)选择性必修1第一节 化学反应速率作业课件ppt: 这是一份高中化学人教版 (2019)选择性必修1第一节 化学反应速率作业课件ppt,共24页。PPT课件主要包含了反应速率减小,淀粉溶液,无色溶液变蓝等内容,欢迎下载使用。
人教版 (2019)选择性必修1第一节 化学反应速率精品课件ppt: 这是一份人教版 (2019)选择性必修1第一节 化学反应速率精品课件ppt,共50页。PPT课件主要包含了知识梳理,正误判断,问题导学,核心突破,试题调研,完成课时作业六,课后作业等内容,欢迎下载使用。













