












高中化学人教版 (2019)必修 第一册第二节 离子反应公开课课件ppt
展开第一章 物质及其变化
人教版高中化学必修一
1.2.3 离子反应
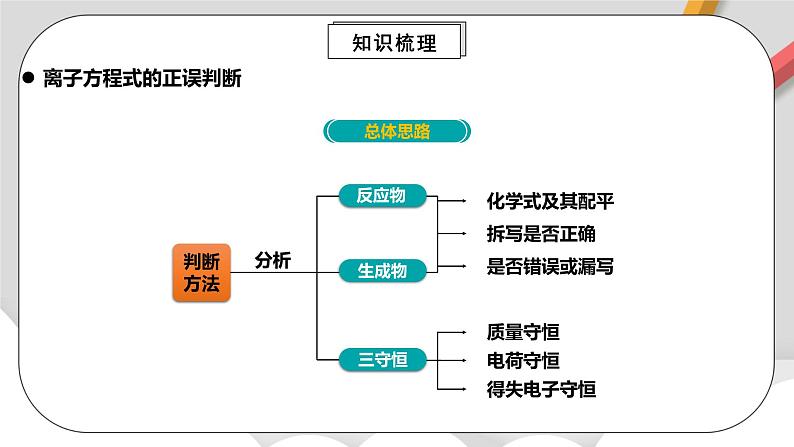
离子方程式的正误判断
离子方程式的正误判断
看离子反应是否符合客观事实,不可主观臆造产物及反应。
如石灰石与稀盐酸的反应不能写成CO32-+2H+===H2O+CO2↑,应写成CaCO3+2H+===Ca2++H2O+CO2↑。
如铁与稀硫酸的反应不能写成2Fe+6H+===2Fe3++3H2↑,应写成Fe+2H+===Fe2++H2↑。
看各物质的化学式拆写是否正确。
注意:微溶物在生成物中当成沉淀,不拆写;若为反应物且为澄清溶液则拆成离子,如Ca(OH)2。
离子方程式的正误判断
看原子和电荷是否守恒。
看是否漏写参加反应的离子。
看反应物或生成物的配比是否正确。
如Cu与AgNO3溶液反应的离子方程式不能写成Cu+Ag+===Cu2++Ag,而应写成Cu+2Ag+===Cu2++2Ag。
【例1】判断下列反应的离子方程式正误。①稀硫酸滴在铜片上:Cu+2H+===Cu2++H2↑( )②稀硫酸与氢氧化钡溶液混合: +Ba2+===BaSO4↓( )③稀硝酸滴在大理石上:CaCO3+2H+===Ca2++H2CO3( )④氧化铁与稀盐酸混合:Fe2O3+6H+===2Fe3++3H2O( )⑤氢氧化铜和稀盐酸反应:OH-+H+===H2O( )⑥镁和硝酸银溶液反应:Mg+Ag+===Mg2++Ag( )
×
√
×
×
×
×
1.下列反应的离子方程式书写正确的是( )A.金属镁与稀盐酸反应:Mg+2H++2Cl-===MgCl2+H2↑B.氯化钡溶液与硫酸反应:Ba2++ ===BaSO4↓C.碳酸钠溶液与盐酸反应:Na2CO3+2H+===2Na++H2O+CO2↑D.氢氧化镁与硫酸溶液反应:OH-+H+===H2O
B
2.下列离子方程式正确的是( )A.二氧化碳与足量澄清石灰水反应:CO2+2OH-=== +H2OB.将稀硫酸滴在铜片上:Cu+2H+===Cu2++H2↑C.碳酸氢钠溶液与稀H2SO4反应: +2H+===H2O+CO2↑D.氯化镁溶液与氢氧化钠溶液反应:Mg2++2OH-===Mg(OH)2↓
D
溶液中离子大量共存的判断
溶液中离子共存的判断原理
离子共存即溶液中的离子之间不能发生反应。判断溶液中的离子能否大量共存,事实上是看离子之间能否发生反应,若能发生反应,则不能大量共存;若不能发生反应,则能大量共存。
生成难溶物或微溶物
生成气体或挥发性物质
生成难电离的物质(弱酸、弱碱、水)
能发生复分解反应的离子不能大量共存
溶液中离子大量共存的判断
“三看”突破溶液中离子能否大量共存问题
(题干是否有隐含条件)
溶液中离子大量共存的判断
“三看”突破溶液中离子能否大量共存问题
溶液中离子大量共存的判断
涉及量的离子方程式的书写
此法就是将“不足量反应物的化学式”前面的配平系数设定为“1 ” ,在此起点上再去推导出其它物质(包括另一种过量的反应物和产物)的配平系数。
此法的原理是:设为“1 ”非权宜之计,其含义乃指不足量反应物中参加反应的相关离子在反应中按其化学式数量完全被消耗殆尽无剩余,而另一个相对过量的反应物中参加反应的相关离子是按前者所需被索取的。
溶液中离子大量共存的判断
写出不足量反应物中参加离子反应的相关离子或分子。若为离子,则其离子数目之比必须符合不足量反应物的化学式。
再依次写出过量的反应物以及产物中的与反应相关的离子(不带系数),最后再予以配平。(配平后,若有分数,则可通分化整。)
此法的特点是,由于不必考虑不参加离子反应的 等离子,所以不必先写出化学反应方程式,而可一次性直接得到离子反应方程式。
例:以NaHCO3溶液与Ba(OH)2溶液反应
溶液中离子大量共存的判断
涉及量的离子方程式的书写
(1)NaHCO3溶液
(2) NaHCO3溶液
:过量
:少量
2NaHCO3+Ba(OH)2=BaCO3↓+Na2CO3+2H2O
NaHCO3+Ba(OH)2=BaCO3↓+NaOH+H2O
——(氢氧化钡不足)
——(氢氧化钡过量)
2HCO3-+Ba2+ + OH-=BaCO3↓+CO32-+H2O
HCO3-+Ba2+ + OH-=BaCO3↓++H2O
【例1】在无色溶液中能大量共存的一组离子是( )A. Cu2+、SO42-、K+、Cl- B.Ag+、Cl-、OH-、Na+C. NO3-、Cl-、Na+、Ca2+ D. NO3- 、 OH- 、Mg2+、Na+
C
【例2】下列各组中的离子,能在溶液中大量共存的是( )K+、H+、 SO42- 、OH- B. Na+、Ca2+、CO32-、 NO3- C. Na+、H+、Cl-、 CO32- D. Na+、Cu2+、Cl-、 SO42-
D
【例3】某溶液中加入铁粉能产生氢气,在该溶液中一定能大量共存的离子组是( )(提示:金属与HNO3反应不产生H2)A. B.C. D.
A
1.对四组无色透明溶液进行离子检验,四位同学各鉴定一组,他们的实验报告的结论如下,其中可能正确的是( )A. B.C. D.
D
2.在下列条件的溶液中,各组离子一定能够大量共存的是( )A.使酚酞溶液变红的溶液:B.无色透明溶液中:C.可与锌反应放出氢气的溶液中:D.使pH试纸变蓝的溶液中:
D
常见离子的检验与推断
依据
离子推断要坚持“四项基本原则”
离子反应所表现出的某“唯一性”的特征性质及现象。
(1)肯定性原则:
据现象推断存在或肯定不存在的离子。
(2)互斥性原则:
如溶液中含有Ba2+,则不存在大量的CO32-、SO42-。
(3)进出性原则:
要注意所加试剂引入什么离子,是否造成干扰。
(4)守恒原则(电中性原则) :
阳离子和阴离子同时存在于溶液中且正负电荷总量相等。
常见离子的检验与推断
常见离子的检验方法
根据离子性质不同而在实验中所表现出的现象不同,可把检验离子的方法归纳为三种类型:①生成沉淀;②生成气体。
【例1】某研究性学习小组欲分析某矿石的主要成分,粉碎后将其溶于过量稀盐酸中充分反应,过滤后用所得滤液进行如下实验,下列说法正确的是( )A.取少量滤液向其中滴加少量Na2CO3溶液,无白色沉淀,说明矿石中一定不含Ca2+B.取少量滤液向其中滴加过量BaCl2溶液,产生白色沉淀,说明矿石中含有SO42-C.取少量滤液,向其中滴加适量NaOH溶液,产生白色沉淀,说明矿石中一定含有Mg2+D.取少量滤液向其中加入硝酸酸化的硝酸银,产生白色沉淀,说明矿石中一定含有Cl-
B
1.某无色、澄清溶液中可能含有①Na+、②SO42- ③Cl-、④HCO3-、⑤CO32-、⑥H+、⑦Cu2+中的几种,且每种离子的浓度均相等。依次进行下列实验,每步所加试剂均过量,观察到的现象如下:
下列结论正确的是( )A.该实验无法确定是否含有③ B.肯定含有的离子是①②⑥C.可能含有的离子是①③ D.肯定不含的离子有④⑤⑦
B
1.下列离子方程式书写正确的是( )A.Ba(OH)2和H2SO4两溶液混合:Ba2++OH-+H++ ===BaSO4↓+H2OB.氢氧化铜加到盐酸中:OH-+H+===H2OC.锌和硝酸银溶液反应:Zn+Ag+===Ag+Zn2+D.FeCl3和NaOH溶液反应:Fe3++3OH-===Fe(OH)3↓
D
2.下列各组中的离子,能在溶液中大量共存的是( )A. K+ H+ SO42- OH- B. Na+ Ca2+ CO32- NO3-C. Na+ H+ Cl- CO32- D. Na+ Cu2+ Cl- SO42-
D
3.A、B、C、D四种可溶性盐,它们的阳离子分别是Ba2+、Ag+、Na+、Cu2+中的某一种,阴离子分别是 中的某一种。①若把四种盐分别溶解于四支试管中,只有C的溶液呈蓝色。②若向①的四支试管中分别加入盐酸,B溶液有沉淀产生,D溶液有无色无味气体逸出。根据①②中的实验事实,可推断它们的化学式分别是A 、B 、C 、D 。
BaCl2
AgNO3
CuSO4
Na2CO3
4.有一包白色固体粉末,其中可能含有NaCl、Ba(NO3)2、CuSO4、Na2CO3中的一种或几种,现做以下实验:①将部分粉末加入水中,振荡,有白色沉淀生成,过滤,溶液呈无色;②向①的沉淀中加入足量稀硝酸,固体完全溶解,并有气泡产生;③取少量②的溶液,滴入稀硫酸,有白色沉淀产生;④另取①中过滤后的溶液加入足量AgNO3溶液,产生白色沉淀。根据上述实验事实,回答下列问题:(1)原白色粉末中一定含有的物质是 ,一定不含有的物质是 ,可能含有的物质是 (均填化学式)。
Ba(NO3)2、Na2CO3
CuSO4
NaCl
(2)写出①、②步变化的离子方程式:① ;② 。
BaCO3+2H+===Ba2++CO2↑+H2O
5.黄山市屯溪一中期中)离子反应是中学化学中重要的反应类型,回答下列问题:(1)在发生离子反应的反应物或生成物中,一定存在 (填序号)。①单质 ②氧化物 ③电解质 ④盐 ⑤化合物
③⑤
(2)将两种化合物一起溶于水得到一种无色透明溶液,溶液中含有下列离子中的某些离子:K+、Mg2+、Fe3+、Ba2+、 ,取该溶液进行如下实验:Ⅰ.取少量溶液滴入紫色石蕊溶液,溶液呈蓝色。Ⅱ.取少许溶液滴入BaCl2溶液,无白色沉淀产生。Ⅲ.另取少许溶液先滴加硝酸再加AgNO3溶液,产生白色沉淀。Ⅳ.再取少许原溶液滴入少量H2SO4溶液,有白色沉淀产生。①根据以上现象判断,原溶液中肯定不存在的离子是_______________________;肯定存在的离子是 。
Ba2+、OH-、Cl-
②写出实验Ⅲ和Ⅳ中可能发生反应的离子方程式:Ⅲ. ___________________________, ___________________________ 。Ⅳ. ______________________________________________________ 。
H++OH===H2O
Cl-+Ag===AgCl↓
③如溶液中各种离子的浓度相等,确定溶液中 (填“有”或“无”)K+,判断依据是_____________________________________________________________。
无
溶液中一定有Ba2+、Cl-、OH-,浓度相等时电荷守恒,所以无K+
(2)将两种化合物一起溶于水得到一种无色透明溶液,溶液中含有下列离子中的某些离子:K+、Mg2+、Fe3+、Ba2+、 ,取该溶液进行如下实验:Ⅰ.取少量溶液滴入紫色石蕊溶液,溶液呈蓝色。Ⅱ.取少许溶液滴入BaCl2溶液,无白色沉淀产生。Ⅲ.另取少许溶液先滴加硝酸再加AgNO3溶液,产生白色沉淀。Ⅳ.再取少许原溶液滴入少量H2SO4溶液,有白色沉淀产生。
6.判断下列各组离子能否大量共存① Ca2+ Na+ CO32- NO3-② Ca2+ Na+ SO42- NO3-③ H+ K+ Cl- OH-④ NH4+ K+ OH- SO42-⑤ SO42- K+ H+ HCO3- ⑥ Na+ K+ OH- HCO3-
Ca2+ 、CO32- 生成难溶物 CaCO3
Ca2+ SO42- 生成微溶物 CaSO4
H+、OH- 生成水
NH4+ 、 OH- 生成 NH3 · H2O
H+ 、HCO3- 生成弱酸 H2CO3
OH- 、HCO3- 生成CO32-和水
课程结束
高中化学人教版 (2019)必修 第一册第二章 海水中的重要元素——钠和氯第一节 钠及其化合物优秀ppt课件: 这是一份高中化学人教版 (2019)必修 第一册第二章 海水中的重要元素——钠和氯第一节 钠及其化合物优秀ppt课件,文件包含人教版高中化学必修一213《钠及其化合物》课件pptx、人教版高中化学必修一213《钠及其化合物》同步练习解析版docx、人教版高中化学必修一213《钠及其化合物》同步练习原卷版docx等3份课件配套教学资源,其中PPT共28页, 欢迎下载使用。
高中人教版 (2019)第三节 氧化还原反应优秀课件ppt: 这是一份高中人教版 (2019)第三节 氧化还原反应优秀课件ppt,文件包含人教版高中化学必修一133《氧化还原反应》课件pptx、人教版高中化学必修一133《氧化还原反应》同步练习解析版docx、人教版高中化学必修一133《氧化还原反应》同步练习原卷版docx等3份课件配套教学资源,其中PPT共22页, 欢迎下载使用。
高中化学人教版 (2019)必修 第一册第三节 氧化还原反应完美版课件ppt: 这是一份高中化学人教版 (2019)必修 第一册第三节 氧化还原反应完美版课件ppt,文件包含人教版高中化学必修一132《氧化还原反应》课件pptx、人教版高中化学必修一132《氧化还原反应》同步练习解析版docx、人教版高中化学必修一132《氧化还原反应》同步练习原卷版docx等3份课件配套教学资源,其中PPT共24页, 欢迎下载使用。













