






- 1.1 物质的分类及转化(第二课时)课件+教案+练习 课件 84 次下载
- 1.2离子反应(第一课时)课件+教案+练习 课件 93 次下载
- 1.2离子反应(第三课时)课件+教案+练习 课件 86 次下载
- 1.3氧化还原反应(第一课时)课件+教案+练习 课件 84 次下载
- 1.3氧化还原反应(第二课时)课件+教案+练习 课件 82 次下载
高中化学人教版 (2019)必修 第一册第一章 物质及其变化第二节 离子反应优秀ppt课件
展开一、离子反应二、离子方程式的书写原则三、离子方程式正误判断(6步)
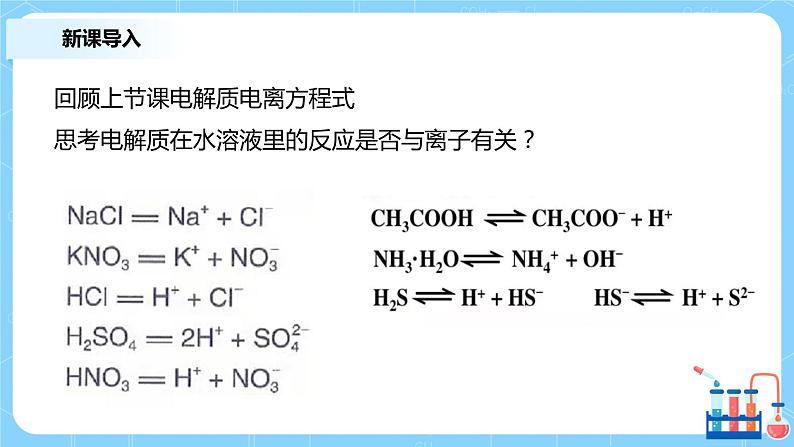
回顾上节课电解质电离方程式思考电解质在水溶液里的反应是否与离子有关?
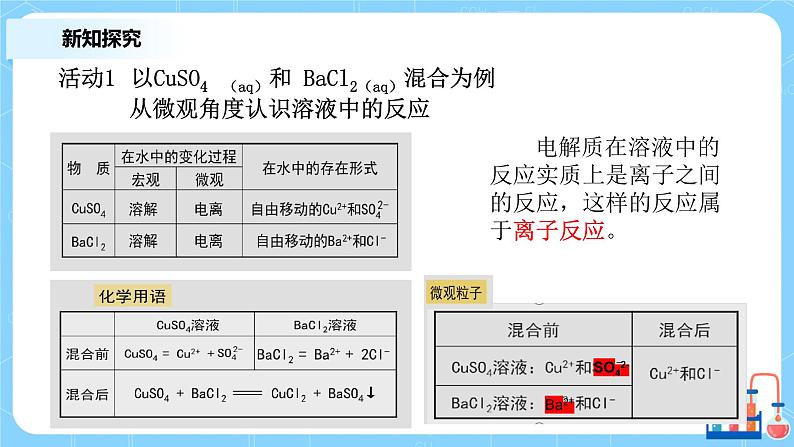
活动1 以CuSO4 (aq)和 BaCl2(aq)混合为例 从微观角度认识溶液中的反应
电解质在溶液中的反应实质上是离子之间的反应,这样的反应属于离子反应。
从微观角度看,其实质是: Ba2+ + SO42- = BaSO4↓
用实际参与反应的离子符号,来表示反应的式子叫做离子反应方程式。
活动2 分析 稀H2SO4 和 Ba(OH)2(aq)反应的实质
请写出稀H2SO4 和 Ba(OH)2(aq)的离子方程式?
活动3 判断以下溶液混合后能否反应,能的写出离子方程式
离子方程式不仅可以表示某个具体的化学反应,还可以表示同一类型的离子反应。
活动4 离子方程式正误判断
一、是否符合反应的客观事实。 (1)反应本身是否会发生,生成物是否正确。。(2)强电解质用“ ” 弱电解质以及盐类的水解用“ ”
二、是否符合拆写原则。(1)只拆分易溶于水且易电离的强酸、强碱、盐类。 特殊的盐Fe(SCN)₃不拆分。(2)微溶物:若处于浑浊状态要写成分子式,澄清状态改写成离子 形式。但在生成物中一般不能拆。 (3)多元弱酸的酸式酸根离子不可拆开,如HCO3-、HS⁻等。(4)单质、气体和氧化物在溶液中亦要保留分子式。(5)浓H2SO4不能拆分,但浓盐酸、浓硝酸可以拆分。
部 分酸、碱、盐的溶解性表
三、是否符合电荷守恒、质量守恒。 四、是否漏离子。 如:CuSO4 和Ba(OH)2的反应,生成物除了BaSO4 ,还有Cu(OH)2五、是否符合阴、阳离子配比。 如:稀硫酸和Ba(OH)2的反应。 H++SO42−+Ba2++OH−=BaSO4↓+H2O ( × ) 其错在约简离子方程式的局部化学计量数;当由化学方程式改写成离子方程式时,若只有局部公约数是不能约简的。 故正确离子方程式为:2H++SO42−+Ba2++2OH−=BaSO4↓+2H2O
六、看用量的多少来确定方程式化学计量数 如:Ca(HCO3)2溶液与过量NaOH溶液反应为: Ca2++ HCO3−+ OH− = CaCO3↓+ H2O ( × ) 由于NaOH溶液为过量,HCO3−转变成的CO32-中有一部分未能形成CaCO3沉淀,故在产物中还有CO32-存在。正确离子方程式为: Ca2++ 2HCO3− + 2OH−(过量)= CaCO3↓+ CO32- + 2H2O ( √ )注: Ca(HCO3)2溶液与少量NaOH溶液反应的离子方程式为: Ca2++ HCO3− + OH−(少量)= CaCO3↓+ H2O ( √ )
一、完成课本[ 实验1-3的表格 ]二、完成课本[思考与讨论]表格
一、概念:离子反应 、离子方程式二、离子方程式的书写三、离子方程式正误判断
请思考:离子间在什么情况下不能同时存在?
化学必修 第一册第一章 物质及其变化第二节 离子反应获奖ppt课件: 这是一份化学必修 第一册第一章 物质及其变化第二节 离子反应获奖ppt课件,共46页。PPT课件主要包含了复分解反应的条件,离子方程式正误判断,复分解反应发生的条件,离子方程式类型,离子方程式的改写,还有什么疑问,课堂小结,三条件等内容,欢迎下载使用。
高中化学人教版 (2019)必修 第一册第二节 离子反应精品ppt课件: 这是一份高中化学人教版 (2019)必修 第一册第二节 离子反应精品ppt课件,共25页。PPT课件主要包含了物质及其变化,学习目标,离子方程式,写出正确的化学方程式,Ca2+,Cl-,Na+,CO32-,CaCO3↓,检查二守恒等内容,欢迎下载使用。
化学必修 第一册第二节 离子反应精品课件ppt: 这是一份化学必修 第一册第二节 离子反应精品课件ppt,文件包含12《离子反应》第三课时课件pptx、12《离子反应》第三课时练习docx、常见阳离子和阴离子的检验知识点docx、12《离子反应》第三课时教案docx等4份课件配套教学资源,其中PPT共24页, 欢迎下载使用。














