

人教版 (2019)必修 第一册第四章 物质结构 元素周期律第三节 化学键练习题
展开
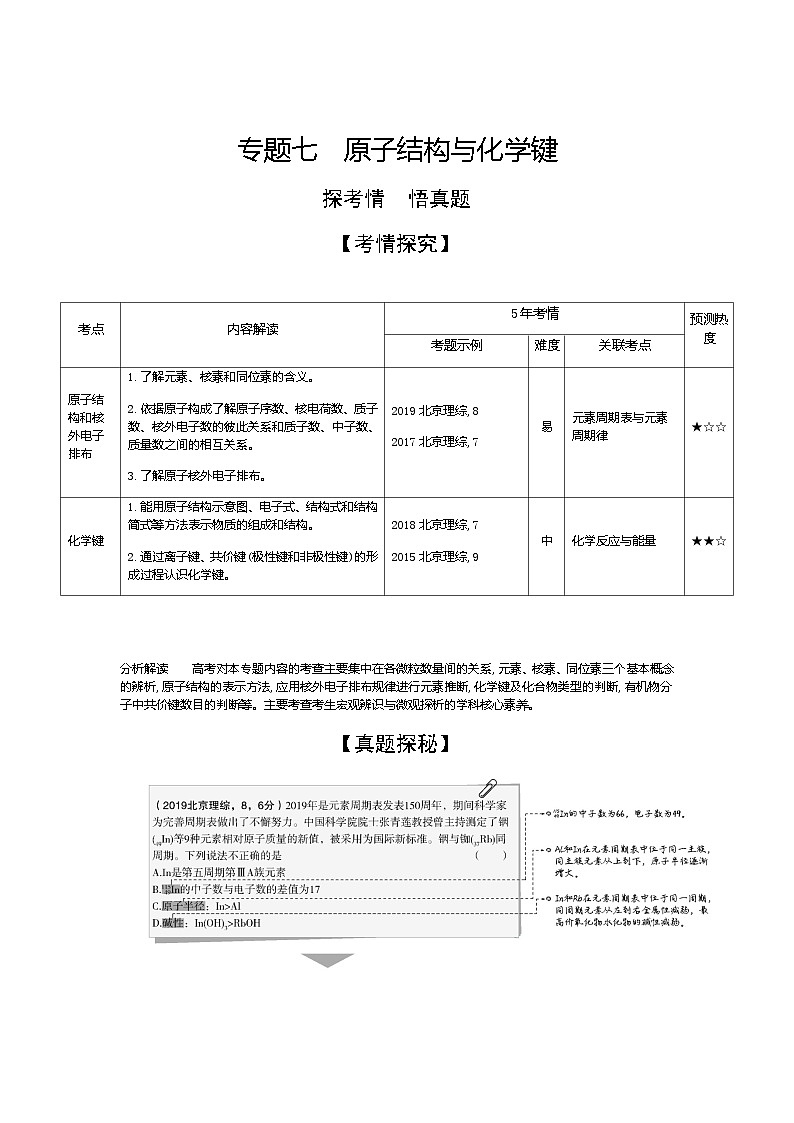
专题七 原子结构与化学键
探考情 悟真题
【考情探究】
考点
内容解读
5年考情
预测热度
考题示例
难度
关联考点
原子结构和核外电子排布
1.了解元素、核素和同位素的含义。
2.依据原子构成了解原子序数、核电荷数、质子数、核外电子数的彼此关系和质子数、中子数、质量数之间的相互关系。
3.了解原子核外电子排布。
2019北京理综,8
2017北京理综,7
易
元素周期表与元素周期律
★☆☆
化学键
1.能用原子结构示意图、电子式、结构式和结构简式等方法表示物质的组成和结构。
2.通过离子键、共价键(极性键和非极性键)的形成过程认识化学键。
2018北京理综,7
2015北京理综,9
中
化学反应与能量
★★☆
分析解读 高考对本专题内容的考查主要集中在各微粒数量间的关系,元素、核素、同位素三个基本概念的辨析,原子结构的表示方法,应用核外电子排布规律进行元素推断,化学键及化合物类型的判断,有机物分子中共价键数目的判断等。主要考查考生宏观辨识与微观探析的学科核心素养。
【真题探秘】
破考点 练考向
【考点集训】
考点一 原子结构和核外电子排布
1.(2018北京海淀二模,7)Lv(中文名“”,lì)是元素周期表第116号元素,Lv的原子核外最外层电子数是6。下列说法中不正确的是( )
A.Lv的原子半径比S的原子半径大
B.116293Lv的原子核内有293个中子
C.Lv位于元素周期表第七周期第ⅥA族
D.116290Lv、116291Lv、116292Lv互为同位素
答案 B
2.下列说法不正确的是( )
A.宇宙射线可使14N转变为14C,14C和14N互为同位素
B.13C60和碳纳米管互为同素异形体
C.2015年12月30日,国际纯粹与应用化学联合会宣布元素周期表第7周期已填补完整,在核素 118297Og中,电子数比中子数少61
D.CH4和C2H6互为同系物,乙醇和二甲醚(CH3—O—CH3)互为同分异构体
答案 A
3.下列有关化学用语表示正确的是( )
A.中子数为10的氧原子:810O
B.Mg2+的结构示意图:
C.硫化钠的电子式:Na··S······Na
D.甲酸甲酯的结构简式:C2H4O2
答案 B
考点二 化学键
4.下列过程中,共价键被破坏的是( )
①碘升华 ②溴蒸气被木炭吸附 ③酒精溶于水 ④HCl气体溶于水 ⑤冰融化 ⑥NH4Cl受热分解 ⑦氢氧化钠熔化
⑧(NH4)2SO4溶于水
A.④⑥ B.④⑥⑧ C.①②④⑤ D.①④⑥⑦
答案 A
5.(2018北京海淀二模,9)三氟化氮(NF3)常用于微电子工业,可用以下反应制备:4NH3+3F2 NF3+3NH4F。下列说法中正确的是( )
A.NF3的电子式为F∶N··F ··∶F
B.NH4F中仅含离子键
C.在制备NF3的反应中,NH3表现出还原性
D.在制备NF3的反应中,各物质均为共价化合物
答案 C
6.在NH3和NH4Cl存在条件下,以活性炭为催化剂,用H2O2氧化CoCl2溶液来制备化工产品[Co(NH3)6]Cl3,下列表述正确的是( )
A.中子数为32,质子数为27的钴原子:2732Co
B.H2O2的电子式:H+[∶O····∶O····∶]2-H+
C.NH3和NH4Cl化学键类型相同
D.[Co(NH3)6]Cl3中Co的化合价是+3
答案 D
炼技法 提能力
【方法集训】
方法 电子式的书写
1.(2019北京丰台期末,2)下列化学用语表述不正确的是( )
A.Cl2电子式:∶Cl····∶Cl····∶
B.Na原子结构示意图:
C.NaCl在水中电离:NaCl Na++Cl-
D.由Na和Cl形成离子键的过程:
答案 C
2.下列有关化学用语表示正确的是( )
A.原子结构示意图只能表示12C,不能表示14C
B.次氯酸的结构式:H—Cl—O
C.NH4Cl的电子式:[H∶N··HH··∶H]+Cl-
D.间硝基甲苯的结构简式:
答案 D
【五年高考】
考点一 原子结构和核外电子排布
A组 自主命题·北京卷题组
1.(2011北京理综,25,12分)在温度t1和t2下,X2(g)和H2反应生成HX的平衡常数如下表:
化学方程式
K(t1)
K(t2)
F2+H2 2HF
1.8×1036
1.9×1032
Cl2+H2 2HCl
9.7×1012
4.2×1011
Br2+H2 2HBr
5.6×107
9.3×106
I2+H2 2HI
43
34
(1)已知t2>t1,HX的生成反应是_______反应(填“吸热”或“放热”)。
(2)HX的电子式是___________。
(3)共价键的极性随共用电子对偏移程度的增大而增强,HX共价键的极性由强到弱的顺序是_________。
(4)X2都能与H2反应生成HX,用原子结构解释原因:_________________________________。
(5)K的变化体现出X2化学性质的递变性,用原子结构解释原因:_______________________,原子半径逐渐增大,得电子能力逐渐减弱。
(6)仅依据K的变化,可以推断出:随着卤素原子核电荷数的增加,___________(选填字母)。
a.在相同条件下,平衡时X2的转化率逐渐降低
b.X2与H2反应的剧烈程度逐渐减弱
c.HX的还原性逐渐减弱
d.HX的稳定性逐渐减弱
答案 (1)放热
(2)H∶X····∶
(3)HF、HCl、HBr、HI
(4)卤素原子的最外层电子数均为7
(5)同一主族元素从上到下原子核外电子层数依次增多
(6)ad
B组 统一命题、省(区、市)卷题组
2.(2018江苏单科,2,2分)用化学用语表示NH3+HCl NH4Cl 中的相关微粒,其中正确的是( )
A.中子数为8 的氮原子:78N
B.HCl 的电子式:H+[∶Cl····∶]-
C.NH3的结构式:
D.Cl-的结构示意图:
答案 C
3.(2018课标Ⅲ,8,6分)下列叙述正确的是( )
A.24 g镁与27 g铝中,含有相同的质子数
B.同等质量的氧气和臭氧中,电子数相同
C.1 mol重水与1 mol水中,中子数比为2∶1
D.1 mol乙烷和1 mol乙烯中,化学键数相同
答案 B
4.(2017江苏单科,2,2分)下列有关化学用语表示正确的是( )
A.质量数为31的磷原子:1531P
B.氟原子的结构示意图:
C.CaCl2的电子式:Ca2+[∶Cl····∶]2-
D.明矾的化学式:Al2(SO4)3
答案 A
5.(2015课标Ⅰ,12,6分)W、X、Y、Z均为短周期主族元素,原子序数依次增加,且原子核外L电子层的电子数分别为0、5、8、8,它们的最外层电子数之和为18。下列说法正确的是( )
A.单质的沸点:W>X
B.阴离子的还原性:W>Z
C.氧化物的水化物的酸性:Y
答案 B
考点二 化学键
A组 自主命题·北京卷题组
1.(2018北京理综,7,6分)我国科研人员提出了由CO2和CH4转化为高附加值产品CH3COOH的催化反应历程。该历程示意图如下。
下列说法不正确的是( )
A.生成CH3COOH总反应的原子利用率为100%
B.CH4→CH3COOH过程中,有C—H键发生断裂
C.①→②放出能量并形成了C—C键
D.该催化剂可有效提高反应物的平衡转化率
答案 D
B组 统一命题、省(区、市)卷题组
2.(2019课标Ⅰ,13,6分)科学家合成出了一种新化合物(如图所示),其中W、X、Y、Z为同一短周期元素,Z核外最外层电子数是X核外电子数的一半。下列叙述正确的是( )
A.WZ的水溶液呈碱性
B.元素非金属性的顺序为X>Y>Z
C.Y的最高价氧化物的水化物是中强酸
D.该新化合物中Y不满足8电子稳定结构
答案 C
3.(2018课标Ⅱ,10,6分)W、X、Y和Z为原子序数依次增大的四种短周期元素。W与X可生成一种红棕色有刺激性气味的气体;Y的周期数是族序数的3倍;Z原子最外层的电子数与W的电子总数相同。下列叙述正确的是( )
A.X与其他三种元素均可形成两种或两种以上的二元化合物
B.Y与其他三种元素分别形成的化合物中只含有离子键
C.四种元素的简单离子具有相同的电子层结构
D.W的氧化物对应的水化物均为强酸
答案 A
4.(2016浙江理综,9,6分)短周期主族元素X、Y、Z、W的原子序数依次增大,X原子核外最外层电子数是其电子层数的2倍,X、Y的核电荷数之比为3∶4。W-的最外层为8电子结构。金属单质Z在空气中燃烧生成的化合物可与水发生氧化还原反应。下列说法正确的是( )
A.X与Y能形成多种化合物,一般条件下都能与Z的最高价氧化物的水化物发生反应
B.原子半径大小:X
C.化合物Z2Y和ZWY3都只存在离子键
D.Y、W的某些单质或两元素之间形成的某些化合物可作水的消毒剂
答案 D
5.(2015重庆理综,8,15分)某汽车安全气囊的产气药剂主要含有NaN3、Fe2O3、KClO4、NaHCO3等物质。当汽车发生碰撞时,产气药剂产生大量气体使气囊迅速膨胀,从而起到保护作用。
(1)NaN3是气体发生剂,受热分解产生N2和Na,N2的电子式为________。
(2)Fe2O3是主氧化剂,与Na反应生成的还原产物为________(已知该反应为置换反应)。
(3)KClO4是助氧化剂,反应过程中与Na作用生成KCl和Na2O。KClO4含有化学键的类型为______________,K的原子结构示意图为________________。
(4)NaHCO3是冷却剂,吸收产气过程中释放的热量而发生分解,其化学方程式为_______________________-。
(5)100 g上述产气药剂产生的气体通过碱石灰后得到N2 33.6 L(标准状况)。
①用碱石灰除去的物质为_______________________________;
②该产气药剂中NaN3的质量分数为__________。
答案 (1)∶N⋮⋮N∶ (2)Fe
(3)离子键和共价键
(4)2NaHCO3 Na2CO3+CO2↑+H2O
(5)①CO2、H2O ②65%
【三年模拟】
时间:45分钟 分值:100分
一、选择题(每题6分,共48分)
1.(2020届北京海淀期中,3)下列关于铝及含铝物质的说法正确的是( )
A.27Al的中子数为13
B.单质铝可用作半导体材料
C.原子半径r(Si)>r(Al)
D.Al(OH)3能与NaOH溶液反应
答案 D
2.(2020届北京朝阳期中,9)2019年科学家们合成了具有半导体特性的环状C18分子,其合成方法的示意图如下:
下列说法不正确的是( )
A.C与O同属第二周期元素,原子半径C>O
B.非金属性C
D.C18与C60、金刚石互为同位素
答案 D
3.(2020届北京朝阳期中,2)过氧化钠可用于呼吸面罩中作为氧气的来源,可发生反应2Na2O2+2H2O O2↑+4NaOH、 2Na2O2+2CO2 O2+2Na2CO3。下列表示相关微粒的化学用语正确的是( )
A.Na2O2中的阴离子符号:O2-
B.NaOH的电子式:Na+[∶O····∶H]-
C.Na+的结构示意图:
D.CO2的结构式:O—C—O
答案 B
4.(2019北京海淀期末,5)114号元素为Fl(中文名“鈇”),它是主族元素,其原子核外最外层电子数是4。下列说法不正确的是 ( )
A.Fl的原子核外有114个电子
B.Fl是第七周期第ⅣA族元素
C.Fl在同主族元素中金属性最强
D.Fl的原子半径小于同主族其他元素
答案 D
5.(2019北京海淀二模,9)下列化学用语的表述正确的是( )
A.钢铁吸氧腐蚀中的正极反应:4OH--4e- 2H2O+O2↑
B.由Na和Cl形成离子键的过程:
C.NaHCO3的水解平衡:HCO3-+H2O H3O++CO32-
D.实验室制乙炔的反应:CaC2+H2O CaO+C2H2↑
答案 B
6.(2019北京海淀期末,13)H2O2是一种“绿色”试剂,许多物质都会使较高浓度的H2O2溶液发生催化分解。实验发现,向H2O2溶液中加入Br2可以加快其分解速率。有人提出反应机理可能有2步,第1步反应为H2O2+Br2 2H++O2↑+2Br-。下列说法正确的是( )
A.H2O2分子中含有离子键和非极性键
B.在第1步反应中,每生成0.1 mol O2,转移0.4 mol电子
C.反应机理中第2步反应为2H++H2O2+2Br- 2H2O+Br2
D.若在加入Br2的H2O2溶液中检出Br-,则说明第1步反应发生了
答案 C
7.(2019北京朝阳二模,9)氮及其化合物的转化过程如下图所示。
下列分析合理的是( )
A.催化剂a表面发生了极性共价键的断裂和形成
B.N2与H2反应生成NH3的原子利用率为100%
C.在催化剂b表面形成氮氧键时,不涉及电子转移
D.催化剂a、b能提高反应的平衡转化率
答案 B
8.(2019北京东城二模,9)BMO(Bi2MoO6)是一种高效光催化剂,可用于光催化降解苯酚,原理如图所示。下列说法不正确的是( )
A.该过程的总反应:C6H6O+7O2 6CO2+3H2O
B.该过程中BMO表现较强氧化性
C.降解产物的分子中只含有极性共价键
D.①和②中被降解的苯酚的物质的量之比为3∶1
答案 B
二、非选择题(共52分)
9.(2020届北京朝阳期中,15)(12分)“氮的固定”对保障人类生存具有重大意义。一种新型合成氨的原理如图所示:
(1)N2的电子式:______________。
(2)Li3N中含有的化学键类型是_____________。
(3)热稳定性:NH3____________H2O(填“>”或“<”)。
(4)NH3 、H2O分子中化学键极性更强的是______________________,从原子结构角度解释原因:_______________________________________。
(5)写出上图所示过程的总反应方程式:________________。
答案 (8分)(1)∶N⋮⋮N∶
(2)离子键
(3)<
(4)H—O N和O电子层数相同,核电荷数N
10.(2019北京东城期末,15)(15分)CO2的有效利用可以缓解温室效应和能源短缺问题。
(1)CO2的分子结构决定了其性质和用途。
①CO2的电子式是__________,所含化学键类型为____________共价键(填“非极性”或“极性”)。
②在温度高于31.26 ℃、压强高于7.29×106 Pa时,CO2处于超临界状态,称为超临界CO2流体,它可用作萃取剂提取草药中的有效成分。与用有机溶剂萃取相比,用超临界CO2萃取的优点有:___________________________________(答出一点即可)。
(2)中科院大连化学物理研究所的科研人员在新型纳米催化剂Na-Fe3O4和HMCM-22的表面将CO2转化为烷烃,其过程如下图:
①上图中CO2转化为CO的反应为CO2(g)+H2(g) CO(g)+H2O(g) ΔH=+41 kJ/mol
已知:2CO2(g)+6H2(g) C2H4(g)+4H2O(g) ΔH=-128 kJ/mol
则图中CO转化为C2H4的热化学方程式是____________________________。
②按系统命名法,图中X的名称是______________________。
③关于X与Y的说法正确的是________________________(填序号)。
a.实验式相同
b.都有4种一氯代物
c.都易使酸性KMnO4溶液褪色
④催化剂中Fe3O4的制备方法如下:将一定比例的FeCl2和FeCl3溶于盐酸,然后在60 ℃下逐滴加入NaOH溶液至pH≈10,继续搅拌,得Fe3O4。该反应的离子方程式是______________________________________。
答案 (1)①∶O··∶∶C∶∶O··∶(2分) 极性(2分) ②萃取剂与溶质更易分离(或萃取剂更环保等)(2分)
(2)①2CO(g)+4H2(g) C2H4(g)+2H2O(g) ΔH=-210 kJ/mol(3分) ②2-甲基丁烷(2分) ③b(2分) ④Fe2++2Fe3++8OH- Fe3O4↓+4H2O(2分)
11.(10分)现有部分元素的原子结构特点如表:
X
L层电子数是K层电子数的3倍
Y
核外电子层数等于原子序数
Z
L层电子数是K层和M层电子数之和
W
最外层电子数是次外层电子数的2.5倍
(1)画出W原子的结构示意图:_______________。
(2)元素X与元素Z相比,非金属性较强的是_______________(填元素名称),写出一个能表示X、Z非金属性强弱关系的化学反应方程式:__________________________。
(3)X、Y、Z、W四种元素形成的一种离子化合物,其水溶液显强酸性,该化合物的化学式为_________。
(4)元素X和元素Y以原子个数比1∶1化合形成化合物Q,元素W和元素Y化合形成化合物M,Q和M的电子总数相等。以M为燃料,Q为氧化剂,可作火箭推进剂,最终生成无毒且在自然界中稳定存在的物质,写出该反应的化学方程式:__________________________________________。
答案 (1)
(2)氧 2H2S+O2 2H2O+2S↓(其他合理答案亦可)
(3)NH4HSO4
(4)N2H4+2H2O2 N2↑+4H2O
12.(15分)氮及氮的化合物有着重要的用途。
(1)氮元素在周期表中的位置是____________;NH3的电子式是_________。
(2)将空气中游离态的氮转化为含氮化合物的过程叫氮的固定,请举例说明一种自然界中氮的固定的途径______________________________(用化学方程式表示)。
(3)工业合成氨是人工固氮的重要方法。2007年化学家格哈德·埃特尔证实了氢气与氮气在固体催化剂表面合成氨的反应过程,示意图如下:
下列说法正确的是_____(选填字母)。
a.图①表示N2、H2分子中均是单键
b.图②→图③需要吸收能量
c.该过程表示的化学变化中包含旧化学键的断裂和新化学键的生成
(4)已知:N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ/mol,
2H2(g)+O2(g) 2H2O(g) ΔH=-483.6kJ/mol,则氨气作燃料完全燃烧生成氮气和水蒸气的热化学方程式是___________________________________。
(5)用氨气作原料可制备重要燃料——肼(N2H4)。
①通常在催化剂存在下,用次氯酸钠与氨反应可制备肼。该反应的化学方程式是______________________。
②如图为肼燃料电池示意图,其负极的电极反应式是______________________________。
答案 (1)第2周期ⅤA族 H∶N··H ··∶H
(2)N2+O2 2NO
(3)bc
(4)4NH3(g)+3O2(g) 2N2(g)+6H2O(g) ΔH=-1 266 kJ/mol
(5)①2NH3+NaClO N2H4+NaCl+H2O ②N2H4-4e-+4OH- N2+4H2O
安徽省2023年高考化学模拟题汇编-15原子结构、化学键、原子结构与性质: 这是一份安徽省2023年高考化学模拟题汇编-15原子结构、化学键、原子结构与性质,共13页。试卷主要包含了单选题,有机推断题,工业流程题等内容,欢迎下载使用。
高考化学微专题小练习专练23原子结构与化学键含答案: 这是一份高考化学微专题小练习专练23原子结构与化学键含答案,共9页。试卷主要包含了下列化学用语的表述正确的是等内容,欢迎下载使用。
练案[13] 第五章 第13讲 原子结构 化学键: 这是一份练案[13] 第五章 第13讲 原子结构 化学键,共7页。













