






2024年高考化学一轮复习 第5讲 离子反应 离子方程式课件PPT
展开1.了解电解质及其分类,掌握强弱电解质的本质区别。2.理解电解质在水溶液中的电离以及电解质溶液的导电性。3.了解离子反应的概念、离子反应发生的条件,并能正确书写离子方程式。
考点一 电解质及电离
考点二 离子反应 离子方程式书写的基本方法
考点三 与量有关的离子方程式的书写
真题演练 明确考向
1.电解质及分类(1)概念在 或 能够导电的化合物,称为电解质,二者情况下均不导电的化合物称为非电解质。(2)分类
强电解质:在水溶液中__________弱电解质:在水溶液中__________
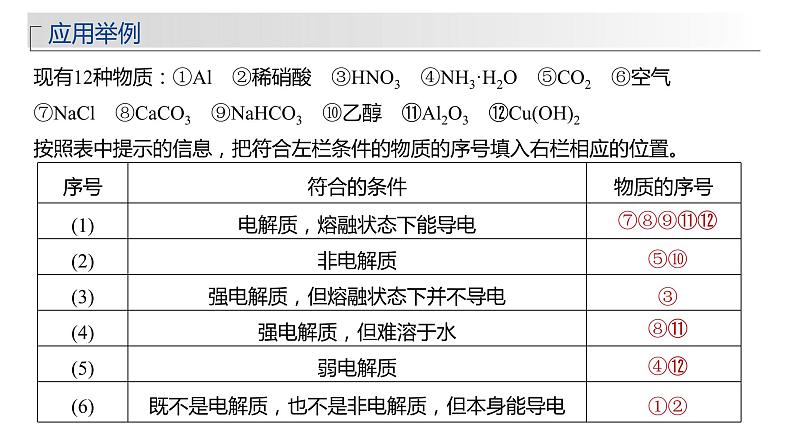
现有12种物质:①Al ②稀硝酸 ③HNO3 ④NH3·H2O ⑤CO2 ⑥空气 ⑦NaCl ⑧CaCO3 ⑨NaHCO3 ⑩乙醇 ⑪Al2O3 ⑫Cu(OH)2按照表中提示的信息,把符合左栏条件的物质的序号填入右栏相应的位置。
2.电解质的电离(1)电离:电解质溶于水或受热熔化时,形成 的过程。(2)电离方程式的书写强电解质在水溶液中完全电离,用“===”连接。弱电解质在水溶液中部分电离,用“ ”连接,多元弱酸分步电离,一般以第一步电离为主;多元弱碱,分步电离,一步完成。
按要求书写下列电解质的电离方程式:①Ba(OH)2:___________________________;②KAl(SO4)2:____________________________;③CH3COOH:___________________________;④H2CO3:______________________________________;⑤Cu(OH)2:_______________________;⑥NaHSO4溶于水:_________________________;⑦NaHSO4熔融:____________________________;⑧NaHCO3:_________________________________________。
Ba(OH)2===Ba2++2OH-
离子反应过程中溶液导电性变化的判断1.下列几种导电性变化图像,把符合要求的图像字母填在相应的题目后面的括号中。
(1)向H2SO4溶液中加入等体积、等物质的量浓度的Ba(OH)2溶液( )(2)向H2S溶液中通入Cl2直至过量( )(3)向AgNO3溶液中通入少量HCl ( )
(4)向氨水中通入HCl直至过量( )(5)向NaOH溶液中通入少量Cl2( )(6)向饱和石灰水中不断通入CO2( )
2.将等浓度的H2SO4、NaHSO4溶液,分别滴入两份相同的Ba(OH)2溶液中,其电导率与滴入溶液体积变化的曲线如图所示。下列分析正确的是A.b→d反应的离子方程式为H++OH-===H2OB.d点溶液中,Na+与 的物质的量之比为1∶1C.c点导电能力相同,所以两溶液中含有相同量的OH-D.a、b两点Ba2+均沉淀完全,所以对应的溶液均显中性
近0,说明该点溶液离子浓度最小,应该为Ba(OH)2和H2SO4的反应,则曲线②为Ba(OH)2和NaHSO4的反应。b→d反应为向NaOH溶液中继续滴加NaHSO4溶液,实际上是酸碱中和反应,离子方程式为H++OH-===H2O,故A项正确;
(1)电解质溶液的导电原理电解质电离出的阴、阳离子在外加电场的作用下,发生定向移动实现导电过程,一般情况下,自由移动离子的浓度越大,所带的电荷数越多,电解质溶液的导电能力越强。(2)同一温度下,强电解质溶液(a)、弱电解质溶液(b)、金属导体(c)的导电能力相同,若升高温度,它们的导电能力大小顺序为b>a>c。
离子反应 离子方程式书写的基本方法
1.离子反应(1)概念:有离子参加或有离子生成的反应统称为离子反应。(2)本质:离子反应的本质是溶液中某些离子的物质的量的 。(3)离子反应发生的条件①发生复分解反应:生成难溶的物质,生成难电离的物质,生成易挥发的物质。②发生氧化还原反应。③发生络合反应。
2.离子方程式(1)离子方程式:用_________________________来表示反应的式子。(2)离子方程式的意义离子方程式不仅可以表示 ,还可以表示 。3.离子方程式中物质的“拆分”(1)一般规律①能拆分写成离子形式的物质是易溶的强电解质,包括 、 、大多数_____ 。②不能拆分的物质包括单质、氧化物、弱电解质、难溶电解质、气体。
实际参加反应的离子符号
(2)微溶物的处理①微溶物作为产物视为沉淀,不拆分;②作反应物时,澄清溶液拆分为离子,浑浊液不拆分,如Ca(OH)2。(3)产物NH3·H2O的处理①不加热或稀溶液中,写成NH3·H2O。②加热或浓溶液中,写成NH3和H2O。
一、书写离子方程式,注意微粒的书写形式1.(1)完成下列反应的离子方程式,注意难溶微粒、气体、难电离微粒的书写形式。①氧化镁溶于稀硫酸 。②向AlCl3溶液中滴加过量的氨水 。③向NaHSO3溶液中加入过量NaHSO4溶液 。
MgO+2H+===H2O+Mg2+
(2)完成下列反应的离子方程式,注意微溶物质、 与碱反应的条件。①向澄清石灰水中加入稀盐酸 。②Na2SO4溶液与AgNO3溶液混合 。③铵盐溶液与强碱溶液混合加热检测 。
OH-+H+===H2O
(3)完成下列反应的离子方程式,注意单质、氧化物、浓酸的书写形式。①过氧化钠溶于水 。②用MnO2与浓盐酸共热制Cl2 。③Cl2溶于水 。④铜溶于浓硝酸 。
2Na2O2+2H2O===4Na++4OH-+O2↑
二、多重反应离子方程式的书写2.完成下列反应的离子方程式。(1)Ba(OH)2溶液与H2SO4溶液混合 。(2)Ba(OH)2溶液与(NH4)2SO4溶液混合 。(3)CuSO4溶液与Ba(OH)2溶液混合 。
Ba2++2OH-+2H++ ===BaSO4↓+2H2O
Ba2++2OH-+ ===BaSO4↓+2NH3·H2O
Cu2++ +Ba2++2OH-===Cu(OH)2↓+BaSO4↓
多重反应离子方程式书写时的注意点
两种电解质溶液混合,至少电离出两种阴离子和两种阳离子,这四种(或更多种)离子之间都能两两结合成难电离(或难溶)的物质或后续离子之间的氧化还原反应,这样的离子反应称为多重反应。在写这类反应的离子方程式时易丢失其中的一组反应。
三、信息给予型离子方程式的书写3.写出符合下列情况的离子方程式。(1)向MgSO4溶液中加入(NH4)2CO3溶液生成Mg(OH)2·MgCO3:______________________________________________________________________________________________________。(2)BaS溶液与硫酸锌溶液混合生成立德粉(ZnS·BaSO4):_________________________________________。(3)向MnCl2溶液中加入NH4HCO3生成MnCO3:_______________________________________。
2Mg2++ +H2O
===Mg(OH)2·MgCO3↓+CO2↑[或2Mg2++ +2H2O===Mg(OH)2·MgCO3↓+ ]
Zn2++Ba2++S2-+
===ZnS·BaSO4↓
===MnCO3↓+CO2↑
(4)已知PbSO4不溶于水,但可溶于醋酸铵溶液,反应方程式如下:PbSO4+2CH3COONH4===(CH3COO)2Pb+(NH4)2SO4将硫化钠溶液与醋酸铅溶液混合,可生成沉淀,写出反应的离子方程式:_________________________________________。
(CH3COO)2Pb+S2-===PbS↓+2CH3COO-
与量有关的离子方程式的书写
类型一 连续型1.反应生成的离子因又能跟剩余(过量)的反应物继续反应而跟用量有关。(1)盐酸滴入Na2CO3溶液中:①盐酸少量: ;②盐酸过量: 。(2)CO2通入NaOH溶液中:①CO2少量: ;②CO2过量: 。
+H+===
+2H+===CO2↑+H2O
(3)NaOH滴入AlCl3溶液中:①NaOH少量: ;②NaOH过量: 。(4)盐酸滴入NaAlO2溶液中:①盐酸少量: ;②盐酸过量: 。
Al3++3OH-===Al(OH)3↓
(5)Fe与稀HNO3反应:①Fe过量: ;②稀HNO3过量: 。
类型二 先后型2.一种反应物的两种或两种以上的组成离子,都能跟另一种反应物的组成离子反应,但因反应次序不同而跟用量有关,又可称为竞争型。(1)NH4HSO4溶液与NaOH溶液的反应:①NaOH不足: ;②NaOH过量: 。(2)向含有H+、Al3+、 的溶液中,逐滴加入NaOH溶液至过量,反应依次为 ; ; ; 。
H++OH-===H2O
(3)向含有OH-、 的溶液中,逐滴加入稀盐酸至过量,反应依次为 ; ; ; 。(4)向FeBr2溶液中通Cl2:①通入少量Cl2: ;②通入过量Cl2: 。
Al(OH)3+3H+===Al3++3H2O
Cl2+2Fe2+===2Fe3++2Cl-
2Fe2++4Br-+3Cl2===2Fe3++2Br2+6Cl-
类型三 配比型3.当一种反应物中有两种或两种以上组成离子参与反应时,因其组成比例不协调(一般为复盐或酸式盐),当一种组成离子恰好完全反应时,另一种组成离子不能恰好完全反应(有剩余或不足),因而跟用量有关。(1)Ca(HCO3)2溶液与NaOH溶液反应:①NaOH不足: ;②NaOH过量: 。
(2)Ba(OH)2溶液与NaHSO4溶液反应:①n[Ba(OH)2]∶n(NaHSO4)=1∶1 ,此时溶液呈 性;②n[Ba(OH)2]∶n(NaHSO4)=1∶2 ,此时溶液呈 性,若向该溶液中再加入Ba(OH)2溶液,反应为 。(3)NH4Al(SO4)2与Ba(OH)2溶液反应:①n[NH4Al(SO4)2]∶n[Ba(OH)2]=1∶1 ;②n[NH4Al(SO4)2]∶n[Ba(OH)2]=1∶2 。
“少定多变”法书写与量有关的离子方程式
先根据题给条件判断“少量物质”,以“少量物质”的离子计量数(充分反应)确定所需“过量物质”的离子数目。如向Ca(HCO3)2溶液中加入过量NaOH溶液的离子方程式的书写方法为
1.(2022·浙江6月选考,2)下列物质属于强电解质的是A.HCOOH D.C2H2
2.(2022·湖南,11改编)下列离子方程式正确的是A.Cl2通入冷的NaOH溶液:Cl2+OH-===Cl-+HClOB.用醋酸和淀粉-KI溶液检验加碘盐中的 +5I-+6H+===3I2+3H2OC.FeSO4溶液中加入H2O2产生沉淀:2Fe2++H2O2+4H2O===2Fe(OH)3↓+4H+D.NaHCO3溶液与少量的Ba(OH)2溶液混合: +Ba2++OH-===BaCO3↓+ H2O
3.完成下列离子方程式。(1)[2020·江苏,16(1)]氨水吸收SO2。向氨水中通入少量SO2,主要反应的离子方程式为___________________________________。(2)[2019·江苏,19(2)]将氨水和NH4HCO3溶液混合,可制得(NH4)2CO3溶液,其离子方程式为____________________________________。(3)(2021·江苏,13改编)室温下,用0.5 ml·L-1 Na2CO3溶液浸泡CaSO4粉末,一段时间后过滤,向滤渣中加稀醋酸,产生气泡,其离子方程式为_______________________________________________________。
CaCO3+2CH3COOH
===Ca2++CO2↑+H2O+2CH3COO-
1.目前市场上有一种专门为婴幼儿设计的电解质饮料,适合在婴幼儿感冒、发烧时快速补充体内流失的电解质成分。下列物质可用作该饮料中的电解质的是A.Fe B.葡萄糖C.MgSO4 D.CO2
2.(2023·福建月考)下列说法正确的是A.CO2的水溶液能导电,所以CO2是电解质B.BaSO4难溶于水,其水溶液的导电能力极弱,所以BaSO4的电离方程式为BaSO4C.液溴不导电,所以溴是非电解质D.强电解质溶液的导电能力不一定比弱电解质溶液的导电能力强
3.(2023·苏州模拟)某离子化合物MCl(s)在水中溶解并发生电离,该过程的微观示意图如图。已知NA为阿伏加德罗常数的值。下列相关说法正确的是A.1 ml MCl中含有NA个共用电子对B.MCl为弱电解质,在水中仅部分电离C.M+和Cl-均与水分子中的氧原子结合形成水合离子D.MCl在水作用下的溶解和电离过程是物理变化
成水合离子,Cl-带负电荷,与水分子中显正电性的氢原子结合形成水合离子,故C错误;MCl在水作用下的溶解和电离过程中没有新物质生成,是物理变化,故D正确。
4.滴有酚酞的Ba(OH)2溶液显红色,在上述溶液中分别滴加X溶液后有下列现象。下列说法不正确的是
A.实验Ⅰ中溶液红色褪去,说明发生了反应:H++OH-===H2OB.实验Ⅱ中溶液红色不变,且灯泡亮度没有明显变化,说明溶液中依然存在大量的 Na+与OH-C.实验Ⅲ中溶液红色褪去,有白色沉淀生成,灯泡逐渐变暗,说明发生了反应:Ba2++ 2OH-+2H++ ===BaSO4↓+2H2OD.将实验Ⅱ中Na2SO4溶液换成CuSO4溶液,现象与原实验Ⅱ中的现象相同
5.(2021·广东,15)宏观辨识与微观探析是化学学科核心素养之一。下列物质性质实验对应的反应方程式书写正确的是A.Na2O2放入水中:Na2O2+H2O===2NaOH+O2↑B.H2O(g)通过灼热铁粉:3H2O+2Fe===Fe2O3 + 3H2C.铜丝插入热的浓硫酸中:Cu+H2SO4 ===CuSO4 + H2↑D.SO2通入酸性KMnO4溶液中:5SO2+2H2O+ +4H++2Mn2+
6.(2021·全国乙卷,9)下列过程中的化学反应,相应的离子方程式正确的是A.用碳酸钠溶液处理水垢中的硫酸钙:B.过量铁粉加入稀硝酸中:Fe +4H++ ===Fe3++NO↑+2H2OC.硫酸铝溶液中滴加少量氢氧化钾溶液:Al3++4OH-=== +2H2OD.氯化铜溶液中通入硫化氢:Cu2++ S2-===CuS↓
11.(2022·长沙高三5月联考) 下列过程中的化学反应,相应的离子方程式正确的是A.向石灰石中加入盐酸:CaCO3+2H+===Ca2++CO2↑+H2OB.利用氢氧化钠溶液吸收废气NO2:2NO2+2OH-=== +H2OC.向硫酸镁溶液中滴加氢氧化钡溶液:Mg2++2OH-===Mg(OH)2↓D.将ICl滴入NaOH溶液中:ICl+2OH-===I-+ClO-+H2O
12.(2022·宁夏银川一中模拟)下列离子方程式与实验对应不正确的是
13.向50 g质量分数为10.6%的Na2CO3溶液中,逐滴加入CaCl2稀溶液。测得溶液中离子的数量变化如图。请据此分析以下问题:(1)请指出以下曲线表示的离子符号:A______;C______;D________。
(2)反应的化学方程式为__________________________________。(3)当A、C曲线相交时,生成的沉淀质量为____g。
Na2CO3+CaCl2===CaCO3↓+2NaCl
14.无机化合物按照组成和性质可进行如下分类。其中②、③、⑥均由Na、K、H、N、O、S中的三种元素组成。
(1)表中★可以代表的物质类别为__________________________。
氧化物(或酸性氧化物)
无机物分为酸、碱、盐、氧化物,表中★可以代表的物质类别是氧化物或酸性氧化物。
(2)③水溶液呈碱性,写出电离方程式:_______________________________________(写一种即可)。
NaOH===Na++OH-(或KOH===K++OH-)
(3)②与④在水溶液中发生反应的离子方程式:_________________ (无沉淀生成)。
(4)④与少量的⑦在水溶液中发生反应的离子方程式:___________________________________________。
Ba2++2OH-+CO2===
(5)④与⑥在水溶液中发生反应的离子方程式:___________________________________________________________________________________。
===BaSO4↓、HS-+OH-===H2O+S2-(合理即可)
15.请按要求书写下列离子方程式:(1)向Ba(HCO3)2溶液中滴入NaHSO4溶液,至沉淀完全,写出反应的离子方程式:_____________________________________________。在上述溶液中继续滴入NaHSO4溶液,此时离子方程式为_________________________。(2)0.2 ml·L-1的NH4Al(SO4)2溶液与0.3 ml·L-1的Ba(OH)2溶液等体积混合:___________________________________________________。(3)AlCl3溶液与烧碱溶液反应,当n(OH-)∶n(Al3+)=7∶2时:___________________________________________。(4)CuCl2溶液与NaHS溶液反应,当n(CuCl2)∶n(NaHS)=1∶2时:_____________________________。
2Al3++7OH-===
Al(OH)3↓+ +2H2O
Cu2++2HS-===
(5)标准状况下,2.24 L CO2通入250 mL 0.5 ml·L-1的NaOH溶液中:____________________________________。(6)100 mL 0.1 ml·L-1的Na2CO3溶液中加入0.01 ml CH3COOH:_______________________________________。(7)4 ml·L-1的NaAlO2溶液和7 ml·L-1的盐酸等体积均匀混合:________________________________________。
+CH3COOH
+7H++
H2O===3Al(OH)3↓+Al3+
第02讲 离子反应 离子方程式-2024年高考化学一轮复习高频考点精讲(新教材新高考)课件PPT: 这是一份第02讲 离子反应 离子方程式-2024年高考化学一轮复习高频考点精讲(新教材新高考)课件PPT,共51页。PPT课件主要包含了复习目标,电解质及其电离,考点一,必备知识,专项突破,考点二,考点三,解题技巧,离子方程式的正误判断,热点强化等内容,欢迎下载使用。
2024年高考化学一轮复习课件(鲁科版)第2章 第5讲 离子反应 离子方程式: 这是一份2024年高考化学一轮复习课件(鲁科版)第2章 第5讲 离子反应 离子方程式,文件包含第2章第5讲离子反应离子方程式pptx、第2章第5练离子反应离子方程式docx、第2章第5讲离子反应离子方程式docx等3份课件配套教学资源,其中PPT共60页, 欢迎下载使用。
2024年高考化学一轮总复习 第1单元 第2讲 离子反应 离子方程式 课件: 这是一份2024年高考化学一轮总复习 第1单元 第2讲 离子反应 离子方程式 课件,共60页。PPT课件主要包含了水溶液中或熔融状态下,化合物,水溶液中和熔融状态下,能全部电离,只能部分电离,自由移动的离子,溶于水,溶于水或受热熔化,全部是H+,全部是OH-等内容,欢迎下载使用。












