





高考化学一轮复习第1章物质及其变化第2讲离子反应离子方程式课件
展开1.了解电解质、强电解质、弱电解质的概念;能用电离方程式表示某些酸、碱、盐的电离。2.了解离子反应的概念、离子反应发生的条件;能正确书写离子方程式,判断离子方程式的正误。
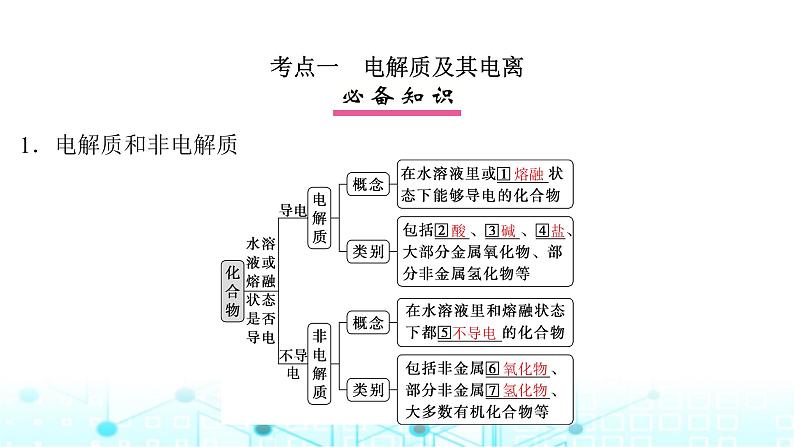
考点一 电解质及其电离
3.电解质导电的原因——电离(1)电离:电解质溶于水或受热熔化时,形成____________________的过程。(2)导电性:取决于溶液中_______________________的大小和离子所带电荷的多少。
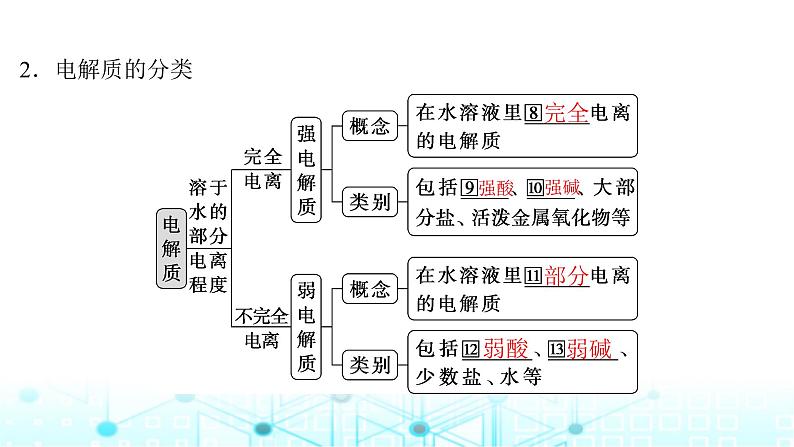
4.电离方程式的书写(1)强电解质的电离方程式中,用“________”连接,弱电解质(包括弱酸的酸式酸根)的电离方程式中,用“________”连接。(2)多元弱酸的电离分步书写,多元弱碱的电离一步完成。
[易错秒判](1)氯气溶于水得到的溶液可以导电,所以氯气是电解质( )(2)Cu、NaCl溶液均能导电,故二者都属于电解质( )(3)NH3属于非电解质,但其水溶液能够导电( )(4)CO2、SO2的水溶液都能导电,故它们属于电解质( )(5)NaCl溶液在电流的作用下电离成钠离子和氯离子( )(6)强电解质都是离子化合物,弱电解质都是共价化合物( )(7)BaSO4、CaCO3的溶解度小,溶液的导电性很弱,故它们属于弱电解质( ) 答案:(1)× (2)× (3)√ (4)× (5)× (6)× (7)×
1.现有11种物质:①Fe;②稀硫酸;③HNO3;④NH3·H2O;⑤CO2;⑥Cl2;⑦NaCl;⑧AgCl;⑨NaHCO3;⑩乙醇;⑪Al2O3。把符合左栏条件的物质的序号填入右栏相应的位置。
答案:⑦⑧⑨⑪ ③ ⑧⑪ ①②
2.按要求书写下列电解质的电离方程式。(1)HClO:__________________________________________;(2)H2CO3:________________________________________;(3)Ba(OH)2:_________________________________________;(4)Cu(OH)2:______________________________________;
(5)KAl(SO4)2:____________________________________;(6)NaHCO3:_________________________________________;(7)NaHSO4溶于水:___________________________________;(8)NaHSO4熔融:______________________________________。
3.几种导电性变化图像如下,将符合要求的图像字母填在相应的题目后面的括号中。
(1)向H2SO4溶液中加入等体积、等物质的量浓度的Ba(OH)2溶液( )(2)向H2S溶液中通入Cl2直至过量( )(3)向AgNO3溶液中通入少量HCl( )(4)向氨水中通入HCl直至过量( )(5)向NaOH溶液中通入少量Cl2( )(6)向饱和石灰水中不断通入CO2( )
答案:(1)D (2)B (3)C (4)B (5)C (6)A
考点二 离子反应和离子方程式
1.离子反应(1)概念:在溶液中有离子参加或生成的反应统称为离子反应。(2)发生条件
2.离子方程式(1)概念:用实际参加反应的离子符号来表示反应的式子。(2)意义:不仅可以表示某个具体的化学反应,还可以表示同一类型的离子反应。
(3)书写步骤(以CaCO3与HCl的反应为例)
答案:(1)√ (2)× (3)× (4)×
答案: (5)× (6)× (7)× (8)×
[名师点睛]离子方程式正误判断的“四角度”
一、书写常见反应的离子方程式1.书写下列反应的离子方程式。(1)注意难溶物质、气体、难电离物质的书写形式。①氧化铝溶于稀硫酸:______________________________。②向AlCl3溶液中滴加过量的氨水:_________________________。③向NaHSO3溶液中加入过量的NaHSO4溶液:__________________。
(2)注意单质、氧化物、浓酸的书写形式。①过氧化钠溶于水:_______________________________。②用MnO2与浓盐酸共热制Cl2:________________________________。③Cl2溶于水:___________________________________。④铜溶于浓硝酸:__________________________________。
二、信息给予型离子方程式的书写2.写出符合下列情况的离子方程式。(1)向MgSO4溶液中加入(NH4)2CO3溶液生成Mg(OH)2·MgCO3:___________________________________________________。(2)BaS溶液与硫酸锌溶液混合生成立德粉(ZnS·BaSO4):___________________________________________________。
(3)向MnCl2溶液中加入NH4HCO3生成MnCO3:___________________________________________________。(4)已知PbSO4不溶于水,但可溶于醋酸铵溶液,反应的化学方程式为2CH3COONH4+PbSO4===(CH3COO)2Pb+(NH4)2SO4。将硫化钠溶液与醋酸铅溶液混合,可生成沉淀:________________________________。
解析:因亚硫酸的酸性弱于盐酸,H2SO3溶液中滴入氯化钙溶液,不发生反应,选项D不正确。
3.(2023·新高考北京卷)下列离子方程式与所给事实不相符的是( )A.Cl2制备“84”消毒液(主要成分是NaClO):Cl2+2OH-===Cl-+ClO-+H2OB.食醋去除水垢中的CaCO3:CaCO3+2H+===Ca2++H2O+CO2↑C.利用覆铜板制作印刷电路板:2Fe3++Cu===2Fe2++Cu2+D.Na2S去除废水中的Hg2+:Hg2++S2-===HgS↓
解析:Cl2和NaOH溶液反应生成NaCl、NaClO和H2O,除了Cl2和H2O不能拆写其余均可拆写为离子形式,A项正确;食醋为弱酸,不能拆写为离子形式,B项错误;FeCl3将Cu氧化为CuCl2而自身被还原为FeCl2,C项正确;Na2S将Hg2+转化为沉淀除去,D项正确。
解析:A.碘化亚铁溶液与等物质的量的氯气,碘离子与氯气恰好完全反应:2I-+Cl2===I2+2Cl-,故A错误;
解析:HNO3具有强氧化性,能够与S2-发生氧化还原反应,A项错误;
2025届高考化学一轮总复习第1章物质及其变化第2讲离子反应离子方程式课件: 这是一份2025届高考化学一轮总复习第1章物质及其变化第2讲离子反应离子方程式课件,共36页。PPT课件主要包含了电解质和非电解质,不导电,氧化物,氢化物,电解质的分类,自由移动的离子,自由移动离子浓度,4“拆分”原则等内容,欢迎下载使用。
新教材(广西专版)高考化学一轮复习第1章物质及其变化第2讲离子反应离子方程式课件: 这是一份新教材(广西专版)高考化学一轮复习第1章物质及其变化第2讲离子反应离子方程式课件,共60页。PPT课件主要包含了内容索引,强基础增分策略,增素能精准突破,研专项前沿命题,明考向真题演练,课程标准,3发生条件,针对训练,答案A,思路指导等内容,欢迎下载使用。
2025版高考化学一轮总复习第1章化学物质及其变化第2讲离子反应和离子方程式课件: 这是一份2025版高考化学一轮总复习第1章化学物质及其变化第2讲离子反应和离子方程式课件,共60页。PPT课件主要包含了全都是H+,全都是OH-,Fe3++3OH-,H2O,Al3++3OH-,③⑤⑦,H2SO4,H2CO3,水溶液,离子符号等内容,欢迎下载使用。












