






2024年高考化学一轮总复习 第1单元 第2讲 离子反应 离子方程式 课件
展开第2讲 离子反应 离子方程式
复习目标1.了解电解质和非电解质、强电解质和弱电解质的概念。2.理解电解质在水溶液中的电离以及电解质溶液的导电性。3.了解离子反应的概念、发生的条件。4.能正确书写离子方程式,并能进行有关计算。
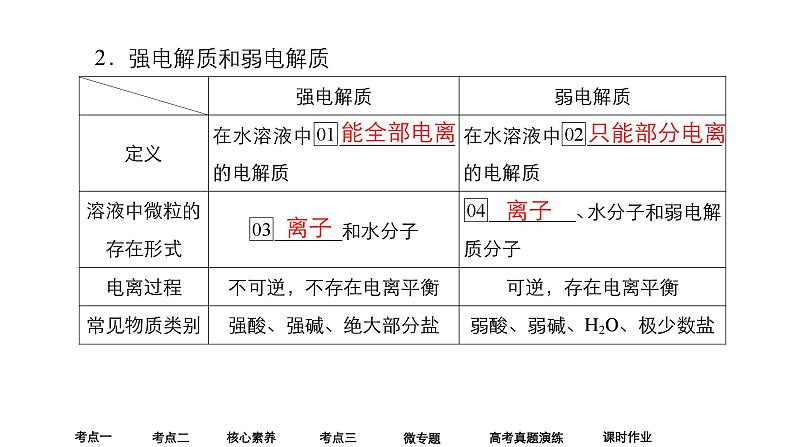
考点一 电解质及其电离
3.电解质溶液的导电性
NaOH===Na++OH-
请指出下列各说法的错因(1)NaCl溶于水时在电流的作用下电离成钠离子和氯离子。错因:_______________________________________________(2)液氯不导电,氯水导电是因为氯气与水反应生成的电解质电离而导电,故氯气是非电解质。错因:_______________________________________________(3)强电解质都是离子化合物。错因:________________________________________________
NaCl溶于水,在水分子的作用下电离成阴、阳离子。
Cl2为单质,既不属于电解质也不属于非电解质。
HCl是强电解质,但属于共价化合物。
(4)CaCO3、AgCl难溶于水,所以是弱电解质。错因:______________________________________________(5)强电解质溶液的导电性比弱电解质溶液的导电性强。错因:______________________________________________
CaCO3、AgCl溶于水的部分完全电离,属于强电解质。
导电性与离子浓度及离子所带电荷数有关。
1.关于电解质与电解质溶液导电性的几个注意点(1)电解质和非电解质都是化合物,单质和混合物既不是电解质也不是非电解质,如Cu、NaCl溶液等,所以能导电的物质不一定是电解质。(2)电解质不一定能导电,如固态NaCl、液态HCl等。(3)自身电离生成离子而导电的化合物才是电解质,而CO2、SO3、SO2、NH3的水溶液能导电,是因为它们与水反应生成的物质能电离出离子,故它们属于非电解质。
(4)电解质的强弱与其溶解性无关。如BaSO4难溶于水但却是强电解质,CH3COOH、NH3·H2O均易溶于水,但却是弱电解质。(5)溶液的导电性与电解质的强弱无关,只与溶液中自由移动离子的浓度大小及所带电荷的多少有关。强电解质溶液的导电能力不一定强,弱电解质溶液的导电能力不一定弱,如稀盐酸的导电能力弱于浓醋酸的导电能力。(6)能电离出H+的物质不一定是酸,如NaHSO4;能电离出OH-的物质不一定是碱,如Mg(OH)Cl;盐的构成不一定仅有金属阳离子和酸根离子,如铵盐。
角度一 电解质类别的判断1.下列各组关于强电解质、弱电解质、非电解质的归类,完全正确的是( )
2.下列叙述正确的是( )A.CO2溶于水部分电离,故CO2是弱电解质B.NaCl是电解质,故NaCl晶体能导电C.氯化氢溶于水能导电,但液态氯化氢不能导电D.导电性强的溶液里自由移动离子数目一定比导电性弱的溶液里自由移动离子数目多
判断电解质和非电解质、强电解质和弱电解质(1)判断电解质和非电解质的两个要点①必须是化合物;②看溶于水或受热熔化时能否自身电离出自由移动的离子而导电。(2)判断强电解质和弱电解质的两个要点①必须是电解质;②看溶于水是否完全电离。
4.写出下列物质的电离方程式:(1)HNO3:______________________________________________;(2)H2CO3:_____________________________________________;(3)NH3·H2O:___________________________________________;(4)NaCl:_______________________________________________;(5)NaHSO3:____________________________________________;(6)CH3COOH:__________________________________________。
NaCl===Na++Cl-
电离方程式书写的思维模型
考点二 离子反应 离子方程式
Fe3++3SCN-===Fe(SCN)3
实际参加反应的离子符号来表示反应
2Fe3++Cu===2Fe2++Cu2+
(2)书写步骤(以CaCO3与盐酸的反应为例)
H++OH-===H2O
Zn与浓硫酸反应产生SO2气体。
Al(OH)3溶于强碱而不溶于弱碱。
1.离子方程式中物质的“拆分”(1)一般规律①能拆分写成离子形式的物质是易溶的强电解质,包括强酸、强碱、大多数可溶性盐。②不能拆分的物质包括难溶电解质、弱电解质、气体、单质、氧化物,写成化学式。(2)微溶物的处理①微溶物作为产物视为沉淀,不拆分。②作反应物时,澄清溶液拆分为离子,浑浊液不拆分。
角度一 离子方程式的书写1.写出下列反应的离子方程式。(1)NH4HSO4溶液与NaOH溶液反应。①NaOH不足:___________________________________________。②NaOH过量:___________________________________________。(2)向FeBr2溶液中通入Cl2。①Cl2少量:______________________________________________。②FeBr2与Cl2等物质的量:_________________________________。③Cl2足量:_____________________________________________。
2Fe2++Cl2===2Fe3++2Cl-
2Fe2++2Br-+2Cl2===2Fe3++Br2+4Cl-
2Fe2++4Br-+3Cl2===2Fe3++2Br2+6Cl-
2.完成下列反应的离子方程式。(1)Ba(OH)2溶液与H2SO4溶液混合:_______________________________________________________。(2)Ba(OH)2溶液与(NH4)2SO4溶液混合:_______________________________________________________。(3)Ca(OH)2溶液与(NH4)2CO3溶液混合:_______________________________________________________。(4)Fe2O3溶于HI溶液中:_______________________________________________________。
Fe2O3+6H++2I-===2Fe2++3H2O+I2
多重反应离子方程式书写时的注意事项(1)防止离子反应方程式出现丢失现象,如FeBr2与Cl2反应,只写了Br-与Cl2的反应,忽略Fe2+与Cl2的反应。(2)防止离子方程式各微粒比与物质组成不相符,Ba(OH)2与H2SO4反应,H+、OH-和生成物H2O的化学计量数均为2,但不能同时约去这个化学计量数。
核心素养 证据推理与模型认知——突破与量有关的离子方程式的书写
[素养要求] 能根据离子方程式的反应特点进行归类并分析,正确书写与判断离子方程式的正误,形成证据推理与模型认知的学科素养。
1.连续反应型离子方程式的书写(1)反应特点:反应生成的离子因又能与过量的反应物继续反应而导致其离子方程式与用量有关。(2)书写方法根据反应条件先分析反应物是否存在过量,再根据反应原理书写。若无过量,则发生第一步反应,若过量,则反应物发生两步反应,写离子方程式时则不必写出第一步反应的中间产物,按终态产物写离子反应方程式。如多元弱酸或酸酐(如CO2或SO2)与强碱溶液反应,若多元弱酸或酸酐少量,产物为正盐;若多元弱酸或酸酐过量,产物为酸式盐;多元弱酸正盐与强酸反应,先生成酸式盐,酸式盐再进一步与强酸反应,生成强酸盐和弱酸。
②氧化还原反应型强氧化剂遇到两种还原性离子时,应注意氧化剂是否过量,若氧化剂不足,将还原性离子按还原性强弱排序,谁强谁先反应。如将少量的Cl2通入FeBr2溶液中,离子方程式为2Fe2++Cl2===2Fe3++2Cl-;若Cl2过量,则离子方程式为2Fe2++4Br-+3Cl2===2Fe3++2Br2+6Cl-。3.配比型离子方程式的书写(1)反应特点:当一种反应物中有两种或两种以上组成离子参与反应时,因其组成比例不协调(一般为复盐或酸式盐),当一种组成离子恰好完全反应时,另一种组成离子能不能恰好完全反应(有剩余或不足)而跟用量有关。
(2)书写方法配比型离子反应按照“以少定多”的原则进行书写,即先根据题给条件判断“少量物质”,以少量物质中离子的物质的量(充分反应)确定所需“过量物质”中离子的物质的量。如向Ca(HCO3)2溶液中加入过量NaOH溶液的离子方程式的书写方法为
1.按用量要求书写下列离子方程式。(1)SO2通入NaOH溶液中:碱过量:_______________________________________________;碱不足:______________________________________________。(2)Na2CO3溶液与稀盐酸混合:盐酸不足:_____________________________________________;盐酸过量:_____________________________________________。
(3)铝盐溶液与强碱溶液反应:强碱少量:_____________________________________________;强碱过量:_____________________________________________。(4)Fe与稀硝酸反应:Fe少量:______________________________________________;Fe过量:______________________________________________。
Al3++3OH-===Al(OH)3↓
2I-+Cl2===I2+2Cl-
2Fe2++4I-+3Cl2===2Fe3++2I2+6Cl-
考点三 离子的检验与推断
若溶液中含有Mg2+,也会产生相同的实验现象。
饱和氯水会氧化KSCN,从而无法检验是否有Fe3+生成,进而不能检验Fe2+的存在,应向所得溶液中滴加少量氯水。
若溶液中含有Ag+时,加入BaCl2溶液则产生不溶于盐酸的AgCl沉淀。
加入稀盐酸,引入了Cl-。
1.常考离子的检验排“干扰”措施
2.无色溶液中离子检验的一般思路
3.离子推断的“四原则”
角度一 离子的检验1.(2022·武汉高三起点质量检测)离子检验的常用方法有三种:
2.(2022·天津滨海重点学校高三联考)下列实验现象与结论均正确的是( )
解析氯水具有强氧化性,向未知液中滴加氯水,再滴加KSCN溶液,溶液呈红色,未知液中可能含有Fe2+,故A错误;K+的焰色试验应透过蓝色钴玻璃观察,故B错误;可能为Na2S、Na2SO3的混合液,与硫酸反应生成S和SO2,D错误。
角度二 离子的推断3.(2022·天津南开区高三期末考试)某白色固体混合物由NaCl、KCl、MgSO4、CaCO3中的两种组成,进行如下实验:①混合物溶于水,得到澄清透明溶液;②做焰色试验,通过钴玻璃可观察到紫色;③向溶液中加碱,产生白色沉淀。根据实验现象可判断其组成为( )A.KCl、NaCl B.KCl、MgSO4C.KCl、CaCO3 D.MgSO4、NaCl
解析混合物溶于水,得到澄清透明溶液,则不含CaCO3;做焰色试验,通过钴玻璃可观察到紫色,可确定含有钾元素,即含有KCl;向溶液中加碱,产生白色沉淀,则应含有MgSO4,综合以上分析,混合物由KCl和MgSO4两种物质组成,故选B。
4.(2022·辽宁省大连市高三期末模拟)有一包白色粉末,由BaCl2、K2SO4、CaCO3、NaOH、CuSO4中的一种或几种组成,为了探究它的成分,进行了如下实验。下列判断正确的是( )A.白色粉末中一定不存在K2SO4、CuSO4B.白色粉末中一定存在BaCl2、CaCO3,NaOH可能存在C.白色沉淀A和白色沉淀D是同种物质D.无色滤液B呈酸性,气体C是碱性氧化物
解析由流程可知,白色固体溶于水得到无色溶液,则一定不含CuSO4,白色沉淀A与盐酸反应生成气体C,且沉淀全部溶解,则A为CaCO3,C为CO2;BaCl2与K2SO4反应生成不溶于盐酸的BaSO4沉淀,则原固体一定不能同时含有BaCl2、K2SO4;氯化钡与二氧化碳不反应,而滤液B与少量二氧化碳反应生成白色沉淀,由分析可知为BaCO3,则B中含BaCl2、NaOH。由上述分析可知,K2SO4、CuSO4一定不存在;BaCl2、CaCO3、NaOH一定存在。
三步搞定离子共存问题1.看清题目要求(1)常见要求:一定大量共存;可能大量共存;不能大量共存。(2)带附加条件的不能大量共存:因发生××反应不能大量共存;因生成沉淀不能大量共存等。
4.(2022·全国乙卷)某白色粉末样品,可能含有Na2SO4、Na2SO3、Na2S2O3和Na2CO3。取少量样品进行如下实验:①溶于水,得到无色透明溶液。②向①的溶液中滴加过量稀盐酸,溶液变浑浊,有刺激性气体逸出,离心分离。 ③取②的上层清液,向其中滴加BaCl2溶液有沉淀生成。该样品中确定存在的是( )A.Na2SO4、Na2S2O3 B.Na2SO3、Na2S2O3C.Na2SO4、Na2CO3 D.Na2SO3、Na2CO3
课时作业建议用时:40分钟
选择题(每小题只有1个选项符合题意)1.某化学兴趣小组在家中进行化学实验,按照图甲连接好线路后发现灯泡不亮,按照图乙连接好线路后发现灯泡亮,由此得出的结论正确的是( )A.NaCl是非电解质B.NaCl溶液是电解质C.NaCl是弱电解质D.NaCl在水溶液中电离出了可以自由移动的离子
2.下表中物质的分类组合完全正确的是( )
解析 氧化铁溶于HI溶液中,发生氧化还原反应,其离子方程式为Fe2O3+6H++2I-===2Fe2++I2+3H2O,故B错误。
9.(2022·吉林市高三第二次调研)下列各组离子在溶液中能大量共存,且加入(或通入)X试剂后发生反应的离子方程式书写正确的是( )
电解法制取高纯镍的原料液中含Cu(Ⅱ)(主要以Cu2+、CuCl+等形式存在)杂质,为保证高纯镍产品的纯度,电解前须将Cu(Ⅱ)除去,方法如下。(1)S-SO2除铜:向原料液中加入适量细硫粉并鼓入SO2,将Cu(Ⅱ)转化为CuS沉淀除去。①Cu2+沉淀时发生反应的离子方程式为_________________________________________________________________。
新高考化学一轮复习精品课件 第1章 第2讲 离子反应 离子方程式 (含解析): 这是一份新高考化学一轮复习精品课件 第1章 第2讲 离子反应 离子方程式 (含解析),共60页。PPT课件主要包含了电解质及电离,必备知识,应用举例,关键能力,真题演练明确考向,课时精练等内容,欢迎下载使用。
2024年高考化学一轮复习(新高考版) 第1章 第2讲 离子反应 离子方程式: 这是一份2024年高考化学一轮复习(新高考版) 第1章 第2讲 离子反应 离子方程式,文件包含2024年高考化学一轮复习新高考版第1章第2讲离子反应离子方程式pptx、2024年高考化学一轮复习新高考版第1章第2讲离子反应离子方程式docx、第1章第2讲离子反应离子方程式docx、第1章第2练离子反应离子方程式docx等4份课件配套教学资源,其中PPT共60页, 欢迎下载使用。
新高考化学一轮复习课件 第1章 第2讲 离子反应 离子方程式: 这是一份新高考化学一轮复习课件 第1章 第2讲 离子反应 离子方程式,共60页。PPT课件主要包含了高考化学一轮复习策略,离子反应离子方程式,电解质及电离,离子方程式的正误判断,真题演练明确考向,课时精练等内容,欢迎下载使用。












