

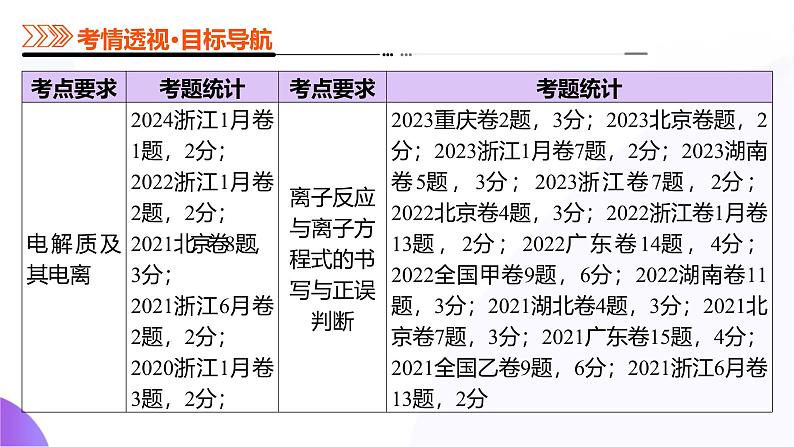




第02讲 离子反应、离子方程式(课件)-2025年高考化学一轮复习讲练测(新教材新高考)
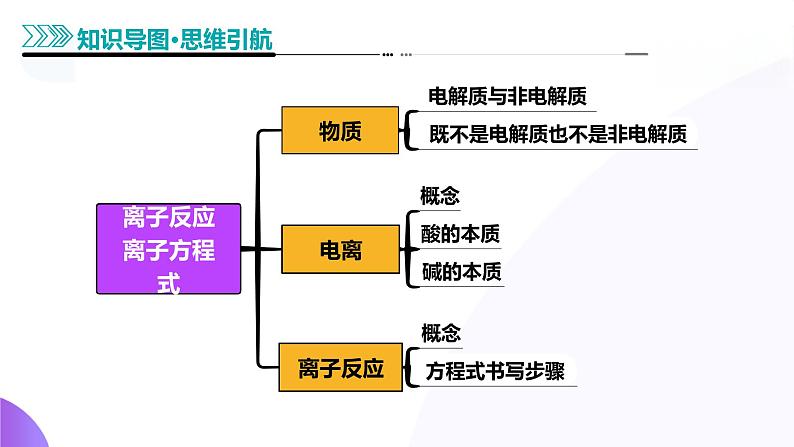
展开考向1 电解质及其电离
考向2 电解质溶液导电性分析
考向1 离子方程式的书写
考向2 离子方程式的正误判断
知识点1 电解质和非电解质
能发生电离的物质(化合物)
不能发生电离的物质(化合物)
本身不含离子 (含的是分子)
本身不含离子(含的是分子)
2.电解质与非电解质的比较
H2SO4、HCl、HNO3等
SO2、SO3、CO2、CO、P2O5等
NaOH、Ca(OH)2等
NaCl、KNO3、NaHSO4、CaCO3等
Na2O、CaO、MgO等
(1)电解质和非电解质均是化合物,单质和混合物既不是电解质,也不是非电解质
如CO2、SO2、NH3、SO3等非电解质,其与水反应生成的产物H2CO3、H2SO3、NH3⋅H2O、H2SO4自身能电离,是电解质
在溶液中能够______电离的电解质,则强电解质溶液中________电离平衡。
在溶液中只是______电离的电解质,则弱电解质溶液中______电离平衡。
知识点2 强电解质和弱电解质
注意:电解质的强弱与电解质溶液导电能力的强弱、溶解性的大小没有直接关系。如碳酸钙,其溶解性小,溶液导电性差,但其属于强电解质
3.强电解质与弱电解质的比较
H2SO4、HCl、HClO4等
Ca(OH)2、Ca(OH)2等
H2CO3、CH3COOH等
NH3⋅H2O、Cu(OH)2、Fe(OH)3等
KNO3=K++NO3-
H2SO4=2H++SO42-
NH3⋅H2O ⇌ NH4++OH-
H2S ⇌ H++HS-
HS- ⇌ H++S2-
过渡元素中常见的弱碱:Fe(OH)3、Fe(OH)2、Cu(OH)2、Zn(OH)2等
4.依据元素周期表,突破强、弱电解质的记忆
注意盐不论难溶、易溶,绝大多数都是强电解质
知识点3 电解质的电离
电解质在水溶液中或熔化状态下,离解成__________离子的过程
离子化合物溶于____或______或共价化合物溶于____
产生__________离子,具有______性
(1)强电解质:完全电离,用“_______”表示
③两性氢氧化物______电离
②多元弱碱______电离,但______写出
①多元弱酸______电离 ,且电离程度逐步______,以________电离为主
(2)弱电解质:部分电离,用“_____”表示
AlO2- + H+ + H2O
AlO2-弱酸根,在溶液中立即水解生成四羟基合铝酸根(AlO2- + 2H2O= [Al(OH)4]-)
①强酸酸式盐______电离,______写出
②多元弱酸酸式盐,第一步______电离,其余______电离
①次磷酸(H3PO2)为______弱酸,电离方程式为:______________________。
(4)特殊电解质的电离:
②硼酸(H3BO3)为______弱酸,电离方程式:____________________________。
③联氨(N2H4)为二元弱碱,在水中的电离方式与氨相似
一级电离:________________________________;
二级电离:________________________________;
(H+由水电离产生而H3BO3电离)
电解质溶液导电能力的大小取决于溶液中自由移动离子的______和离子的______
温度升高时,弱电解质电离程度______,离子浓度______,导电性会______;但强电解质溶液的导电性______。
熔融电解质或电解质溶液中的导电微粒是__________的阴、阳离子,它们在外电场作用下能产生______移动从而导电。
知识点4 电解质溶液的导电性
2.电解质溶液导电能力大小的影响因素
3.电解质导电性与导电能力强弱的判断
4.金属导电与电解质溶液导电原因对比
(1)金属导电是由于__________在电场作用下的______移动,温度高、金属阳离子振动幅度____,自由电子定向移动阻力______,金属导电性变____。
(2)电解质溶液之所以导电,是由于溶液中有自由移动的离子存在。电解质溶液导电能力的大小,决定于溶液中自由移动离子的浓度和离子的电荷数,和电解质的强弱没有必然联系。但温度升高时,弱电解质电离程度增大、离子浓度增大、导电性会增强。
①电解质溶液的导电原理:电解质电离出的阴、阳离子在外加电场的作用下,发生定向移动实现导电过程,一般情况下,自由移动离子的浓度越大,所带电荷数越多,电解质溶液的导电能力越强
②同一温度下,强电解质溶液(a)、弱电解质溶液(b)、金属导体(c)的导电能力相同,若升高温度,导电能力大小顺序为b>a>c
5.电解质电离与导电的关系
A.镁 B.NO2C.HF D.硬脂酸钠
【例1】(2024⋅浙江·二模)下列物质属于强电解质的是( )
【变式训练1】(非电解质的判断)(2024∙浙江金华·三模)下列物质属于非电解质的是( )
A.氯化铝 B.重晶石 C.氯仿 D.福尔马林
【变式训练2】(电离方程式的书写)(2024∙江苏盐城·三模)下列电离方程式书写正确的是( )
A→B:Ba(OH)2逐渐消耗,溶液中离子浓度降低
B→C:NaOH逐渐消耗
C点以后:继续加NaHCO3溶质为Na2CO3和NaHCO3
Ba2+ +OH- +HCO3- =BaCO3↓+H2O
B→C:加入的NaHCO3继续消耗OH−,C点两者恰好完全反应,因此B→C过程中,溶液中c(OH− )减小
酸或碱抑制水的电离,含有弱离子的盐水解促进水的电离,A点溶液中全部是Ba(OH)2,水的电离受到抑制,电离程度最小,B点为反应一半的点,OH−还有剩余,C点Ba(OH)2和NaHCO3恰好完全反应,因此水的电离程度:A<B<C
③络合反应:生成稳定的络合物或络合离子
④盐类的水解反应:在溶液中盐电离出的离子与水电离出的H+或OH-结合生成弱电解质
⑤电化学反应:实质为氧化还原反应,但需要添加电解或通电条件
1.概念:凡有______参加或生成的反应都是离子反应。
2.本质:溶液中某些离子的物质的量的______或粒子种类发生______。
1.概念:用实际参加反应的__________来表示离子反应的式子.所谓实际参加反应的离子,即是在反应前后数目__________的离子。
2.意义:离子方程式不仅表示一定物质间的______反应,而且可以表示______同一类型的离子反应。
知识点2 离子方程式及其书写
3.离子方程式书写步骤书写离子方程式按照“________________”的步骤书写。应注意的是,第二步“拆”是______:把易溶于水、易电离的物质拆写成离子形式,______、难电离、______、单质、________等仍用化学式表示。
1)根据离子反应的实质直接写
第4步:检查方程式两边是否符合电荷守恒和原子守恒。
2)根据化学方程式改写为离子方程式
①写:根据客观事实,写出正确的化学方程式
②拆:把易溶于水、易电离的物质拆成离子的形式
③删:删去方程式两边不参加反应的离子
④查:检查方程式两边是否符合原子守恒和电荷守恒
CaCO3+2HCl=CaCl2 + CO2↑ + H2O
CaCO3+2H++2Cl-=Ca2+ +2Cl- + CO2↑ + H2O
CaCO3+2H+=Ca2++ CO2↑ + H2O
1)书写离子方程式的注意事项
①微溶物处理方式有三种情况:生成物中写化学式作反应物处于溶液状态写离子符号作反应物处于浊液或固态时写化学式
⑥易溶、易电离的物质(可溶性强电解质,包括强酸、强碱、可溶性盐)以实际参加反应的离子符号表示;非电解质、弱电解质、难溶物、气体、单质、氧化物均用化学式表示。
⑦离子方程式要遵循质量守恒、电荷守恒,是氧化还原反应的还要遵循得失电子守恒。
2)强化记忆盐、碱溶解性
钾、钠、铵盐、硝酸盐都易溶硫酸盐不溶铅和钡盐酸盐不溶银亚汞微溶物有四种强碱都易溶,Ca(OH)2是微溶
用石灰乳制漂白粉的反应
Ca(OH)2 + Cl2 = Ca2+ + ClO-+ Cl- +H2O
Al3++3NH3∙H2O= Al(OH)3↓ + 3NH4+
浓NaOH溶液中加入硫酸铵固体并加热
铜和浓硫酸加热反应,氯化铵和氢氧化钙固体反应
1.看是否符合客观事实
【特别提醒】“客观事实”陷阱:离子反应应符合客观事实,而命题者往往设置不符合“反应原理”的陷阱
知识点3 离子方程式的正误判断——“七看”
如:Fe和稀盐酸反应的离子方程式写成2Fe+6H+=2Fe3++3H2↑是错误的,Fe和稀盐酸反应生成Fe2+
如:Fe和非氧化性酸反应应生成Fe2+,金属和氧化性酸反应不生成H2,应注意隐含反应,“=”“⇌”使用是否正确以及反应条件等
2.看化学式拆写是否正确(书写离子方程式时最关键的一步)
④非溶液状态下的反应,一般不用离子方程式表示。如实验室中制备氨气的反应
①易溶于水的强电解质均写成离子形式,如强酸、强碱和大多数盐。其他物质均用化学式表示,如单质、气体、弱电解质(弱酸、弱碱、水等)及难溶性盐
②微溶物的写法。一般来说,微溶于水的强电解质的澄清溶液(如澄清石灰水)中微溶物写成离子形式,浊液中的微溶物写成化学式
③可溶性多元弱酸的酸式酸根一律写成酸式酸根离子的形式(如HCO3-)
【特别提醒】“守恒”陷阱:离子方程式除符合质量守恒外,还应符合电荷守恒,做题时往往只注意质量守恒,而忽略电荷守恒,这也是命题者经常设置的“陷阱”
3.看符号使用是否正确。要注意“=”“⇌ ”“↓”“↑”等符号的正确使用
4.看是否遵循原子守恒、电荷守恒和得失电子守恒
如:Fe3++Cu=Fe2++Cu2+不符合电荷守恒及得失电子守恒,是错误的
5.看是否漏掉离子反应。
如:Ba(OH)2溶液与CuSO4溶液反应,既要写Ba2+与SO42-生成BaSO4沉淀的反应,又不能漏掉Cu2+与OH-生成Cu(OH)2沉淀的反应
【特别提醒】“量比”陷阱:在离子方程式正误判断中,做题时往往忽略相对量的影响,命题者往往设置“离子方程式正确,但不符合相对量”的陷阱。突破“陷阱”的方法一是审准“相对量”的多少,二是看离子反应是否符合该量。
如:向溴化亚铁溶液中通入少量Cl2的离子方程式为______________________________向溴化亚铁溶液中通入过量Cl2的离子方程式为___________________________________________________________________________
6.看反应物或产物的配比是否正确
如:稀硫酸与Ba(OH)2溶液反应,不能写成H++OH-+SO42-+ Ba2+=BaSO4↓+H2O,应写成: _______________________________________________
7.看是否符合题设条件的要求。如过量、少量、等物质的量、适量、任意量以及滴加顺序等对反应产物的影响
2Fe2++Cl2=2Fe3++ 2Cl-
2Fe2+ +4Br-+ 3Cl2=2Fe3++ 6Cl- + 2Br2
2H++2OH-+SO42-+ Ba2+=BaSO4↓+2H2O
(1)可溶性多元弱酸(或其酸酐)与碱溶液反应
(指反应生成的离子因又能跟剩余(过量)的反应物继续反应而跟用量有关)
知识点4 与“量”有关的离子方程式的书写技巧
离子方程式的书写是高考的重点和难点,特别是与用量有关的反应方程式的书写、正误的判断及其应用。解决此类问题的难点在量的关系及进行的配平
CO2 +2OH-=CO32-+ H2O
CO2 +OH-=HCO3-
(2)多元弱酸(或其酸酐)与更弱酸的盐溶液
如:CO2通入Na[Al(OH)4]溶液中,先生成碳酸盐,再生成酸式盐:
① Na[Al(OH)4]过量(CO2少量):_______________________________________
② Na[Al(OH)4]不足(CO2过量): _______________________________________
[Al(OH)4]- + CO2 = HCO3- + Al(OH)3↓
2[Al(OH)4]- + CO2 = 2Al(OH)3↓ + CO32- + H2O
(3)多元弱酸盐与强酸反应
如:Na2CO3溶液与稀盐酸,先反应生成酸式盐,然后生成二氧化碳:
①盐酸不足:_______________________
②盐酸过量:_______________________
H+ + CO32- = HCO3-
2H+ + CO32- = CO2↑ + H2O
②强酸过量:_______________________________________
①Na[Al(OH)4]过量:_______________________________________
(4)铝盐溶液与强碱溶液
如:在铝盐中滴入强碱,先生成氢氧化铝沉淀,然后溶解生成四羟基合铝酸根
①铝盐过量(NaOH少量):_______________________________________
②强碱过量(NaOH过量): _______________________________________
Al3+ + 4OH- = [Al(OH)4]-
Al3+ +3OH- = Al(OH)3↓
(5) Na[Al(OH)4]溶液与强酸溶液,在四羟基合铝酸盐中滴加强酸,先生成氢氧化铝,然后溶解,生成铝离子
[Al(OH)4]-+H+=Al(OH)3↓+H2O
[Al(OH)4]-+4H+= Al3+ +4H2O
(6)Fe与稀HNO3溶液,在硝酸中逐渐加入铁,先生成三价铁,铁过量,生成二价铁
① Fe过量:_______________________________________
② HNO3过量: _______________________________________
3Fe + 2NO3- +8H+ = 3Fe2+ + 2NO↑ + 4H2O
Fe + NO3- +4H+ = Fe3+ + NO↑ + 2H2O
2.先后型反应:一种反应物的两种或两种以上的组成离子,都能跟另一种反应物的组成离子反应,但因反应次序不同而跟用量有关。又可称为竞争型
(1)非氧化还原型的离子反应
H+ + CO32- =HCO3-
H+ + HCO3- = CO2↑ + H2O
Al(OH)3+3H+=Al3++3H2O
对于氧化还原反应,按“先强后弱”的顺序书写,即氧化性(或还原性)强的优先发生反应,氧化性(或还原性)弱的后发生反应,步骤如下:
①少量Cl2与FeI2溶液反应时只有I-与Cl2反应:_____________________
(2)氧化还原型的离子反应
第一步:确定反应的先后顺序
2I-+Cl2=I2+2Cl-
(2)“多变”就是过量的反应物,其离子的化学计量数根据反应实际需求量来确定,不受化学式中的比例制约,是可变的
3.配比型反应:当一种反应物中有两种或两种以上组成离子参与反应时,因其组成比例不协调(一般为复盐或酸式盐),当一种组成离子恰好完全反应时,另一种组成离子不能恰好完全反应(有剩余或不足)而跟用量有关
②NaHSO4溶液与Ba(OH)2溶液反应
溶液呈中性时:________________________________________________
SO42-完全沉淀时 :________________________________________________
2H+ + 2OH-+ SO42- + Ba2+ = BaSO4↓+ 2H2O
H+ + OH-+ SO42- + Ba2+ = BaSO4↓+ H2O
【例1】(2024⋅上海·模拟预测)在煤炭中加入碳酸钙可减少酸雨的形成。在研究碳酸盐分解时发现MgCO3和CaCO3的能量关系如图所示(?=??、??),??表达式为_______________________;已知
化学反应自发进行的条件:ΔG=ΔH+TΔS<0
由于ΔH>0,ΔS>0,所以要使该反应能自发进行,应在高温下进行
(1)上述反应的氧化剂是________________。
(4)基态N价层电子排布式为________。
【解析】HF分子中的F原子与另一HF分子中的H原子间可形成氢键,从而形成环状六聚体,作用力是氢键;在测定HF相对分子质量实验中,应将环状六聚体转化为单个分子,则低压有利于平衡向生成HF分子的方向移动,从而提高测定的准确性。
(3)Br与Cl以共价键形成BrCl,其中____显负电性,BrCl与水反应的方程式是__________________________
【例2】(2024⋅河北沧州·三模)电解质在水溶液中的反应属于离子反应。下列离子方程式正确的是( )
新高考化学一轮复习讲义课件 第2章 第7讲 离子反应 离子方程式: 这是一份新高考化学一轮复习讲义课件 第2章 第7讲 离子反应 离子方程式,共60页。PPT课件主要包含了复习目标,内容索引,考点一电解质及电离,知识梳理·夯基础,电解质及其分类,强电解质,弱电解质,水溶液,电解质的电离,自由移动离子等内容,欢迎下载使用。
新高考化学一轮复习课件第1章 第2讲 离子反应 离子方程式(含解析): 这是一份新高考化学一轮复习课件第1章 第2讲 离子反应 离子方程式(含解析),共60页。PPT课件主要包含了电解质及电离,必备知识,应用举例,关键能力,真题演练明确考向,课时精练等内容,欢迎下载使用。
第05讲 离子反应 离子方程式(课件)-2024年高考化学一轮复习(新教材新高考): 这是一份第05讲 离子反应 离子方程式(课件)-2024年高考化学一轮复习(新教材新高考),共60页。PPT课件主要包含了内容索引,考情分析,网络构建,PARTONE等内容,欢迎下载使用。













