









2024年高考化学一轮复习课件(鲁科版)第2章 第5讲 离子反应 离子方程式
展开第5讲 离子反应 离子方程式
[复习目标] 1.了解电解质及其分类,掌握强弱电解质的本质区别。2.理解电解质在水溶液中的电离以及电解质溶液的导电性。3.了解离子反应的概念、离子反应发生的条件,并能正确书写离子方程式。
考点一 电解质及电离
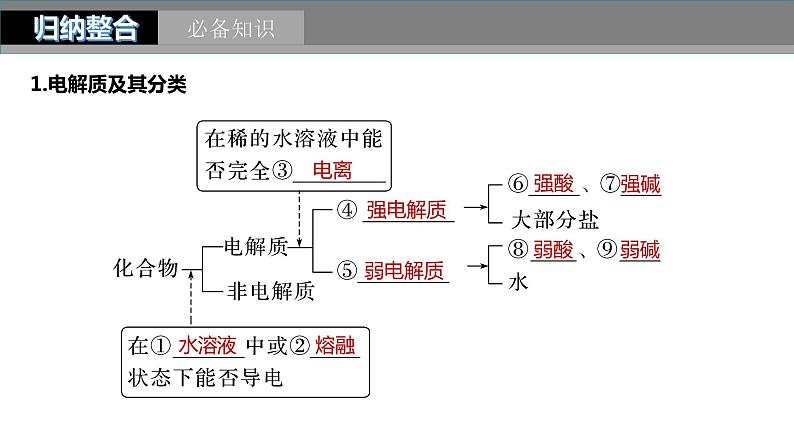
1.电解质及其分类
应用举例
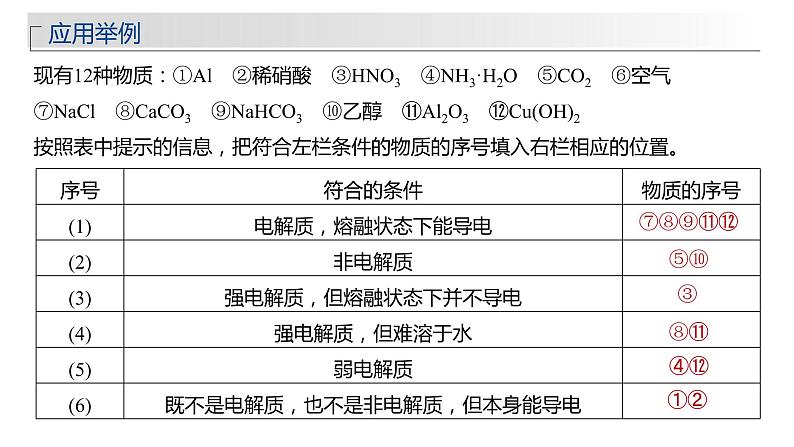
现有12种物质:①Al ②稀硝酸 ③HNO3 ④NH3·H2O ⑤CO2 ⑥空气 ⑦NaCl
⑧CaCO3 ⑨NaHCO3 ⑩乙醇 ⑪Al2O3 ⑫Cu(OH)2
按照表中提示的信息,把符合左栏条件的物质的序号填入右栏相应的位置。
序号 | 符合的条件 | 物质的序号 |
(1) | 电解质,熔融状态下能导电 |
|
(2) | 非电解质 |
|
(3) | 强电解质,但熔融状态下并不导电 |
|
(4) | 强电解质,但难溶于水 |
|
(5) | 弱电解质 |
|
(6) | 既不是电解质,也不是非电解质,但本身能导电 |
|
2.电解质的电离
(1)电离:电解质溶于水或受热熔化时,形成________________的过程。
(2)电离方程式的书写
①强电解质在水溶液中完全电离,用“===”连接。
②弱电解质在水溶液中部分电离,用“”连接,多元弱酸分步电离,一般以第一步电离为主;多元弱碱,分步电离,一步完成。
应用举例
按要求书写下列电解质的电离方程式:
①Ba(OH)2:____________________________________________________________________;
②KAl(SO4)2:___________________________________________________________________;
③CH3COOH:__________________________________________________________________;
④H2CO3:______________________________________________________________________;
⑤Cu(OH)2:____________________________________________________________________;
⑥NaHSO4溶于水:______________________________________________________________;
⑦NaHSO4熔融:________________________________________________________________;
⑧NaHCO3:____________________________________________________________________。
离子反应过程中溶液导电性变化的判断
1.下列几种导电性变化图像,把符合要求的图像字母填在相应的题目后面的括号中。
(1)向H2SO4溶液中加入等体积、等物质的量浓度的Ba(OH)2溶液( )
(2)向H2S溶液中通入Cl2直至过量( )
(3)向AgNO3溶液中通入少量HCl( )
(4)向氨水中通入HCl直至过量( )
(5)向NaOH溶液中通入少量Cl2( )
(6)向饱和石灰水中不断通入CO2( )
2.将等浓度的H2SO4、NaHSO4溶液,分别滴入两份相同的Ba(OH)2溶液中,其电导率与滴入溶液体积变化的曲线如图所示。下列分析正确的是( )
A.b→d反应的离子方程式为H++OH-===H2O
B.d点溶液中,Na+与SO的物质的量之比为1∶1
C.c点导电能力相同,所以两溶液中含有相同量的OH-
D.a、b两点Ba2+均沉淀完全,所以对应的溶液均显中性
3.电导率是衡量电解质溶液导电能力大小的物理量,根据溶液电导率变化可以确定滴定反应的终点。如图是KOH
溶液分别滴定HCl溶液和CH3COOH溶液的滴定曲线示意图。下列示意图中,能正确表示用NH3·H2O溶液滴定HCl和CH3COOH混合溶液的滴定曲线的是( )
(1)电解质溶液的导电原理
电解质电离出的阴、阳离子在外加电场的作用下,发生定向移动实现导电过程,一般情况下,自由移动离子的浓度越大,所带的电荷数越多,电解质溶液的导电能力越强。
(2)同一温度下,强电解质溶液(a)、弱电解质溶液(b)、金属导体(c)的导电能力相同,若升高温度,它们的导电能力大小顺序为b>a>c。
考点二 离子反应 离子方程式书写的基本方法
1.离子反应
(1)概念:在溶液中有离子参加的化学反应称为离子反应。
(2)本质:离子反应的本质是溶液中某些离子的物质的量的________。
(3)离子反应发生的条件
①发生复分解反应:生成难溶的物质,生成难电离的物质,生成易挥发的物质。
②发生氧化还原反应。
③发生络合反应。
2.离子方程式
(1)离子方程式:用________________________来表示反应的式子。
(2)离子方程式的意义
离子方程式不仅可以表示________________,还可以表示____________________。
3.离子方程式中物质的“拆分”
(1)一般规律
①能拆分写成离子形式的物质是易溶的强电解质,包括____________、__________、大多数____________。
②不能拆分的物质包括单质、氧化物、弱电解质、难溶电解质、气体。
(2)微溶物的处理
①微溶物作为产物视为沉淀,不拆分;
②作反应物时,澄清溶液拆分为离子,浑浊液不拆分,如Ca(OH)2。
(3)产物NH3·H2O的处理
①不加热或稀溶液中,写成NH3·H2O。
②加热或浓溶液中,写成NH3和H2O。
一、书写离子方程式,注意微粒的书写形式
1.(1)完成下列反应的离子方程式,注意难溶微粒、气体、难电离微粒的书写形式。
①氧化镁溶于稀硫酸
________________________________________________________________________。
②向AlCl3溶液中滴加过量的氨水
________________________________________________________________________。
③向NaHSO3溶液中加入过量NaHSO4溶液
________________________________________________________________________。
(2)完成下列反应的离子方程式,注意微溶物质、NH与碱反应的条件。
①向澄清石灰水中加入稀盐酸
________________________________________________________________________。
②Na2SO4溶液与AgNO3溶液混合
________________________________________________________________________。
③铵盐溶液与强碱溶液混合加热检测NH
________________________________________________________________________。
(3)完成下列反应的离子方程式,注意单质、氧化物、浓酸的书写形式。
①过氧化钠溶于水
________________________________________________________________________。
②用MnO2与浓盐酸共热制Cl2
________________________________________________________________________。
③Cl2溶于水
________________________________________________________________________。
④铜溶于浓硝酸
________________________________________________________________________。
二、多重反应离子方程式的书写
2.完成下列反应的离子方程式。
(1)Ba(OH)2溶液与H2SO4溶液混合
________________________________________________________________________。
(2)Ba(OH)2溶液与(NH4)2SO4溶液混合
________________________________________________________________________。
(3)CuSO4溶液与Ba(OH)2溶液混合
________________________________________________________________________。
多重反应离子方程式书写时的注意点
两种电解质溶液混合,至少电离出两种阴离子和两种阳离子,这四种(或更多种)离子之间都能两两结合成难电离(或难溶)的物质或后续离子之间的氧化还原反应,这样的离子反应称为多重反应。在写这类反应的离子方程式时易丢失其中的一组反应。
三、信息给予型离子方程式的书写
3.写出符合下列情况的离子方程式。
(1)向MgSO4溶液中加入(NH4)2CO3溶液生成Mg(OH)2·MgCO3:_______________________。
(2)BaS溶液与硫酸锌溶液混合生成立德粉(ZnS·BaSO4):______________________________。
(3)向MnCl2溶液中加入NH4HCO3生成MnCO3:____________________________________。
(4)已知PbSO4不溶于水,但可溶于醋酸铵溶液,反应方程式如下:PbSO4+2CH3COONH4===
(CH3COO)2Pb+(NH4)2SO4
将硫化钠溶液与醋酸铅溶液混合,可生成沉淀,写出反应的离子方程式:________________
_______________________________________________________________________________。
4.以电石渣[主要成分是Ca(OH)2,含SiO2、Al2O3以及其他少量杂质]为原料生产氯酸钾联产碳酸钙的流程如下:
回答下列问题:
(1)该流程中“复分解”反应的离子方程式:_________________________________________。
(2)该流程中碳化反应的离子方程式是______________________________________________。
考点三 与量有关的离子方程式的书写
类型一 连续型
1.反应生成的离子因又能跟剩余(过量)的反应物继续反应而跟用量有关。
(1)盐酸滴入Na2CO3溶液中:
①盐酸少量:_____________________________________________;
②盐酸过量:_____________________________________________。
(2)CO2通入NaOH溶液中:
①CO2少量:_____________________________________________;
②CO2过量:_____________________________________________。
(3)CO2通入Na[Al(OH)4]溶液中:
①CO2少量:_____________________________________________;
②CO2过量:_____________________________________________。
(4)NaOH滴入AlCl3溶液中:
①NaOH少量:___________________________________________;
②NaOH过量:___________________________________________。
(5)盐酸滴入Na[Al(OH)4]溶液中:
①盐酸少量:_____________________________________________;
②盐酸过量:____________________________________________。
(6)Fe与稀HNO3反应:
①Fe过量:______________________________________________;
②稀HNO3过量:_________________________________________。
类型二 先后型
2.一种反应物的两种或两种以上的组成离子,都能跟另一种反应物的组成离子反应,但因反应次序不同而跟用量有关,又可称为竞争型。
(1)NH4HSO4溶液与NaOH溶液的反应:
NaOH不足:___________________________________________________;
NaOH过量:___________________________________________________。
(2)向含有H+、Al3+、NH的溶液中,逐滴加入NaOH溶液至过量,反应依次为
________________________________________________________________________;
________________________________________________________________________;
________________________________________________________________________;
________________________________________________________________________。
(3)向含有OH-、CO、[Al(OH)4]-的溶液中,逐滴加入稀盐酸至过量,反应依次为
________________________________________________________________________;
________________________________________________________________________;
________________________________________________________________________;
________________________________________________________________________。
(4)向FeBr2溶液中通Cl2:
通入少量Cl2:___________________________________________________________;
通入过量Cl2:___________________________________________________________。
类型三 配比型
3.当一种反应物中有两种或两种以上组成离子参与反应时,因其组成比例不协调(一般为复盐或酸式盐),当一种组成离子恰好完全反应时,另一种组成离子不能恰好完全反应(有剩余或不足),因而跟用量有关。
(1)Ca(HCO3)2溶液与NaOH溶液反应:
①NaOH不足:____________________________________________________________;
②NaOH过量:_____________________________________________________________。
(2)NaHCO3溶液与Ca(OH)2溶液反应:
①NaHCO3不足:__________________________________________________________;
②NaHCO3过量:__________________________________________________________。
(3)Ba(OH)2溶液与NaHSO4溶液反应:
①n[Ba(OH)2]∶n(NaHSO4)=1∶1
________________________________________________________________________,
此时溶液呈____性;
②n[Ba(OH)2]∶n(NaHSO4)=1∶2
________________________________________________________________________,
此时溶液呈____性,若向该溶液中再加入Ba(OH)2溶液,反应为________________。
(4)NH4Al(SO4)2与Ba(OH)2溶液反应:
①n[NH4Al(SO4)2]∶n[Ba(OH)2]=1∶1
________________________________________________________________________;
②n[NH4Al(SO4)2]∶n[Ba(OH)2]=1∶2
________________________________________________________________________。
“少定多变”法书写与量有关的离子方程式
先根据题给条件判断“少量物质”,以“少量物质”的离子计量数(充分反应)确定所需“过量物质”的离子数目。如向Ca(HCO3)2溶液中加入过量NaOH溶液的离子方程式的书写方法为
1.(2022·浙江6月选考,2)下列物质属于强电解质的是( )
A.HCOOH B.Fe
C.Na2CO3 D.C2H2
2.(2022·全国甲卷,9)能正确表示下列反应的离子方程式为( )
A.硫化钠溶液和硝酸混合:S2-+2H+===H2S↑
B.明矾溶液与过量氨水混合:Al3++4NH3+4H2O===[Al(OH)4]-+4NH
C.硅酸钠溶液中通入二氧化碳:SiO+CO2+H2O===HSiO+HCO
D.将等物质的量浓度的Ba(OH)2和NH4HSO4溶液以体积比1∶2混合:Ba2++2OH-+2H++SO===BaSO4↓+2H2O
3.(2022·广东,14)下列关于Na的化合物之间转化反应的离子方程式书写正确的是( )
A.碱转化为酸式盐:OH-+2H++CO===HCO+2H2O
B.碱转化为两种盐:2OH-+Cl2===ClO-+Cl-+H2O
C.过氧化物转化为碱:2O+2H2O===4OH-+O2↑
D.盐转化为另一种盐:Na2SiO3+2H+===H2SiO3↓+2Na+
4.(2022·浙江6月选考,13)下列反应的离子方程式不正确的是( )
A.盐酸中滴加Na2SiO3溶液:SiO+2H+===H2SiO3↓
B.Na2CO3溶液中通入过量SO2:CO+2SO2+H2O===2HSO+CO2
C.乙醇与K2Cr2O7酸性溶液反应:3CH3CH2OH+2Cr2O+16H+―→3CH3COOH+4Cr3++11H2O
D.溴与冷的NaOH溶液反应:Br2+OH-===Br-+BrO-+H+
5.(2022·湖南,11改编)下列离子方程式正确的是( )
A.Cl2通入冷的NaOH溶液:Cl2+OH-===Cl-+HClO
B.用醋酸和淀粉-KI溶液检验加碘盐中的IO:IO+5I-+6H+===3I2+3H2O
C.FeSO4溶液中加入H2O2产生沉淀:2Fe2++H2O2+4H2O===2Fe(OH)3↓+4H+
D.NaHCO3溶液与少量的Ba(OH)2溶液混合:HCO+Ba2++OH-===BaCO3↓+H2O
新高考化学一轮复习精品课件 第1章 第2讲 离子反应 离子方程式 (含解析): 这是一份新高考化学一轮复习精品课件 第1章 第2讲 离子反应 离子方程式 (含解析),共60页。PPT课件主要包含了电解质及电离,必备知识,应用举例,关键能力,真题演练明确考向,课时精练等内容,欢迎下载使用。
2024年高考化学一轮总复习 第1单元 第2讲 离子反应 离子方程式 课件: 这是一份2024年高考化学一轮总复习 第1单元 第2讲 离子反应 离子方程式 课件,共60页。PPT课件主要包含了水溶液中或熔融状态下,化合物,水溶液中和熔融状态下,能全部电离,只能部分电离,自由移动的离子,溶于水,溶于水或受热熔化,全部是H+,全部是OH-等内容,欢迎下载使用。
2024年高考化学一轮复习 第5讲 离子反应 离子方程式课件PPT: 这是一份2024年高考化学一轮复习 第5讲 离子反应 离子方程式课件PPT,共60页。PPT课件主要包含了电解质及电离,真题演练明确考向,课时精练等内容,欢迎下载使用。












