





还剩10页未读,
继续阅读
成套系列资料,整套一键下载
人教版高中化学选择性必修1·第三章 第二节 第2课时 酸碱中和滴定(课件PPT)
展开
这是一份人教版高中化学选择性必修1·第三章 第二节 第2课时 酸碱中和滴定(课件PPT),共18页。
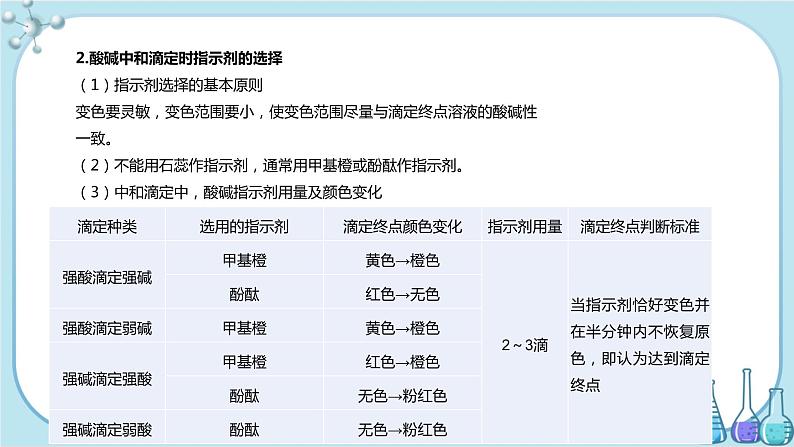
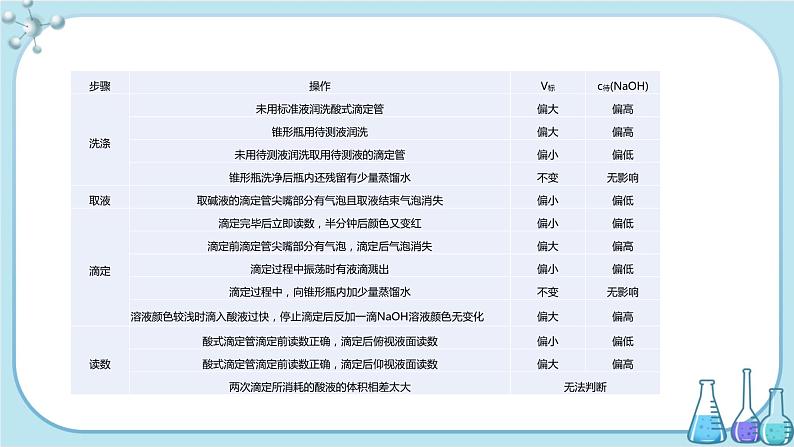
第二节 水的电离和溶液的PH高中化学 选择性必修1第三章 第2课时 酸碱中和滴定学习目标1.知道水是一种极弱的电解质,认识水的电离平衡及其影响因素。2.认识水的离子积常数,能进行溶液pH的简单计算。3.了解溶液的酸碱性与pH的关系。一、酸碱中和滴定的实验操作步骤、误差分析及拓展应用1.实验操作步骤(1)主要试剂:待测液、标准液、指示剂(一般用酚酞或甲基橙)、蒸馏水。(2)滴定操作①实验前的准备工作滴定管:锥形瓶:水洗、装待测液、加指示剂。②滴定③终点的判断当滴入最后一滴标准液,指示剂变色,且在半分钟内不恢复原来的颜色(或颜色不再变化),视为滴定终点并记录标准液的体积。④数据处理为减少实验误差,滴定时,要求重复实验2~3次,求出所用标准液体积的平均值,然后计算待测液的物质的量浓度。2.酸碱中和滴定时指示剂的选择(1)指示剂选择的基本原则变色要灵敏,变色范围要小,使变色范围尽量与滴定终点溶液的酸碱性一致。(2)不能用石蕊作指示剂,通常用甲基橙或酚酞作指示剂。(3)中和滴定中,酸碱指示剂用量及颜色变化3.酸碱中和滴定的误差分析根据计算式c待=ν ,c标是标准液的浓度,V待是待测液的体积,ν是化学方程式中待测液中溶质化学计量数与标准液中溶质化学计量数的比值,标准液滴定待测液时,c标、V待均为已知量,是定值,c待的大小取决于V标的大小,所有操作导致消耗标准液多或读数大,则结果偏高;消耗标准液少或读数小,则结果偏低。以用标准盐酸滴定一定体积的待测NaOH溶液为例,分析实验误差归纳如下表:4.氧化还原滴定的原理及应用(1)原理与酸碱中和滴定的原理相似,如果两种物质发生氧化还原反应,能够用一种方法(通常是颜色变化)确定物质间恰好反应完全的时刻,则可通过滴定实验来进行浓度测定、含量测定等定量分析。例如:酸性KMnO4溶液作氧化剂常用于滴定含H2C2O4、HC2O4-、Fe2+的溶液,其反应原理分别是:2MnO4-+5H2C2O4+6H+ =2Mn2++10CO2↑+8H2O2MnO4-+5HC2O4-+11H+ = 2Mn2++10CO2↑+8H2OMnO4-+5Fe2++8H+ = Mn2++5Fe3++4H2O又如,测定碘盐中碘含量的反应原理是:5KI+KIO3+3H2SO4 = 3K2SO4+3I2+3H2OI2+2Na2S2O3 =2NaI+Na2S4O6(2)指示剂的选择用酸性KMnO4溶液滴定H2C2O4溶液或含Fe2+溶液时,不需另加指示剂。用Na2S2O3溶液滴定含I2的溶液时,以淀粉为指示剂。(3)计算依据化学方程式或离子方程式或关系式列比例式计算,或运用得失电子守恒进行计算。(4)应用氧化还原滴定广泛地应用于溶液浓度的测定、物质纯度的测定等定量分析。例 某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液时,选择甲基橙作指示剂。请填写下列空白:(1)用标准的盐酸滴定待测的NaOH溶液时,左手握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视____________。直到加入一滴盐酸后,溶液由黄色变为橙色,并____________为止。(2)若滴定开始和结束时,酸式滴定管中的液面如图所示,则起始读数为______mL,终点读数为______mL,所用盐酸溶液的体积为______mL。(3)某同学根据3次实验分别记录有关数据见下表:依据上表数据列式计算该NaOH溶液的物质的量浓度。解析:在求c(NaOH)时应依据公式c(NaOH)= 。欲求c(NaOH),须先求V[(HCl)aq],再代入公式。(1)考查酸碱中和滴定实验的操作规范。(3)先算出耗用标准酸液的平均值: = = 26.10 mL(第二次偏差太大,舍去),再求NaOH溶液的物质的量浓度。答案:(1)锥形瓶内颜色变化 半分钟内不恢复原来的颜色 (2)0.00 26.10 26.10 (3) ==26.10 mL,c(NaOH)==0.104 4 mol/L三 实践活动——实验测定酸碱滴定曲线1.实验目的【提示】课本中的“学习用图示处理科学实验数据的方法”,即应用中和滴定数据绘制滴定曲线的方法。2.实验原理·滴定曲线的涵义前面图3-2-6中的图像就是一条滴定曲线(注意其横、纵坐标轴的意义)。它描述了酸碱滴定过程中溶液pH的变化情况。3.滴定曲线的意义滴定曲线中滴定终点附近的pH变化情况,对于酸碱滴定中如何选择合适的指示剂具有重要意义。指示剂的变色范围必须在“突变范围之内”。【注意】(1)pH计和滴定管夹都属于实验中的主要仪器。(2)c(HCl)和c(NaOH)都精确到4位有效数字。(3)实验试剂中没有酸碱指示剂。4.实验仪器使用说明(1)pH计pH计有多种型号,使用方法不尽相同,使用时参照使用说明。(2)滴定管【注意】(1)碱式滴定管上的橡胶管易被酸和强氧化剂腐蚀,故不能盛装酸性和强氧化性溶液。酸式滴定管上的玻璃活塞是做了磨砂处理的,易被碱性溶液腐蚀,故不能盛装碱性溶液。(2)酸、碱式滴定管都是玻璃管,易被氢氟酸腐蚀。(3)若滴定中用到了忌光性试剂(如HNO3溶液),可使用棕色玻璃滴定管。(4)滴定管不能用量筒代替,原因:一是量筒的精确度不够;二是量筒没有灵活地放出一定体积溶液的功能。使用方法(1)检查滴定管是否漏水(检漏)【注意】①检漏要在用蒸馏水洗净之后进行。②酸、碱式滴定管的活塞都要检漏,在确保不漏水后方可使用。(2)润洗滴定管(润洗)【注意】①润洗要在检漏之后、加入反应液之前进行。②酸、碱式滴定管都要润洗。③润洗的方法:从滴定管上口加入3~5 mL所要盛装的反应液,倾斜着转动滴定管,使液体全部润湿滴定管内壁。然后,一手控制活塞(酸式滴定管轻轻转动活塞;碱式滴定管轻轻挤压玻璃球),使液体从滴定管下部放到预置的烧杯中。④润洗的目的是除去滴定管内壁上的蒸馏水,以免反应液被稀释,所以润洗剂必须是所要盛装的反应液;滴定管的整个内壁都要润洗到;要连续润洗2~3遍。(3)加入反应液(加液)【注意】加液是为下一步操作打基础,加液的量要使液面位于滴定管刻度“0”以上2~3 mL处。(4)调节起始读数(调数)【注意】①对滴定管内的液面读数时,一要平视;二要读取与液体凹面最低点相切的那条刻度线,并精确到4位有效数字。②要将液面调到滴定管的“0”或其以下的某一刻度。③要在调液面的同时排净滴定管尖嘴内的气泡,使整个尖嘴内充满溶液。(5)放出反应液(放液)【注意】①放液的速度一定要慢,一般要控制在逐滴放出的速度。②放出溶液体积的计算方法:放液结束读取的刻度线减去调液面后读取的刻度线,即末读数减去初读数。实验操作提示·【注意】因为在滴定终点附近,加入很少量的反应液就会使pH发生很大变化,故在整个滴定过程中,测试和记录pH的间隔要“大→小→大”,即滴定开始时和达滴定终点后,间隔可稍大些;滴定终点附近,间隔要小。实验要求·【注意】绘制滴定曲线时必须应用真实的实验数据,至于它是否正确,可参考图3-2-6进行分析判断。如有错误,要分析出原因,重新进行测定。【说明】1.只要测定绘制的滴定曲线正确,据此可知酚酞和甲基橙都能较准确地指示出该酸碱滴定的终点。2.如果反过来向NaOH溶液中逐渐加入HCl溶液,所得滴定曲线的参考图如图3-2-7。3.在中和滴定中,通过酸碱指示剂来判断滴定终点的表述,一般是:当滴入某一滴反应液使指示剂发生颜色突变(见下表)时要立即停止滴加反应液,然后继续旋摇锥形瓶约半分钟并观察指示剂的颜色。如果指示剂颜色保持不变,则滴定达到了终点。谢 谢!
第二节 水的电离和溶液的PH高中化学 选择性必修1第三章 第2课时 酸碱中和滴定学习目标1.知道水是一种极弱的电解质,认识水的电离平衡及其影响因素。2.认识水的离子积常数,能进行溶液pH的简单计算。3.了解溶液的酸碱性与pH的关系。一、酸碱中和滴定的实验操作步骤、误差分析及拓展应用1.实验操作步骤(1)主要试剂:待测液、标准液、指示剂(一般用酚酞或甲基橙)、蒸馏水。(2)滴定操作①实验前的准备工作滴定管:锥形瓶:水洗、装待测液、加指示剂。②滴定③终点的判断当滴入最后一滴标准液,指示剂变色,且在半分钟内不恢复原来的颜色(或颜色不再变化),视为滴定终点并记录标准液的体积。④数据处理为减少实验误差,滴定时,要求重复实验2~3次,求出所用标准液体积的平均值,然后计算待测液的物质的量浓度。2.酸碱中和滴定时指示剂的选择(1)指示剂选择的基本原则变色要灵敏,变色范围要小,使变色范围尽量与滴定终点溶液的酸碱性一致。(2)不能用石蕊作指示剂,通常用甲基橙或酚酞作指示剂。(3)中和滴定中,酸碱指示剂用量及颜色变化3.酸碱中和滴定的误差分析根据计算式c待=ν ,c标是标准液的浓度,V待是待测液的体积,ν是化学方程式中待测液中溶质化学计量数与标准液中溶质化学计量数的比值,标准液滴定待测液时,c标、V待均为已知量,是定值,c待的大小取决于V标的大小,所有操作导致消耗标准液多或读数大,则结果偏高;消耗标准液少或读数小,则结果偏低。以用标准盐酸滴定一定体积的待测NaOH溶液为例,分析实验误差归纳如下表:4.氧化还原滴定的原理及应用(1)原理与酸碱中和滴定的原理相似,如果两种物质发生氧化还原反应,能够用一种方法(通常是颜色变化)确定物质间恰好反应完全的时刻,则可通过滴定实验来进行浓度测定、含量测定等定量分析。例如:酸性KMnO4溶液作氧化剂常用于滴定含H2C2O4、HC2O4-、Fe2+的溶液,其反应原理分别是:2MnO4-+5H2C2O4+6H+ =2Mn2++10CO2↑+8H2O2MnO4-+5HC2O4-+11H+ = 2Mn2++10CO2↑+8H2OMnO4-+5Fe2++8H+ = Mn2++5Fe3++4H2O又如,测定碘盐中碘含量的反应原理是:5KI+KIO3+3H2SO4 = 3K2SO4+3I2+3H2OI2+2Na2S2O3 =2NaI+Na2S4O6(2)指示剂的选择用酸性KMnO4溶液滴定H2C2O4溶液或含Fe2+溶液时,不需另加指示剂。用Na2S2O3溶液滴定含I2的溶液时,以淀粉为指示剂。(3)计算依据化学方程式或离子方程式或关系式列比例式计算,或运用得失电子守恒进行计算。(4)应用氧化还原滴定广泛地应用于溶液浓度的测定、物质纯度的测定等定量分析。例 某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液时,选择甲基橙作指示剂。请填写下列空白:(1)用标准的盐酸滴定待测的NaOH溶液时,左手握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视____________。直到加入一滴盐酸后,溶液由黄色变为橙色,并____________为止。(2)若滴定开始和结束时,酸式滴定管中的液面如图所示,则起始读数为______mL,终点读数为______mL,所用盐酸溶液的体积为______mL。(3)某同学根据3次实验分别记录有关数据见下表:依据上表数据列式计算该NaOH溶液的物质的量浓度。解析:在求c(NaOH)时应依据公式c(NaOH)= 。欲求c(NaOH),须先求V[(HCl)aq],再代入公式。(1)考查酸碱中和滴定实验的操作规范。(3)先算出耗用标准酸液的平均值: = = 26.10 mL(第二次偏差太大,舍去),再求NaOH溶液的物质的量浓度。答案:(1)锥形瓶内颜色变化 半分钟内不恢复原来的颜色 (2)0.00 26.10 26.10 (3) ==26.10 mL,c(NaOH)==0.104 4 mol/L三 实践活动——实验测定酸碱滴定曲线1.实验目的【提示】课本中的“学习用图示处理科学实验数据的方法”,即应用中和滴定数据绘制滴定曲线的方法。2.实验原理·滴定曲线的涵义前面图3-2-6中的图像就是一条滴定曲线(注意其横、纵坐标轴的意义)。它描述了酸碱滴定过程中溶液pH的变化情况。3.滴定曲线的意义滴定曲线中滴定终点附近的pH变化情况,对于酸碱滴定中如何选择合适的指示剂具有重要意义。指示剂的变色范围必须在“突变范围之内”。【注意】(1)pH计和滴定管夹都属于实验中的主要仪器。(2)c(HCl)和c(NaOH)都精确到4位有效数字。(3)实验试剂中没有酸碱指示剂。4.实验仪器使用说明(1)pH计pH计有多种型号,使用方法不尽相同,使用时参照使用说明。(2)滴定管【注意】(1)碱式滴定管上的橡胶管易被酸和强氧化剂腐蚀,故不能盛装酸性和强氧化性溶液。酸式滴定管上的玻璃活塞是做了磨砂处理的,易被碱性溶液腐蚀,故不能盛装碱性溶液。(2)酸、碱式滴定管都是玻璃管,易被氢氟酸腐蚀。(3)若滴定中用到了忌光性试剂(如HNO3溶液),可使用棕色玻璃滴定管。(4)滴定管不能用量筒代替,原因:一是量筒的精确度不够;二是量筒没有灵活地放出一定体积溶液的功能。使用方法(1)检查滴定管是否漏水(检漏)【注意】①检漏要在用蒸馏水洗净之后进行。②酸、碱式滴定管的活塞都要检漏,在确保不漏水后方可使用。(2)润洗滴定管(润洗)【注意】①润洗要在检漏之后、加入反应液之前进行。②酸、碱式滴定管都要润洗。③润洗的方法:从滴定管上口加入3~5 mL所要盛装的反应液,倾斜着转动滴定管,使液体全部润湿滴定管内壁。然后,一手控制活塞(酸式滴定管轻轻转动活塞;碱式滴定管轻轻挤压玻璃球),使液体从滴定管下部放到预置的烧杯中。④润洗的目的是除去滴定管内壁上的蒸馏水,以免反应液被稀释,所以润洗剂必须是所要盛装的反应液;滴定管的整个内壁都要润洗到;要连续润洗2~3遍。(3)加入反应液(加液)【注意】加液是为下一步操作打基础,加液的量要使液面位于滴定管刻度“0”以上2~3 mL处。(4)调节起始读数(调数)【注意】①对滴定管内的液面读数时,一要平视;二要读取与液体凹面最低点相切的那条刻度线,并精确到4位有效数字。②要将液面调到滴定管的“0”或其以下的某一刻度。③要在调液面的同时排净滴定管尖嘴内的气泡,使整个尖嘴内充满溶液。(5)放出反应液(放液)【注意】①放液的速度一定要慢,一般要控制在逐滴放出的速度。②放出溶液体积的计算方法:放液结束读取的刻度线减去调液面后读取的刻度线,即末读数减去初读数。实验操作提示·【注意】因为在滴定终点附近,加入很少量的反应液就会使pH发生很大变化,故在整个滴定过程中,测试和记录pH的间隔要“大→小→大”,即滴定开始时和达滴定终点后,间隔可稍大些;滴定终点附近,间隔要小。实验要求·【注意】绘制滴定曲线时必须应用真实的实验数据,至于它是否正确,可参考图3-2-6进行分析判断。如有错误,要分析出原因,重新进行测定。【说明】1.只要测定绘制的滴定曲线正确,据此可知酚酞和甲基橙都能较准确地指示出该酸碱滴定的终点。2.如果反过来向NaOH溶液中逐渐加入HCl溶液,所得滴定曲线的参考图如图3-2-7。3.在中和滴定中,通过酸碱指示剂来判断滴定终点的表述,一般是:当滴入某一滴反应液使指示剂发生颜色突变(见下表)时要立即停止滴加反应液,然后继续旋摇锥形瓶约半分钟并观察指示剂的颜色。如果指示剂颜色保持不变,则滴定达到了终点。谢 谢!
相关资料
更多









