








初中化学沪教版九年级上册第1节 构成物质的基本微粒公开课ppt课件
展开第3章 物质构成的奥秘
第1节 构成物质的基本微粒
第4课时
教学过程
导入新课
通过前面的学习我们知道,构成物质的粒子除了分子和原子外,还有离子,这节课我们就一块学习一下有关离子的知识。首先我们一起了解一下核外电子排布的相关知识。
讲授新课
【教师讲述】
五、离子
1.核外电子的分层排布
(1)电子层
在含有多个电子的原子里,有的电子在离核较近的区域运动,有的电子在离核较远的区域运动。科学家形象地将这些区域称为电子层。现在发现的元素原子核外电子层最少的有1层,最多的有7层。
(2)核外电子的分层排布
通常用电子层来形象地表示电子的运动离核远近的不同,离核越近,电子能量越低;离核越远,电子能量越高
【教师导入】
原子结构可以用原子结构示意图形象的表达。
【教师讲述】
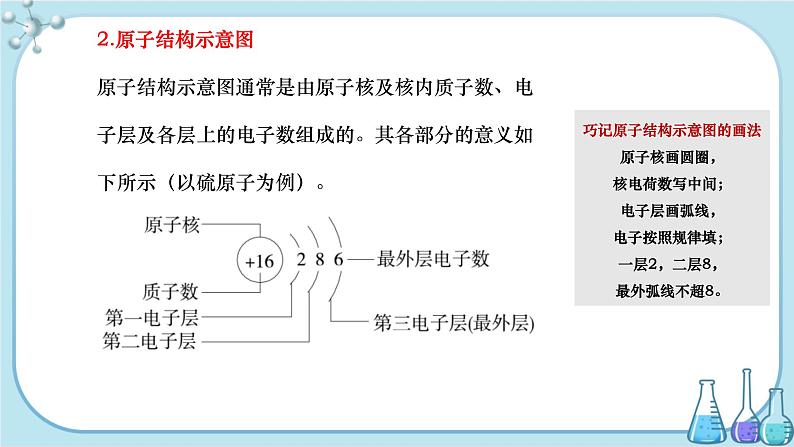
2.原子结构示意图
原子结构示意图通常是由原子核及核内质子数、电子层及各层上的电子数组成的。其各部分的意义如下所示(以硫原子为例)。
【多媒体展示】
【教师总结】
巧记原子结构示意图的画法
原子核画圆圈,
核电荷数写中间;
电子层画弧线,
电子按照规律填;
一层2,二层8,
最外弧线不超8。
【教师点拨】
核外电子排布的规律
核外电子的运动状态被人为地分成了若干个电子层,每个电子层排布的电子数是有规律的。第一层最多能容纳2个电子;第二层最多能容纳8个电子;最外层最多容纳8个电子(如果第一层为最外层,则最多容纳2个电子)。
【教师总结】
原子结构示意图是一种重要的化学用语,它能够直观、形象地表示原子内部核外电子的分层排布。由此我们可以获得许多信息,如粒子是否属于相对稳定结构、核外电子数、元素的化学性质是否活泼等。在原子中,质子数等于各电子层上的电子数之和。根据粒子中质子数与核外电子数的关系识别原子结构示意图和离子结构示意图。
【教师导入】原子得失电子后形成了带电荷的离子,那什么是离子呢?
【教师讲述】
3.离子
(1)离子的定义:原子或原子团得失电子后形成的带电荷的微粒叫做离子.如Na+、Cl-、等。
【教师点拨】
不同种原子结合在一起,作为一个整体参加化学反应,这样的原子集合称为原子团,化学上常用“根”来命名。常见的原子团有氢氧根()、硝酸根()、碳酸根()、硫酸根()、铵根()等。
【教师讲述】
(2)离子的分类
①阳离子:带正电的原子(或原子团)叫做阳离子。
特点:电子数<质子数。
示例:Na+、K+、Mg2+、Al3+。
②阴离子:带负电的原子(或原子团)叫做阴离子。
特点:电子数>质子数。
示例:O2-、S2-、 F- 、Cl-。
【多媒体展示】
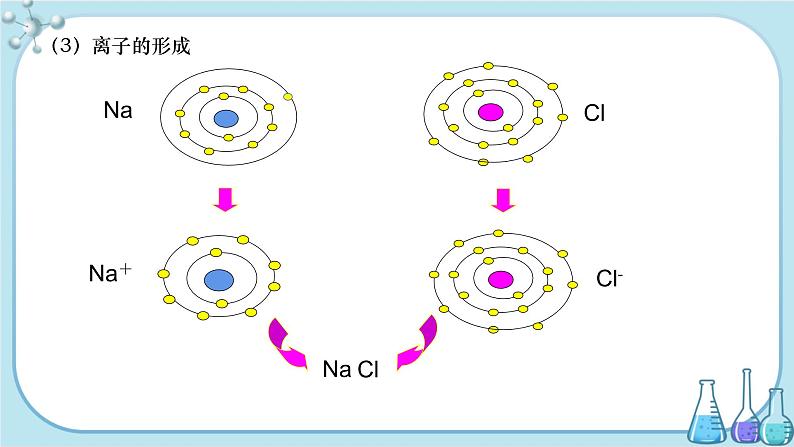
(3)离子的形成
【教师点拨】
①金属原子的最外层电子数一般小于4,在化学反应中易失去电子,使质子数大于核外电子数,所以带正电荷,为阳离子。
②非金属原子的最外层电子数一般大于4,在化学反应中易得到电子,使质子数小于核外电子数,所以带负电荷,为阴离子。
【教师讲述】
(4)离子符号
①表示方法:在元素符号或原子团的右上角标明离子所带的电荷种类和数目,数值在前,正、负号在后。当离子带1个单位的正电荷或1个单位的负电荷时,“1”省略不写。
【多媒体展示】
②常见离子的符号的写法
【教师点拨】
离子符号各部分表示的意义
【教师讲述】
(5)原子和离子的区别与联系
原子得失电子后形成离子,因此原子和离子既有区别又有联系。
粒子种类 | 原子 | 阳离子 | 阴离子 | |
区别 | 粒子结构 | 质子数=核外电子数 | 质子数>核外电子数 | 质子数<核外电子数 |
粒子电性 | 不显电性 | 显正电 | 显负电 | |
符号 | 元素符号,如Na | 阳离子符号如Na+ | 阴离子符号,如O2- | |
联系 | ||||
【教师点拨】
①微观世界中已经学习到的粒子有分子、原子、离子、质子、中子和电子。
②显电性的粒子为离子(有的显正电性,有的显负电性)、质子(显正电性)、电子(显负电性)。
③能直接构成物质的粒子为分子、原子、离子。
【教师讲述】
(6)原子、离子和分子的相互关系
原子、离子和分子在化学变化中的转化关系如下所示。
【教师总结】
原子、离子和分子都是构成物质的基本微粒。在化学反应中,原子可以通过得到或失去电子形成离子,离子也可以通过失去或得到电子形成原子。
课堂小结
本节课我们学习了离子的相关知识,离子是原子或原子团得失电子后形成的。核外电子是分层排布的,金属原子的最外层电子数一般小于4,在化学反应中易失去电子,质子数大于核外电子数,为阳离子。非金属原子的最外层电子数一般大于4,在化学反应中易得到电子,质子数小于核外电子数,为阴离子。离子的表示方法是在元素符号或原子团的右上角标明离子所带的电荷的种类和数目,数值在前,正、负号在后。当离子带1个单位的正电荷或1个单位的负电荷时,“1”省略不写。
当堂达标
1.如图所示是某元素的原子结构示意图。下列说法不正确的是( )
A.该原子的质子数为12
B.该原子的核外有三个电子层
C.该原子的核外电子数为12
D.该原子在化学反应中容易得到2个电子
答案:D
2.下列结构示意图中,表示阴离子的是( )
A B C D
答案:D
3.关于分子、原子、离子的说法,正确的是( )
A.分子的质量一定比原子大
B.原子是不能再分的粒子
C.原子得失电子后形成离子
D.分子、原子都能构成物质,离子不能
答案:C
4.某离子带3个单位的正电荷,质子数为13,该离子的核外电子数为_____,该离子的名称是______,符号是____,该离子的结构示意图是________。
答案:10 铝离子 Al3+
5.根据下边的结构图回答:
如果该图表示的是原子,X值为___,该原子的符号是____。
如果该图表示的是带两个单位正电荷的阳离子,X值为___,符号是____。
如果该图表示的是带两个单位负电荷的阴离子,X值为___,符号是____。
答案:10 Ne 12 Mg2+ 8 O2-
板书设计
第3章 物质构成的奥秘
第1节 构成物质的基本微粒
第4课时
五、离子
1.核外电子的分层排布
(1)电子层
(2)核外电子的分层排布
2.原子结构示意图
3.离子
(1)离子的定义
(2)离子的分类
(3)离子的形成
(4)离子符号
(5)原子和离子的区别与联系
(6)原子、离子和分子的相互关系
初中化学第1节 构成物质的基本微粒完美版教学ppt课件: 这是一份初中化学第1节 构成物质的基本微粒完美版教学ppt课件,文件包含31构成物质的基本微粒第4课时课件pptx、31构成物质的基本微粒第4课时练习含答案解析docx、31构成物质的基本微粒第4课时练习docx、01相对原子质量wmv等4份课件配套教学资源,其中PPT共23页, 欢迎下载使用。
化学第1节 构成物质的基本微粒优质ppt课件: 这是一份化学第1节 构成物质的基本微粒优质ppt课件,文件包含第3章第1节第3课时教学课件pptx、第3章第1节第3课时教案含练习docx等2份课件配套教学资源,其中PPT共18页, 欢迎下载使用。
沪教版第1节 构成物质的基本微粒精品ppt课件: 这是一份沪教版第1节 构成物质的基本微粒精品ppt课件,文件包含第3章第1节第2课时教学课件pptx、第3章第1节第2课时教案含练习docx等2份课件配套教学资源,其中PPT共18页, 欢迎下载使用。













