








化学九年级下册课题1 生活中常见的盐优质ppt课件
展开第2课时 复分解反应
【学习目标】
1.知道复分解反应的概念、发生的条件和实质。
2.能判断复分解反应是否能发生。
【学习重点】理解并判断复分解反应;掌握常见的碱和盐的溶解性规律,熟记常见的难溶性碱和盐。
【学习难点】复分解反应和置换反应的区别;熟练掌握难溶性物质。
【学习过程】
一、自主学习
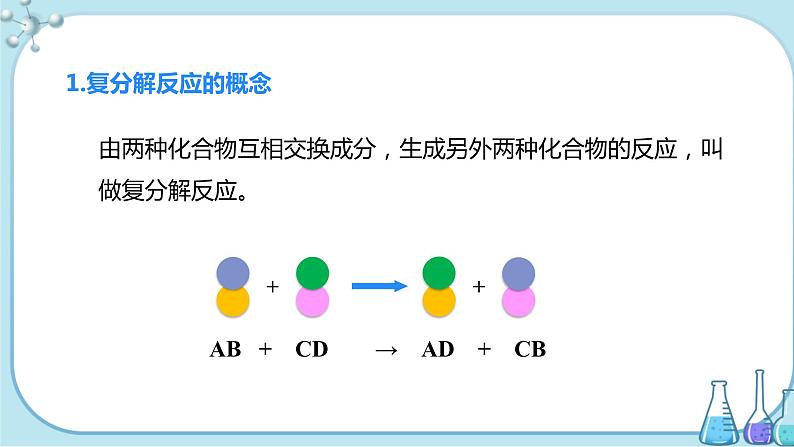
1.复分解反应:两种化合物相互交换成分,生成另外两种化合物的反应。
2.复分解反应发生的条件:当两种化合物互相交换成分,生成物中有沉淀或者水或者气体生成时,复分解反应才可以发生。
3.根据溶解性表,可归纳盐的溶解性如下:
(1)钾盐、钠盐、铵盐、硝酸盐均可溶。
(2)碳酸盐中除了钾、钠、铵盐可溶,镁盐微溶外,其余都不溶。
(3)盐酸盐除了AgCl不溶外,其余都可溶。
(4)硫酸盐除了CaSO4微溶、BaSO4不溶外,其余都可溶。
二、新知导学
知识点一 复分解反应
【小组讨论】1.写出下列反应的化学方程式,分析它们有什么共同点?
(1))碳酸钠溶液+澄清石灰水:Na2CO3+Ca(OH)2===CaCO3↓+2NaOH;
(2)稀硫酸+苛性钠:H2SO4+2NaOH===Na2SO4+2H2O;
(3)熟石灰+稀硫酸:Ca(OH)2+H2SO4===CaSO4+2H2O;
(4)氧化铜+稀盐酸:CuO+2HCl===CuCl2+H2O。
小结:1.定义:由两种化合物交换成分,生成另外两种化合物的反应叫作复分解反应。
2.特点:“双交换、价不换”。即两种化合物互相交换成分,各元素化合价在反应前后保持不变。
3.表达式:AB+CD== AD+CB。
4.复分解反应发生的条件
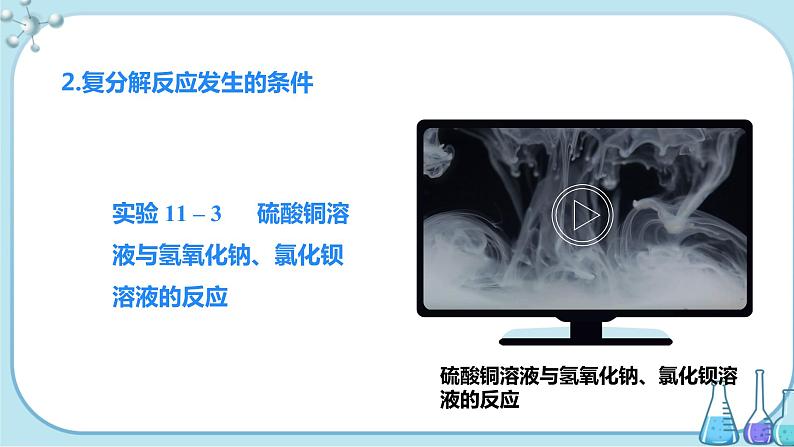
【师生合作】完成教材P75的“实验11-3”,向两支分别盛有少量氢氧化钠溶液和氯化钡溶液的试管中滴加硫酸铜溶液,观察现象并填写下表。
| CuSO4溶液+NaOH溶液 | CuSO4溶液+BaCl2溶液 |
现象 | 有蓝色沉淀生成 | 有白色沉淀生成 |
化学方程式 | CuSO4+2NaOH=== Cu(OH)2↓+Na2SO4 | CuSO4+BaCl2=== BaSO4↓+CuCl2 |
酸、碱、盐之间并不是都能发生复分解反应。只有当两种化合物相互交换成分,生成物中有沉淀或有气体或有 水生成时,复分解反应才可以发生。
知识点二 酸、碱、盐的溶解性
阅读课本P114附录 I 找出常见的酸、碱、盐的溶解性规律,并归纳记忆方法。
名称 | 化学式 | 溶解性 | 名称 | 化学式 | 溶解性 | 名称 | 化学式 | 溶解性 |
硫酸 | H2SO4 | 可溶 | 盐酸 | HCl | 可溶 | 硝酸 | HNO3 | 可溶 |
氢氧化钠 | NaOH | 可溶 | 氢氧化钡 | Ba(OH)2 | 可溶 | 氢氧化铁 | Fe(OH)3 | 不溶 |
硝酸钾 | KNO3 | 可溶 | 硝酸银 | AgNO3 | 可溶 | 硝酸钡 | Ba(NO3)2 | 可溶 |
硫酸铝 | Al2(SO4)3 | 可溶 | 硫酸铜 | CuSO4 | 可溶 | 硫酸钡 | BaSO4 | 不溶 |
碳酸钠 | Na2CO3 | 可溶 | 碳酸钡 | BaCO3 | 不溶 | 碳酸钙 | CaCO3 | 不溶 |
氯化银 | AgCl | 不溶 | 氯化钡 | BaCl2 | 可溶 | 氯化铝 | AlCl3 | 可溶 |
1.酸、碱、盐的溶解性:
(1)酸一般都溶于水;
(2)碱只有NaOH、KOH、Ba(OH)2、氨水溶于水、Ca(OH)2
微溶于水,其他均难溶于水。
(3)盐的溶解性有如下规律:钾盐、钠盐、铵盐、硝酸盐易
溶,盐酸盐只有AgCl难溶,硫酸盐只有BaSO4难溶,碳
酸盐只有碳酸钾、碳酸钠、碳酸铵可溶。
2.常见溶液的颜色:
含铜离子的溶液为蓝色;含亚铁离子的溶液为浅绿色;
含铁离子的溶液为黄色。其他的溶液多为无色。
【自主探究】阅读教材P75,判断某些酸、碱、盐之间是否发生反应。
| NaOH溶液 | NaCl溶液 | K2CO3溶液 | Ba(NO3)2溶液 |
稀硫酸 | 能 | 不能 | 能 | 能 |
判断依据 | 有水生成 | 没有沉淀或气体或水生成 | 有气体生成 | 有沉淀生成 |
复分解反应的常见类型及发生条件:
反应类型 | 酸+金属氧化物→盐+水 | 酸+碱→盐+水 | 酸+盐→新盐+新酸 | 碱+盐→新盐+新碱 | 盐+盐→新盐+新盐 |
反应物条件 | 酸溶于水 | 酸溶于水 | 酸溶于水 | 两者都溶于水 | 两者都溶于水 |
生成物条件 | 生成物中有沉淀或有气体或有水 | ||||
三、我的收获
四、当堂检测
1.下列反应属于复分解反应的是( A )
A.NaOH+HCl═==NaCl+H2O B.CO+CuOCO2+Cu
C.H2CO3═==H2O+CO2↑ D.Fe+2HCl===FeCl2+H2↑
2.下列各组物质的溶液,不能发生复分解反应的是( D )
A.HCl和Ca(OH)2 B.H2SO4和Na2CO3
C.AgNO3 和 BaCl2 D.KCl和CuSO4
3.可溶性钡盐有毒,既不溶于水,又不溶于酸的硫酸钡不但对人体无毒,还由于它不易被X射线透过,被医疗上作为X射线透视胃肠的内服药剂-“钡餐”。若误食了溶于水的BaCl2,可用于解毒的药剂是( C )
A.糖水 B.食盐水 C.硫酸钠溶液 D.碳酸钠溶液
4. 下列各组溶液混合,能发生复分解反应,既有沉淀又有气体产生的是( C )
A.氯化钾溶液和硝酸 B.氢氧化钡溶液和硫酸
C.碳酸氢钡溶液和硫酸 D.硫酸镁溶液和氢氧化钾溶液
5.下列各组物质中,能全部溶于水的是( A )
A.BaCl2、NaNO3、MgSO4 B.AgNO3、BaSO4、MgCl2
C.AgCl、CaCO3、Al2(SO4)3 D.ZnSO4、Cu(OH)2、CuSO4
6.判断以下反应能否发生(反应的写出方程式,不能反应的写明原因)
硝酸银和盐酸:AgNO3+ HCl===AgCl↓+ HNO3;氯化钡和硫酸:BaCl2 + H2SO4 ===BaSO4↓+2HCl;
硝酸钠和氯化钾:不能,生成物中没有沉淀或气体或水生成;碳酸钾和硫酸:K2CO3 + H2SO4=== K2SO4 +CO2↑+ H2O;
碳酸钡和硫酸:BaCO3 + H2SO4 === BaSO4↓+CO2↑+ H2O。
7.课外活动中,同学们玩起了以水为主题的“化学反应接龙”游戏。按图中的序号和要求的反应类型循环,完成下列反应的化学方程式。
①分解反应:2H2O2H2↑+O2↑。
②置换反应:H2+CuOCu+H2O。
③化合反应:H2O+CaO===Ca(OH)2。
④复分解反应:Ca(OH)2+2HCl===CaCl2+2H2O。
初中化学人教版九年级下册第十一单元 盐 化肥课题1 生活中常见的盐精品课件ppt: 这是一份初中化学人教版九年级下册第十一单元 盐 化肥课题1 生活中常见的盐精品课件ppt,文件包含第3课时盐的化学性质pptx、第3课时盐的化学性质docx、第3课时盐的化学性质docx、第3课时盐的化学性质学用docx等4份课件配套教学资源,其中PPT共14页, 欢迎下载使用。
初中化学人教版九年级下册第十一单元 盐 化肥课题1 生活中常见的盐优质课ppt课件: 这是一份初中化学人教版九年级下册第十一单元 盐 化肥课题1 生活中常见的盐优质课ppt课件,文件包含第1课时氯化钠碳酸钠碳酸氢钠和碳酸钙pptx、第1课时氯化钠碳酸钠碳酸氢钠和碳酸钙docx、第1课时氯化钠碳酸钠碳酸氢钠和碳酸钙学用docx、第1课时氯化钠碳酸钠碳酸氢钠和碳酸钙docx、实验11-1碳酸钠碳酸氢钠与盐酸的反应mp4、实验11-2碳酸钠溶液和氢氧化钙溶液反应mp4等6份课件配套教学资源,其中PPT共27页, 欢迎下载使用。
人教版九年级下册课题2 酸和碱的中和反应试讲课课件ppt: 这是一份人教版九年级下册课题2 酸和碱的中和反应试讲课课件ppt,文件包含第1课时中和反应pptx、第1课时中和反应docx、第1课时中和反应学用docx、第1课时中和反应docx、实验10-8氢氧化钠溶液与稀盐酸反应mp4等5份课件配套教学资源,其中PPT共20页, 欢迎下载使用。













