







鲁教版(五四制)九年级全一册 第二单元第三节 原子的构成 第2课时(课件+教案+练习+素材)
展开第二单元第三节 原子的构成 第2课时 教案
【教学目标】
1.知识与技能
(1)知道什么是相对原子质量,能说出原子的实际质量与相对原子质量的关系,能根据相对原子质量的概念进行简单的计算。
(2)知道原子核外的电子是分层排布的。
(3)原子得失电子后会形成离子
(4)知道离子的表示方法
2.过程与方法
(1)逐步认识到用相对原子质量的大小来衡量原子质量的大小会使衡量结果更接近常规的数据范围,这是一种重要的科学方法。
(2)通过多媒体教学手段及直观的语言,诱发学生的想像力,增加学生对微观粒子的感性认识
3.情感态度和价值观
(1)进行世界是物质的、物质是运动的等辨证唯物主义观点教育。
【教学重点】
(1)相对原子质量的计算
(2)对原子结构示意图的分析
【教学难点】
(1)原子结构示意图
(2)相对原子质量的意义
【课前准备】
多媒体素材
【课时安排】
1课时
【教学过程】
一、导入新课
虽然所有原子都非常微小,但是它们的质量仍存在差异。
例如,1个氧原子的质量为2.657×10-26 kg,1个铁原子的质量为9.288×10-26 kg。这么小的数字,书写、记忆和运算都很不方便,为此,国际上统一采用相对原子质量来计量原子的质量。
二、新课学习
二、原子质量的计量
以碳12原子质量的1/12作为基准,计算出其他原子的相对质量,就是这种原子的相对原子质量。
视频:相对原子质量
在这里值得我们注意的是:
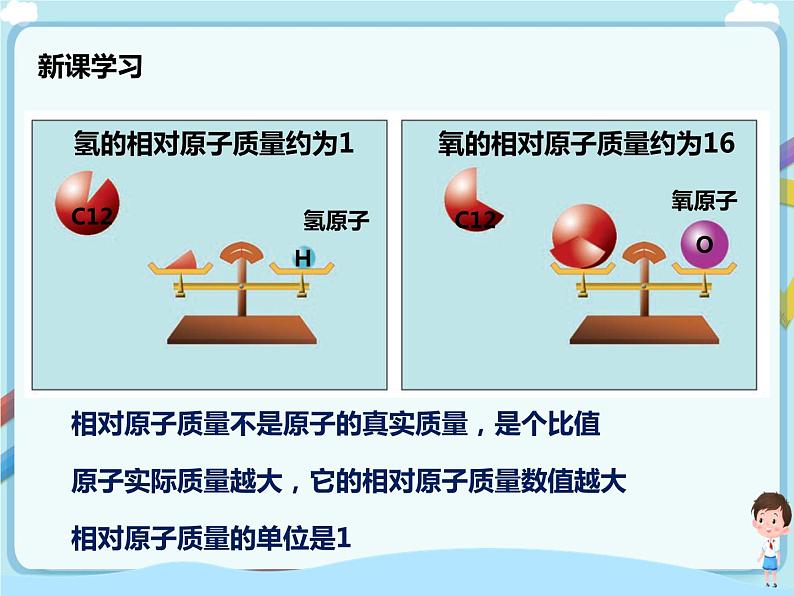
相对原子质量不是原子的真实质量,是个比值
原子实际质量越大,它的相对原子质量数值越大
相对原子质量的单位是1
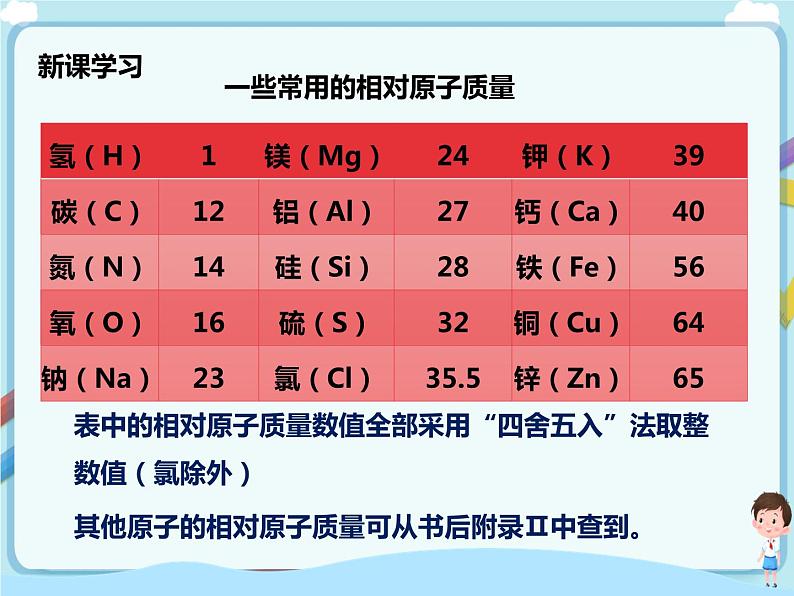
我们读表格:一些常用的相对原子质量
表中的相对原子质量数值全部采用“四舍五入”法取整数值(氯除外);其他原子的相对原子质量可从书后附录Ⅱ中查到。
由上表可知:计量原子的质量时,采用“碳12原子质量的1/12”作为基准,所得的相对原子质量数值要比采用“千克”作为基准所得的实际原子质量数值更简约,更便于比较和运算。
例:已知1个碳原子的质量是1.993×10-26Kg,一个硫原子的质量是5.3152×10-25Kg,求硫原子的相对原子质量?
[解:标准=1.993×10-26Kg×1/12=1.66×10-27Kg
硫原子的相对原子质量=5.3152×10-25Kg/1.66×10-27Kg=32
答:硫原子的相对原子质量是32]
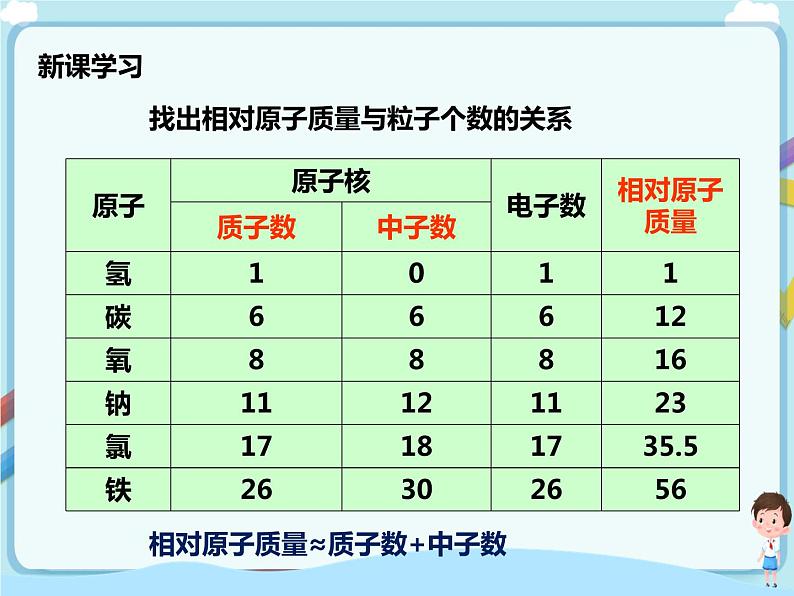
读表格,找出相对原子质量与粒子个数的关系
[相对原子质量≈质子数+中子数]
多识一点:计量中的科学
一要科学选择计量单位,以使得计量结果易于比较和运算。
二要科学选择计量工具,以保证计量结果的精确性。
三要科学控制影响计量的各种外界因素,以确保计量结果的公正性。
详细内容、参阅P41
三、原子中的电子
视频:原子核外电子的排布
在原子中,电子是体积小、质量轻的一种小粒子。不同的原子含有的电子数目不同。在多电子原子中,核外电子的能量是不同的。能量高的在离核较远的区域运动,能量低的在离核较近的区域运动。
通常把电子在离核远近不同的区域运动称为电子的分层排布。
一个碳原子的原子核内有6个质子和6个中子。核外有6个电子,其中有2个电子能量相近都较低,另外4个电子能量相近且能量稍高。这些电子都同时绕原子核高速运动。
根据刚才的理解,请你把碳原子的结构以最简洁的方式画出来。
[]
视频:原子结构示意图
用原子结构示意图可以方便简明地表示原子核外电子的排布。在原子结构示意图中:圆圈和圈内的数字表示原子核和核内质子数,弧线表示电子层,弧线上面的数字表示该层的电子数。
我们读图,这是部分原子的原子结构示意图
从这些示意图中,我们能得到哪些规律?
[核外电子两层排布的,第一层为2,第二层为质子数-2
核外电子三层排布的,第一层为2,第二层为8,第三层为质子数-10
……]
核外电子对原子在化学反应中的表现有很大影响。在化学反应中:有的原子容易失去电子,如多数金属原子;有的原子容易得到电子,如许多非金属原子;也有的原子既不易失去电子,也不易得到电子,如氦、氖、氩等稀有气体的原子。
我们结合示意图来填空表格:
元素 | 最外层电子数 | 原子结构 | 变化趋势 | 化学性质 |
稀有气体 | 8个(氦为2个 ) | 稳定结构 | 稳定 | 稳定 |
金属 | 一般少于4个 | 不稳定结构 | 易失去电子 | 活泼 |
非金属 | 一般等于或多于4个 | 不稳定结构 | 易获得电子 | 活泼 |
可见,原子的最外层电子数决定着原子的化学性质。
在化学反应中,原子核是不变的,发生改变的只是原子核外的电子。原子失去电子后变成带正电荷的阳离子,得到电子后变成带负电荷的阴离子。
像这种,带电的原子或原子团,我们称之为离子。
例如:钠原子(Na)失去1个电子,形成带1个单位正电荷的钠离子(Na+);氯原子(Cl)得到1个电子,形成带1个单位负电荷的氯离子(Cl-)。
可见,离子所带电荷数由该元素原子的最外层电子数决定。
离子可以用符号来进行表示:例:Al3+、S2-
离子符号有两个含义:表示一个离子所带的电荷数。还表示一个离子,如在符号前加上数字,则只表示几个离子。
带相反电荷的钠离子和氯离子相互作用,就形成了新的物质——氯化钠(NaCl),它是食盐的主要成分。
交流共享:离子与原子的区别和联系
| 原子 | 离子 | |
结构 | 质子数=电子数 | 阳离子 | 阴离子 |
质子数>电子数 | 质子数<电子数 | ||
电性 | 不带电 | 带正电 | 带负电 |
联系 | |||
在线测试:
1.关于相对原子质量,下列叙述正确的是( C )。
A.相对原子质量就是原子质量
B.两种原子的质量之比等于它们的相对原子质量之比
C.碳原子的相对原子质量是12g
D.采用相对原子质量后,就增大了原子的质量
2.已知一个铁原子的质量为9.288×10-26 kg,则铁的相对原子质量为__56__。
3.已知一个碳12原子的质量是1.993×10-26 kg,氧的相对原子质量为16,则一个氧原子的实际质量为__2.657×10-26Kg_。
课堂练习:
1.1991年我国科学家张青莲教授与另一位科学家合作,测定了铟元素的相对原子质量新值,铟的核电荷数为49,相对原子质量为115,则铟的中子数为( C )
A.164 B.115 C.66 D.49
2.非金属元素的原子得到电子后发生变化的是( B )
A.核外电子层数 B.化学性质 C.元素种类 D.核内中子数
3.根据下列原子或离子结构示意图填空。
A. B. C. D.
(1)电子层排布相同的是__ B、C_。
(2)属于金属元素的是__ D_ 。
(3)属于稀有气体元素的是__ C__ 。
(4)属于阴离子的是__ B__ ,其离子符号是__ F-__ 。
(5)原子变成离子后电子层会改变吗?
[得到电子后电子层数不变;失去电子后电子层减少]
课堂小结:
本节我们学习了哪些内容?
[1.原子在化学反应中的表现主要是由原子的最外层电子数决定的。最外层电子数较多的原子在化学反应中易得到电子;最外层电子数较少的原子在化学反应中易失去电子。
2.原子得到或失去电子后转变为离子。离子也是构成物质的一种基本粒子。
3.某原子的相对原子质量是一个该原子的质量跟一个碳12原子质量的1/12的比值。]
【板书设计】
二、原子中的电子
电子的分层排布
原子结构示意图
离子的概念与类别
三、原子质量的计量
相对原子质量≈质子数+中子数
【作业布置】
1.上网了解有关核外电子的更多知识
2.P43挑战自我1、4题
【教学反思】
通过本次教学,学生对原子构成和相对原子质量的认识只能是带来或多或少的机械记忆的成分,较深入的理解和较熟悉的运用还要在今后的教学中不断地复习、巩固、加深、提高才能达到。
在新课改理念下,如何同时做到课堂的开放与高效两不误。就拿本节课为例,通过分组讨论,亲自经历探究过程,培养了学生探究能力,加深了对原子结构的理解,这是我设计的初衷,但也正是这一点占用了大量的课堂时间,有时会使课堂出现了前紧后更紧的局面,影响教学任务的完成,使教学效果不佳。新课程倡导开放式教学,要求还课堂给学生,自主学习,合作学习,探究学习,无论哪种学习方式都需要很多时间,农村的实际决定了这段时间会更长,而课堂时间有限,怎样才能找到它们的最佳结合点。









