









人教版 (2019)选择性必修1第二节 化学平衡备课课件ppt
展开第六讲《影响化学平衡的因素》
题型一:勒夏特列原理
1.合成氨反应为 N2+3H22NH3 +Q(Q>0),在合成氨工业中常采取的下列措施不能用勒夏特列原理来解释的是( )
A.及时补充氮气和氢气 B.使用铁触媒做催化剂
C.将氨液化及时分离出反应器 D.压强增至20MPa~50MPa
2.下列措施或事实不能用勒夏特列原理解释的是( )
A.将平衡球浸泡在冰水中颜色变浅 B.用排饱和食盐水的方法收集氯气
C.打开可乐盖后看到大量的气泡逸出 D.氧化成,需要使用催化剂
3.下列事实中,不能用勒夏特列原理解释的是( )
A.在溴水中存在如下平衡:Br2+H2OHBr+HBrO,当加入NaOH溶液后颜色变浅
B.对2H2O22H2O+O2的反应,使用MnO2可加快制O2的反应速率
C.反应CO+NO2CO2+NO ΔH<0,升高温度使平衡向逆反应方向移动
D.合成氨反应:N2+3H22NH3 ΔH<0,为使氨的产率提高,理论上应采取低温高压的措施
题型二:影响化学平衡的因素
4.有一处于平衡状态的反应:3A(s)+2B(g) 3C(g),ΔH>0。为了使平衡向生成C的方向移动,应选择的条件是( )
①高温 ②低温 ③高压 ④低压 ⑤加催化剂
A.①③ B.①③⑤ C.①④ D.②④⑤
5.反应3H2(g)+N2(g) 2NH3(g) ΔH<0,达到平衡后,将体系的温度降低,下列叙述中正确的是( )
A.正反应速率增大,逆反应速率减小,平衡向正反应方向移动
B.正反应速率减小,逆反应速率增大,平衡向逆反应方向移动
C.正反应速率和逆反应速率都减小,平衡向逆反应方向移动
D.正反应速率和逆反应速率都减小,平衡向正反应方向移动
6.在下列平衡体系中,保持温度一定时,改变某物质的浓度,混合气体的颜色会改变;改变压强时,颜色也会改变,但平衡并不移动,这个反应是( )
A.2NO(g)+O2(g)2NO2(g) B.N2O4(g)2NO2(g)
C.Br2(g)+H2(g)2HBr(g) D.6NO(g)+4NH3(g)5N2(g)+3H2O(g)
7.K2Cr2O7溶液中存在平衡:Cr2O(橙色)+H2O2CrO(黄色)+2H+。现在用K2Cr2O7溶液进行下列实验:
已知:C2H5OH遇到强氧化剂可被氧化。结合实验,下列说法不正确的是( )
A.①中溶液橙色加深,③中溶液变黄
B.②中Cr2O被C2H5OH还原
C.对比②和④可知K2Cr2O7酸性溶液氧化性弱
D.若向④中加入70%H2SO4溶液至过量,溶液变为绿色
8.一定条件下的可逆反应:N2(g)+3H2(g)=2NH3(g) △H=-92.4kJ·mol-1,下列说法正确的是( )
A.将氨气液化分离或升高温度,都有利于提高反应物的转化率
B.保持容积不变时充入少量Ar气体,压强增大,平衡不移动
C.将1molN2(g)和3molH2(g)充入一密闭容器中反应,放出92.4kJ的热量
D.加入催化剂,改变了反应的路径,反应的△H也随之改变
题型三:影响化学平衡的因素&转化率
9.工业合成氨反应:N2(g)+3H2(g) 2NH3(g) △H= -92.4kJ/mol。下列措施有利于提高H2平衡转化率的是( )
A.升高温度 B.增大压强
C.使用铁触媒做催化剂 D.增大H2的浓度
10.密闭的真空容器中放入一定量CaO2固体,发生反应2CaO2(s)⇌2CaO(s)+O2(g)并达到平衡。保持温度不变,缩小容器容积为原来的一半,下列叙述正确的是( )
A.缩小容器的容积后,平衡正向移动 B.重新平衡后O2的浓度不变
C.重新平衡后CaO的量不变 D.重新平衡后CaO2的量不变
11.在恒压、NO和O2的起始浓度均为的条件下,催化反应相同时间,测得五种不同浓度下NO转化为NO2的转化率如下表:
温度/℃ | 100 | 200 | 300 | 400 | 500 |
NO转化率/% | 28.8 | 78.5 | 80.0 | 50.0 | 18.2 |
下列说法错误的是( )
A.反应2NO+O22NO2的
B.200℃时,延长反应时间能提高NO转化率
C.五种条件下,增加O2的起始浓度不一定都能提高NO的转化率
D.300℃时,该反应一定处于平衡状态
12.在密闭容器中,反应xA(g)+yB(g) zC(g),达到平衡后测得A气体的浓度为0.5mol/L。保持温度不变,将密闭容器的容积增加一倍,当达到新的平衡时,测得A的浓度为0.3mol/L,则下列叙述中正确的是( )
A.平衡向正反应方向运动 B.x + y > z
C.物质C的体积分数增大 D.物质B的转化率增大
题型四:影响化学平衡的因素的图像分析
13.在一定温度下,改变起始时n(SO2)对反应2SO2(g)+O2(g) 2SO3(g)ΔH<0的影响如图所示,下列说法正确的是( )
A.b、c点均为平衡点,a点未达平衡且向正反应方向进行
B.a、b、c三点中,a点时SO2的转化率最大
C.a、b、c点均为平衡点,b点时SO2的转化率最大
D.a、b、c三点的平衡常数:Kb>Kc>Ka
14.现有下列四个图象:
下列反应中符合上述全部图象的是( )
A. N2(g)+3H2(g) 2NH3 (g)
B.2SO3 (g) SO2(g)+O2(g)
C.4NO(g)+5H2O (g) 4NO(g) +5O2 (g)
D.H2(g)+CO(g) C(s) + O2(g)
15.在一定条件下,取一定量的A和B在恒容密闭容器中发生反应: mM(g)+nN(g),达到平衡时,M的浓度与温度和容器容积的关系如图所示。下列有关判断一定正确的是( )
A.
B.达到平衡后,增大B的量将会提高A的转化率
C.E点的平衡常数小于F点的平衡常数
D.
16.已知:N2(g)+3H2(g)⇌2NH3(g) ΔH= m kJ·mol-1。在 2 L 容积不变的密闭容器中通入 1 mol N2和3 mol H2,在温度分别为T1 、T2下,测得NH3的产率随时间变化如图。下列说法正确的是( )
A.T2>T1,∆H>0 B.a,b两点的反应速率:va>vb
C.平衡时,通入氩气平衡正向移动 D.达到平衡时,放出热量为 |m| kJ
题型四:化学平衡综合计算
17.一定温度下,在三个容积均为1.0 L的恒容密闭容器中仅发生反应:CH3OH(g)+CO(g)CH3COOH(g) △H<0。下列说法正确的是( )
容器编号 | 温度/K | 物质的起始浓度/mol·L-1 | 物质的平衡浓度/mol·L-1 | ||
c(CH3OH) | c(CO) | c(CH3COOH) | c(CH3COOH) | ||
I | 530 | 0.50 | 0.50 | 0 | 0.40 |
II | 530 | 0.20 | 0.20 | 0.40 |
|
III | 510 | 0 | 0 | 0.50 |
|
A.容器I中反应达到平衡所需时间比容器III中的长
B.达到平衡时,容器I中的CH3OH体积分数比容器II中的小
C.达平衡时,容器I中CH3OH转化率与容器III中CH3COOH转化率之和小于1
D.若起始时向容器I中充入2.0 mol CH3OH(g)、0.10 mol CO(g)和8.0 mol CH3COOH(g),则反应将向逆反应方向进行
18.将不同量的CO(g)和(g)分别通入体积为2L的恒容密闭容器中,发生反应,得到如下三组数据:
实验序号 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | |
CO | |||||
1 | 650 | 4 | 2 | 1.6 | 5 |
2 | 900 | 2 | 1 | 0.4 | 3 |
3 |
| 2 | 1 | 0.4 | 1 |
下列说法错误的是( )
A.该反应的
B.实验1中,前5min用CO表示的反应速率为0.16
C.实验2中,平衡常数
D.实验3与实验2相比,改变的条件可能是升高温度
19.将2molA和1molB混合置于一容积可变的密闭容器中,在温度T下发生如下反应:2A(g)+B(g)2C(g)+Q,反应进行tmin后达到平衡,测得混合气体的总物质的量为2.1mol。试回答:
(1)该反应的平衡常数表达式为___________;
(2)下列有关化学平衡常数K的说法正确的是___________(填字母)
A.在任何情况下,化学平衡常数K均为一个定值
B.改变气体A或C的浓度,都会改变平衡常数K
C.平衡常数K只与温度有关,与反应物的浓度无关
D.从平衡常数K的大小可以推断一个反应进行的限度
(3)若降低温度,则该反应的K值___________(填“增大”、“减小”或“不变”,下同),A的转化率___________,化学反应速率___________;
(4)反应进行tmin后,C的体积分数为___________。
20.用合成甲醇()的化学方程式为,按照相同的物质的量投料,测得在不同温度下的平衡转化率与压强的关系如图所示。下列说法正确的是( )
A.温度:
B.正反应速率:、
C.平衡常数:、
D.平均摩尔质量:、
21.(双选)在同一温度下,在3个容积均为1.0 L的恒容密闭容器中发生反应:PCl5(g) PCl3(g)+Cl2(g)。下列说法错误的是
容器编号 | 物质的起始浓度/(mol/L) | 物质的平衡浓度/(mol/L) | ||
c(PCl5) | c(PCl3) | c(Cl2) | c(Cl2) | |
I | 0.4 | 0 | 0 | 0.2 |
II | 0.6 | 0 | 0.2 |
|
III | 0.8 | 0 | 0 |
|
A.反应达到平衡时,容器I中比容器II中的大
B.反应达到平衡时,容器I与容器II中的总压强之比为3∶4
C.反应达到平衡时,容器III中Cl2的体积分数小于
D.反应达到平衡时,容器III中0.4 mol/L<c(PCl5)<0.8 mol/L
22.已知2SO2(g)+O2(g) 2SO3(g),下图为不同温度(T1、T2)下SO2的转化率随时间的变化曲线。
(1)T1___________(选填“>”“<”或“=”)T2,判断依据是___________;该反应为___________(选填“放”或“吸”)热反应,判断依据是___________。
(2)在相同温度下:2NO(g)+O2(g) 2NO2(g) K1=a;
NO2(g)+SO2(g) SO3(g)+NO(g) K2=b;
则2SO2(g)+O2(g) 2SO3(g)的平衡常数K=___________(用a、b表示)。
23.科学家利用反应对汽车尾气进行无害化处理,发生如下反应: 2CO+2NO 2CO2+N2。一定条件下, 在1L密闭容器中充入2.00molCO和2.00molNO,一段时间后测得CO、CO2浓度随时间变化如图1所示,CO的平衡转化率与温度、起始投料比m的关系如图2所示,图中起始投料比m=
(1)该反应的化学平衡常数表达式是_______, 该反应的正反应是_______反 应(填“吸热”或“放热”)。
(2)根据图1,用N2表示该反应达平衡过程中的平均反应速率是_______(保留小数点后两位小数)
(3)图2中a、b、c三点对应的平衡常数Ka、Kb、Kc相对大小关系是_______。
(4)关于该可逆反应的说法正确的是_______。
a.加入催化剂可提高NO的平衡转化率
b.当体系中c(CO2): c(N2)=2: 1时,该反应达到平衡状态
c.保持其他条件不变,若充入N2,则达到新平衡时,正、逆反应速率均增大
d.投料比: m1>m2>m3
(5)随着温度的升高,不同投料比下CO的平衡转化率趋于相近的原因为_______。
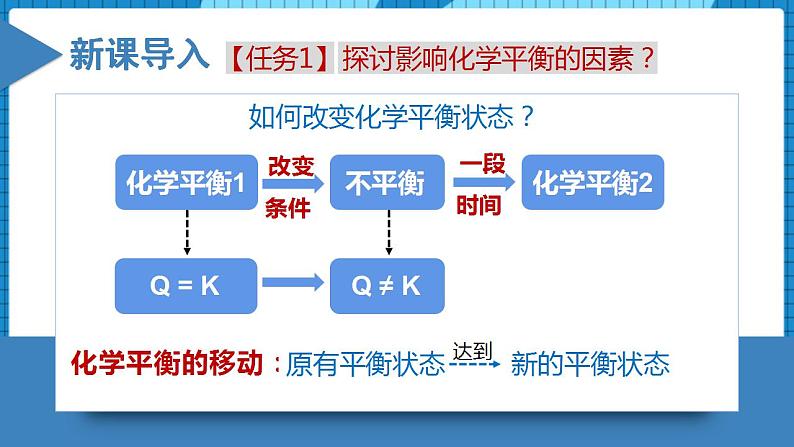
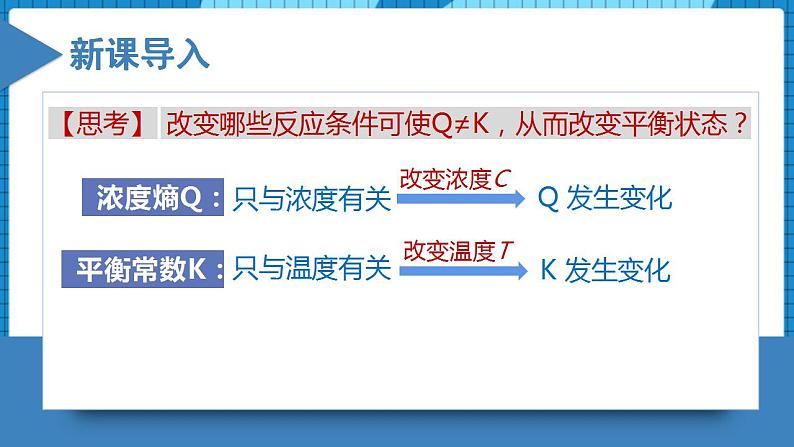
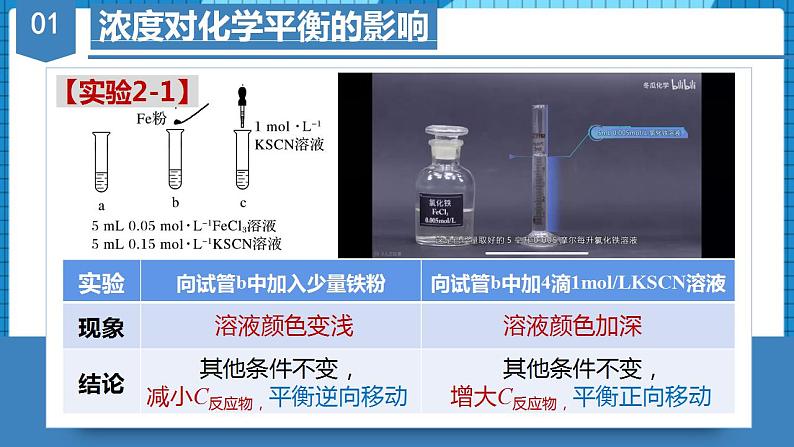
高中化学人教版 (2019)选择性必修1第二节 化学平衡备课课件ppt: 这是一份高中化学人教版 (2019)选择性必修1第二节 化学平衡备课课件ppt,共28页。PPT课件主要包含了V正≠V逆,V正V逆≠0,条件改变,建立新平衡,破坏旧平衡,一定时间,化学平衡移动,实验2-1,硫氰化铁,正反应等内容,欢迎下载使用。
高中人教版 (2019)第二章 化学反应速率与化学平衡第二节 化学平衡备课课件ppt: 这是一份高中人教版 (2019)第二章 化学反应速率与化学平衡第二节 化学平衡备课课件ppt,共36页。PPT课件主要包含了化学平衡常数,称为浓度商,c为平衡浓度,c为任一时刻浓度,一定温度下,某温度下,模块三速率常数,压强平衡常数,p分压,第三段等内容,欢迎下载使用。
高中化学人教版 (2019)选择性必修1第二节 化学平衡备课课件ppt: 这是一份高中化学人教版 (2019)选择性必修1第二节 化学平衡备课课件ppt,文件包含221化学平衡分层作业解析版-上好课2022-2023学年高二化学同步备课系列人教版2019选择性必修1docx、221化学平衡分层作业原卷版-上好课2022-2023学年高二化学同步备课系列人教版2019选择性必修1docx、221化学平衡教学课件高二化学同步备课系列人教版2019选择性必修1pptx等3份课件配套教学资源,其中PPT共0页, 欢迎下载使用。













