

化学选择性必修3第三章 烃的衍生物第五节 有机合成第2课时教案设计
展开学习导航
1. 结合碳骨架的构建及官能团衍变过程中的反应规律,能利用反应规律进行有机物的推断与合成。
2.落实有机物分子结构分析的思路和方法,建立对有机反应多角度认识模型、并利用模型进一步掌握有机合成的思路和方法。
教学过程
一、有机合成路线的设计
1.常见有机物的转化关系
若以乙醇为原料合成乙二酸(HOOC—COOH),则依次发生反应的类型是消去反应、加成反应、水解(或取代)反应、氧化反应、氧化反应。
2.常见的有机合成路线
(1)一元化合物合成路线
eq \x(R—CH==CH2)eq \(――→,\s\up7(HX))eq \x(卤代烃)eq \(―――――→,\s\up11(NaOH水溶液),\s\d4(△))eq \x(一元醇)eq \(――→,\s\up7([O]))eq \x(一元醛)eq \(――→,\s\up7([O]))eq \x(一元羧酸)eq \(―――――――→,\s\up7(醇、浓H2SO4,△))eq \x(酯)
(2)二元化合物合成路线
eq \x(CH2==CH2)eq \(――→,\s\up7(X2))eq \x(CH2X—CH2X)eq \(―――――→,\s\up11(NaOH水溶液),\s\d4(△))eq \x(HOCH2—CH2OH)eq \(――→,\s\up7([O]))eq \x(OHC—CHO)eq \(――→,\s\up7([O]))eq \x(HOOC—COOH)eq \(―――→,\s\up7(一定条件))eq \x(链酯、环酯、聚酯)
(3)芳香族化合物合成路线
①eq \(――→,\s\up11(Cl2),\s\d4(FeCl3))eq \(―――――――→,\s\up11(NaOH水溶液、H+),\s\d4(△))
②eq \(――→,\s\up11(Cl2),\s\d4(光照))eq \(―――――→,\s\up11(NaOH水溶液),\s\d4(△))
eq \(―――――――→,\s\up7(醇,浓硫酸,△))芳香酯
3.有机合成中常见官能团的保护
(1)酚羟基的保护:因酚羟基易被氧化,所以在氧化其他基团前可以先使其与NaOH溶液反应,把—OH变为—ONa(或使其与ICH3反应,把—OH变为—OCH3)将其保护起来,待氧化后再酸化将其转变为—OH。
(2)碳碳双键的保护:碳碳双键也容易被氧化,在氧化其他基团前可以利用其与HCl等的加成反应将其保护起来,待氧化后再利用消去反应转变为碳碳双键。
(3)氨基(—NH2)的保护:如在对硝基甲苯eq \(――→,\s\up7(合成))对氨基苯甲酸的过程中应先把—CH3氧化成—COOH之后,再把—NO2还原为—NH2。防止当KMnO4氧化—CH3时,—NH2(具有还原性)也被氧化。
二、逆合成分析法
1.逆合成分析法
从目标化合物的组成、结构、性质入手,找出合成所需的直接或间接的中间体,逐步推向已知原料,其合成示意图为
2.逆合成分析法应用例析
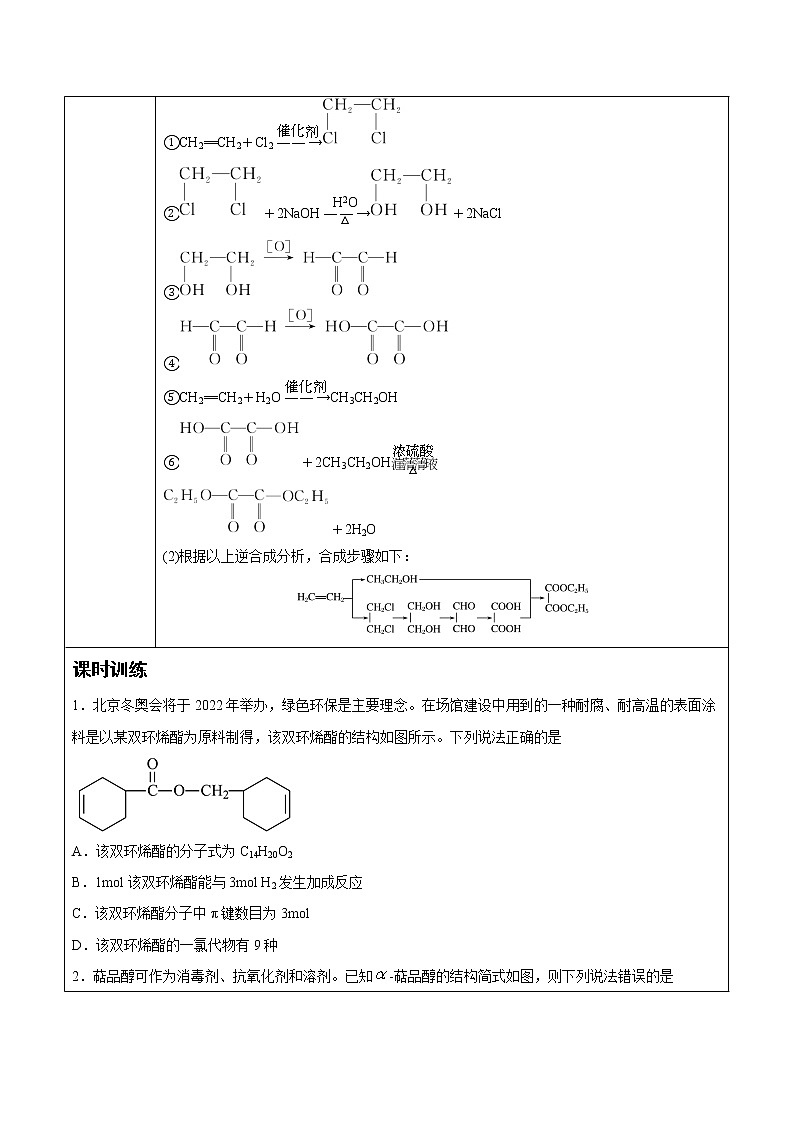
由“逆合成分析法”分析由乙烯合成草酸二乙酯
(1)具体步骤如下:
根据以上逆合成分析,可以确定合成草酸二乙酯的有机基础原料为乙烯(CH2==CH2),通过六步反应进行合成,写出反应的化学方程式:
①CH2==CH2+Cl2eq \(――→,\s\up7(催化剂))
②+2NaOHeq \(――→,\s\up11(H2O),\s\d4(△))+2NaCl
③
④
⑤CH2==CH2+H2Oeq \(――→,\s\up7(催化剂))CH3CH2OH
⑥+2CH3CH2OHeq \(,\s\up11(浓硫酸),\s\d4(△))
+2H2O
(2)根据以上逆合成分析,合成步骤如下:
课时训练
1.北京冬奥会将于2022年举办,绿色环保是主要理念。在场馆建设中用到的一种耐腐、耐高温的表面涂料是以某双环烯酯为原料制得,该双环烯酯的结构如图所示。下列说法正确的是
A.该双环烯酯的分子式为C14H20O2
B.1ml该双环烯酯能与3ml H2发生加成反应
C.该双环烯酯分子中π键数目为3ml
D.该双环烯酯的一氯代物有9种
2.萜品醇可作为消毒剂、抗氧化剂和溶剂。已知-萜品醇的结构简式如图,则下列说法错误的是
A.1ml该物质最多能和1ml氢气发生加成反应B.该物质属于烃
C.该物质能使溴水褪色D.分子式为
3.绿原酸是金银花的提取物,它是中成药连花清瘟胶囊的有效成分,其结构简式如图,下列有关说法错误的是
A.绿原酸分子存在顺反异构现象B.绿原酸能够发生消去反应
C.绿原酸最多能与反应D.绿原酸可以与发生加成反应
4.欧前胡素()具有抗菌、平喘及抗过敏等作用。下列关于欧前胡素的说法错误的是
A.分子式为
B.能使酸性高锰酸钾溶液和溴水褪色,但反应类型不同
C.能够在碱性条件下发生水解反应
D.欧前胡素最多能与发生加成反应
5.止吐药米格列奈中间体N的合成反应如图(已知:Ph为苯基)。下列相关叙述错误的是
A.中间体N的分子式为C22H16O8N2
B.物质的量相同的M与N最多消耗等量的NaOH
C.M合成N的反应为取代反应
D.M、N都能使酸性的KMnO4溶液褪色
6.下列说法不正确的是
A.等质量的烷烃与氧气充分反应,消耗氧气的量最多的烷烃是CH4
B.乙烷和乙烯燃烧现象不同是因为乙烯有碳碳双键
C.燃烧0.1ml两种气态烃的混合物,生成标况下3.584LCO2,则混合气体中一定有甲烷
D.同状况下,VL乙烯和乙醇的混合气体以任意比混合,完全燃烧,消耗氧气的体积均为3VL
7.“一锅法”用[Ru]催化硝基苯(PhNO2,Ph-表示苯基)与醇(RCH2OH)反应为仲胺(RCH2NHPh),反应过程如下图所示。下列叙述错误的是
A.反应原料中的RCH2OH 不能用RCH(CH3)OH代替
B.历程中存在反应PhNH2+RCHO→RCH=NPh+H2O
C.有机物还原反应的氢都来自于RCH2OH
D.该反应过程结束后RCHO没有剩余
8.某有机物A的分子式为C10H20O2,已知A~E有如右图转化关系。则A的结构可能有
A.3种B.4种
C.5种D.6种
9.2-氯乙醇是一种重要的有机化工原料,溶于水,受热时易分解。通常是以适量的2-氯乙醇为溶剂,用氯化氢与环氧乙烷反应制得新的2-氯乙醇。制取反应装置如图所示。
反应原理为:
(g)+HCl(g)⇌ClCH2CH2OH(l) △H<0
部分实验药品及物理量:
化合物名称
相对分子质量
熔点(℃)
沸点(℃)
环氧乙烷
44
-112.2
10.8
2-氯乙醇
80.5
-67.5
128.8
制取与测定实验步骤如下:
I.2-氯乙醇的制取
①将溶剂2-氯乙醇加入______(填仪器名称)中,启动搅拌器;
②分别将氯化氢与环氧乙烷两种气体按6:5物质的量的配比通入反应器中,使其在溶剂中充分溶解反应;
③反应温度控制在30℃,持续反应100 min;
④采用减压蒸馏、收集产品。
(1)实验装置A、B中均用到了浓硫酸,分别体现的浓硫酸的性质为______,______。
(2)步骤③控制反应温度在30℃,如果温度高于30℃可能的后果有______。
(3)在步骤④中,采用减压蒸馏的原因是______。
II.2-氯乙醇样品中Cl元素的测定
①取样品1.00 mL于锥形瓶中,加入NaOH溶液,加热;待反应完全后加稀硝酸至酸性;
②加入32.50 mL 0.4000 ml·L-1 AgNO3溶液,使Cl-完全沉淀;
③加入指示剂,用0.1000 ml·L-1 NH4SCN溶液滴定过量的Ag+至终点,消耗NH4SCN溶液10.00 mL;
④另取样品1.00 mL加水稀释至10.00 mL,用pH计测定,测得溶液pH为1.00。
已知:
a.Ksp(AgCl)=1.8×10-10、Ksp(AgSCN)=1.0×10-12
b.2-氯乙醇样品中还含有一定量的氯化氢和其他杂质(杂质不与NaOH和AgNO3溶液反应),密度约为1.10 g·mL-1。
(1)ClCH2CH2OH与NaOH反应生成NaCl和另一种物质,该物质的分子式为______。
(2)步骤④中选用的指示剂可以是下列的______。(选填序号)
A.淀粉溶液 B.酚酞溶液 C.NH4Fe(SO4)2溶液 D.NaCl溶液
(3)根据实验测定的数据计算,样品中2-氯乙醇的质量分数为______。
(4)ClCH2CH2OH与乙酸发生酯化反应的方程式______。
10.以有机物A和CCl4为原料合成苯丙氨酸E的流程如下:
已知:→
(1)A的化学名称为________________E的质谱图中,最大质荷比的数值是__________
(2)D→E的反应类型为__________
(3)有关D的叙述错误的是_____________(填序号)
a.能使KMnO4溶液褪色 b.能与液溴在铁粉作用下反应
c.能与甲醇发生酯化反应 d.能发生水解反应
(4)C的结构简式为_______________
(5)满足下述条件的E的同分异构体共有______________种。
①属于酯类;
②苯环上有两个对位取代基,其中一个为−NH2
答案解析
1.A
【详解】
A.该结构中含两个六元环,12个C原子;一个酯基、一个亚甲基,故其分子式为,故A正确;
B.酯基不能与氢气加成,故1ml双环烯酯能与2 ml H2发生加成反应, B错误;
C.没有具体说明双环烯酯的物质的量,故不能计算出分子中所含大π键的数目,故C错误;
D.该分子为非对称结构,酯基左边 的一氯代物有6种;酯基右边部分一氯代物有7种,共计13种,故D错误;
故选A。
2.B
【详解】
A.-萜品醇分子中含有1个碳碳双键,则1ml该物质最多能和1ml氢气发生加成反应,A正确;
B.该分子中除有碳、氢原子外,还含有氧原子,不属于烃,B错误;
C.该物质分子中含有碳碳双键,能使溴水褪色,C正确;
D.该物质的分子式为,D正确;
故选B。
3.C
【详解】
A.绿原酸含有碳碳双键,碳碳双键左端连的两个原子或原子团不相同,碳碳双键右端连的两个原子或原子团不相同,即类似与,因此绿原酸分子存在顺反异构现象,故A正确;
B.绿原酸右下角的羟基,连羟基的碳的相邻碳上有碳氢键,因此能够发生消去反应,故B正确;
C.绿原酸含有2ml酚羟基,1ml羧基,1ml酚醇酯,因此最多能与4mlNaOH反应,故C错误;
D.绿原酸含有苯环和碳碳双键,因此绿原酸可以与发生加成反应,故D正确。
答案为C。
4.D
【详解】
A.根据结构简式可以确定欧前胡素的分子式为C16H14O4,A项正确;
B.分子中含有碳碳双键,能使酸性高锰酸钾溶液和误水褪色,前者为氧化反应,后者为加成反应,故反应类型不同,B项正确;
C.含有酯基,在碱性条件下可以发生水解反应,C项正确;
D.分子中含有碳碳双键和苯环,可以与H2发生加成反应,但酯基中的C=O键不能与H2发生加成反应,故1 ml欧前胡素最多能与6 mlH2发生加成反应,D项错误;
答案选D。
5.B
【详解】
A.由N结构可知分子式为C22H16O8N2,A正确;
B.1mlM含有2ml羧基,能消耗2mlNaOH,1mlN含有2ml酯基,消耗2mlNaOH用于酯的水解,得到的羟基连在苯环上,属于酚羟基,又消耗2mlNaOH,则1mlN能消耗4mlNaOH,两者不同,B错误;
C.M合成N是羟基和羧基发生酯化反应,反应类型是取代反应,C正确;
D.M 、N中苯的支链上有H原子,能被酸性的KMnO4氧化褪色,D正确;
故选:B。
6.B
【详解】
A. 等质量的烷烃与氧气充分反应,氢的质量分数越大,消耗氧气越多,消耗氧气的量最多的烷烃是CH4,故A正确;
B. 乙烷和乙烯燃烧现象不同是因为两者碳的质量分数不同,故B错误;
C. 燃烧0.1ml两种气态烃的混合物,生成标况下3.584LCO2,即 =0.16ml,平均每摩烃含有碳原子数为 =1.6,则混合气体中一定有甲烷,故C正确;
D. 乙烯和乙醇分子式分别是:C2H4,C2H6O,根据物质的组成判断耗氧量,物质的量相同的烃CxHy的耗氧量取决于x+=2+1=3,物质的量相同的含烃氧衍生物CxHyOz耗氧量取决于x+-=2+1.5-0.5=3,同状况下,VL乙烯和乙醇的混合气体以任意比混合,完全燃烧,消耗氧气的体积均为3VL,故D正确;
故选B。
7.D
【详解】
A.由①②③知,RCHO是①的产物,是③的反应物,①中生成③中消耗,③生成的RCH2NHPh会变成RCH=NPh作为④的反应物,若将RCH2OH替代,最终RCH2NHPh会变成RCH(CH3)NHPh,不是所需产物,A项不符合题意;
B.由③知,存在该反应,B项不符合题意;
C.由图中PhNO2→PhNH2,RCH=NPh→RCH2NHPh,该反应中的H来源于Ru-H,Ru-H中的H来源于RCH2OH,C项不符合题意;
D.[Ru]为催化剂,由分析可知总反应为4RCH2OH+PhNO23RCHO+3H2O+RCH2NHPh,RCHO有剩余,D项符合题意;
故正确选项为D
8.B
【详解】
有机物A的化学式为C10H20O2,A在碱性条件下水解生成B和D,B经过酸化后得到C,D通过两步氧化能转化成C,说明有机物A是属于酯类,且B、D、E和C有相同的碳原子数。D可经两步氧化转化为C,则可知D是醇,化学式为C4H9CH2OH,C是酸,化学式为C4H9COOH,B和D都含有烷基C4H9-,且碳链骨架相同;所以B、D的烃基碳链结构式如下:CH3CH2CH2CH2-、(CH3)2CHCH2-、CH3CH2CH(CH3)-、(CH3)3C-,共4种结构,所以有机物A可能结构有4种,故答案选B。
9.三颈烧瓶 难挥发性 吸水性 2-氯乙烷产率低 减小压强,使液体沸点降低,防止2-氯乙醇因温度过高而分解 C2H6O2 C 80.5% CH3COOH+ClCH2CH2OHCH3COOCH2CH2Cl+H2O
【详解】
I.①根据图示可知,将溶剂2-氯乙醇加入三颈烧瓶中,故答案为:三颈烧瓶;
(1)装置A中,浓硫酸作为反应物,利用难挥发性酸制易挥发性酸的原理,制取氯化氢气体;B中用浓硫酸除去氯化氢中混有的水蒸气,所以分别体现的浓硫酸的性质为难挥发性,吸水性。故答案为:难挥发性;吸水性;
(2)对于反应(g)+HCl(g)⇌ClCH2CH2OH(l) △H<0,步骤③控制反应温度在30℃,以加快反应速率,但如果温度高于30℃,则平衡会发生逆向移动,所以可能的后果有2-氯乙烷产率低。故答案为:2-氯乙烷产率低;
(3)题中信息显示:2-氯乙醇受热时易分解,所以在步骤④中,采用减压蒸馏的原因是减小压强,使液体沸点降低,防止2-氯乙醇因温度过高而分解。故答案为:减小压强,使液体沸点降低,防止2-氯乙醇因温度过高而分解;
II.(1)ClCH2CH2OH与NaOH反应发生水解反应,生成NaCl和乙二醇(HOCH2CH2OH),乙二醇的分子式为C2H6O2。故答案为:C2H6O2;
(2)步骤④中,为准确测定NH4SCN与过量的Ag+刚好完全反应,需选择与SCN-反应敏感的Fe3+,所以选用的指示剂可以是NH4Fe(SO4)2溶液,故选C;故答案为:C;
(3)样品中含有HCl的物质的量为n(HCl)=0.1ml/L×0.01L=0.001ml,n(AgNO3)=0.4ml/L×0.0325L=0.013ml,n(NH4SCN)= 0.1ml/L×0.01L=0.001ml,则样品中氯原子的物质的量为0.013ml-0.001ml-0.001ml=0.011ml,所以样品中2-氯乙醇的质量分数为=80.5%。故答案为:80.5%;
(4)ClCH2CH2OH与乙酸发生酯化反应的方程式为:CH3COOH+ClCH2CH2OHCH3COOCH2CH2Cl+H2O,故答案为:CH3COOH+ClCH2CH2OHCH3COOCH2CH2Cl+H2O
10.苯乙烯 165 加成反应 d 6
【详解】
(1)根据前面分析得到A(苯乙烯)的化学名称为苯乙烯,根据E的质谱图原理,最大质荷比就是它的相对原子质量即165,故答案为:苯乙烯;165。
(2)根据D、E的结构得到D→E的反应类型为加成反应,故答案为:加成反应。
(3)a.D含有碳碳双键,因此D能使KMnO4溶液褪色,故a正确;b.D含有苯环,能与液溴在铁粉作用下发生取代反应,故b正确;c.D含有羧基,因此D能与甲醇发生酯化反应,故c正确;d.D中不含有酯基,因此D不能发生水解反应,故d错误;综上所述,答案为d。
(4)根据B的结构简式和D的结构简式得到B发生水解反应得到C,C发生消去反应得到D,因此C的结构简式为,故答案为:。
(5)E的同分异构体符合下列条件:①属于酯类,说明含有酯基;②苯环上有两个对位取代基,其中一个为一NH2,则另一个为酯基,可能是CH3CH3COO-、CH3COOCH2-、HCOOCH2CH2-、HCOOCH(CH3)-、CH3OOCCH2-、CH3CH2OOC--共6种,所以符合条件的有6种结构,故答案为:6。
人教版 (2019)选择性必修3第五节 有机合成第二课时教案设计: 这是一份人教版 (2019)选择性必修3第五节 有机合成第二课时教案设计,共6页。
化学实验活动3 糖类的性质第1课时教学设计: 这是一份化学实验活动3 糖类的性质第1课时教学设计,共12页。教案主要包含了醇的概述,醇的化学性质——以乙醇为例等内容,欢迎下载使用。
高中化学人教版 (2019)选择性必修3第五节 有机合成第1课时教学设计: 这是一份高中化学人教版 (2019)选择性必修3第五节 有机合成第1课时教学设计,共14页。教案主要包含了有机合成等内容,欢迎下载使用。













