



高中化学人教版 (2019)选择性必修1第三章 水溶液中的离子反应与平衡第三节 盐类的水解课堂教学课件ppt
展开这是一份高中化学人教版 (2019)选择性必修1第三章 水溶液中的离子反应与平衡第三节 盐类的水解课堂教学课件ppt,共27页。PPT课件主要包含了盐类的水解,④⑥⑤③①②等内容,欢迎下载使用。
实验回顾: 向Na2CO3溶液中滴加酚酞溶液,可观察到什么现象?
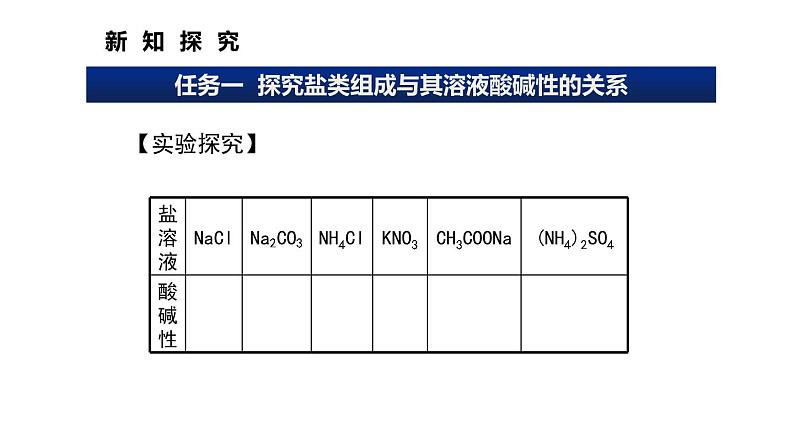
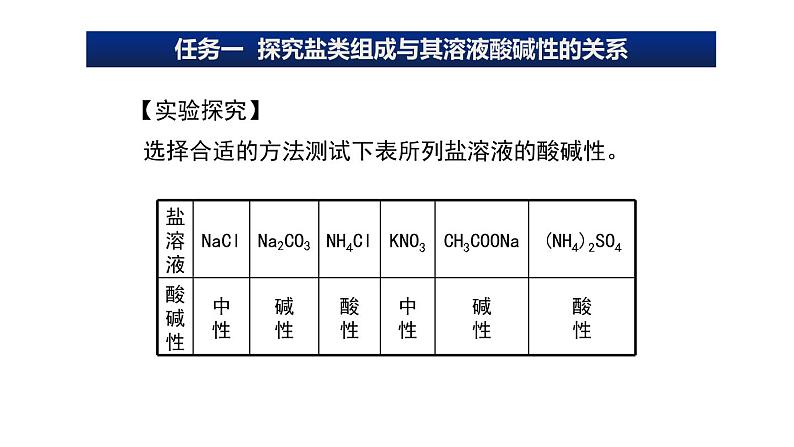
任务一 探究盐类组成与其溶液酸碱性的关系
选择合适的方法测试下表所列盐溶液的酸碱性。
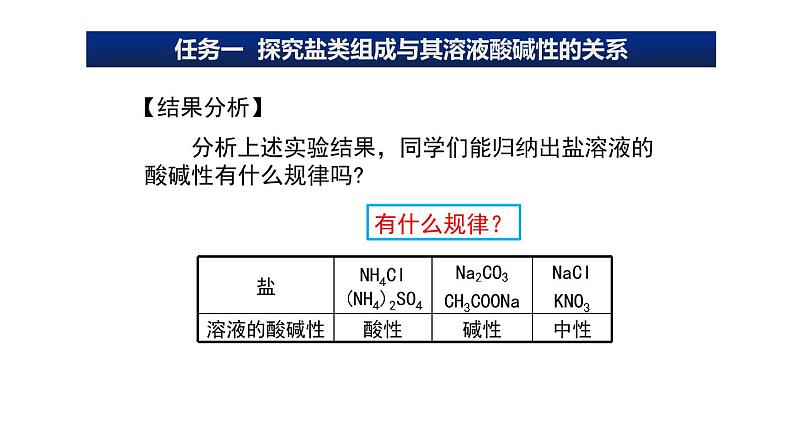
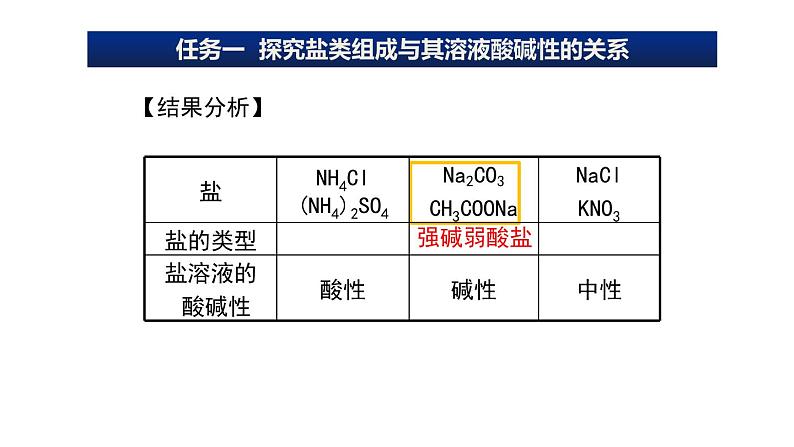
分析上述实验结果,同学们能归纳出盐溶液的酸碱性有什么规律吗?
活动1 分析NH4Cl溶液呈酸性的原因。
问题:什么原因造成不同类型的盐溶液中c(H+)和c(OH-)相对大小的差异呢?
任务二 探究盐溶液呈现不同酸碱性的原因
H2O H+ + OH-
活动2 请同学们分析CH3COONa溶液呈碱性的原因。
活动3 请同学们分析NaCl溶液呈中性的原因。
Na+、Cl-、H+、OH-
c(H+)=c(OH-)
1.概念 在溶液中盐电离出来的离子与水电离出 来的H+或OH–结合生成弱电解质的反应, 叫做盐类的水解。
2.实质 生成弱电解质,破坏、促进水的电离。
3.表达 盐 + 水 酸 + 碱
问题 FeCl3溶液呈酸性、碱性还是中性?
宏观 FeCl3为强酸弱碱盐,溶液呈酸性。
盐电离产生的Fe3+与溶液中的OH- 结合生成弱碱Fe(OH)3,使溶液中 c(H+)>c(OH-),溶液呈酸性。
有下列盐溶液:①KNO3 ②CuSO4 ③K2CO3 ④AlCl3 ⑤K2SO4 ⑥NaClO ⑦NH4Cl ⑧AgNO3呈酸性的是________(填序号,下同),呈碱性的是____,呈中性的是____。
解析 CuSO4、AgNO3、AlCl3、NH4Cl属于强酸弱碱盐,溶液呈酸性;K2CO3、NaClO属于强碱弱酸盐,溶液呈碱性;KNO3、K2SO4属于强酸强碱盐,溶液呈中性。
活动4 请同学们根据CH3COONa水解反应的离子方程式, 写出对应水解平衡的平衡常数表达式。
CH3COO-的水解程度与CH3COOH的强弱有什么关系?
当水解达到平衡时,溶液中还存在以下关系:
将以上关系代入K 的表达式,得到如下关系:
盐类水解程度的大小,主要由盐的性质所决定。
问题 25 ℃时, CH3COOH的电离常数 Ka=1.75×10-5, HClO的电离常数Ka=2.98×10-8, 比较同浓度时CH3COONa溶液与NaClO溶液碱性。
A- + H2O HA + OH-
CH3COO- + H2O CH3COOH + OH-
一般盐类水解的程度很小,通常不生成沉淀或气体
(1)盐类的水解过程促进了水的电离( )(2)酸式盐溶液一定显酸性( )(3)酸碱恰好中和生成的盐溶液一定显中性( )(4)盐溶液显酸性、碱性还是中性,取决于溶液中c(H+)与c(OH-)的相对大小( )(5)盐水解后,溶液不是呈酸性就是呈碱性( )
等物质的量浓度的下列物质的溶液,其pH由小到大的顺序排列正确的是_____________。①CH3COONa ②NaOH ③NaNO3 ④HCl ⑤Al2(SO4)3 ⑥CH3COOH
常温下,某浓度的NH4Cl溶液的pH为4,回答下列问题。(1)该氯化铵溶液中含氮元素的微粒有______________。(2)比较该溶液中的c(Cl-)___(填“>”“<”或“=”)c(NH4+) 。
(3)该氯化铵溶液中氢离子浓度__(填“>”“<”或“=”)pH=4盐酸中氢离子浓度 。(4)该氯化铵溶液中水电离的氢离子浓度__(填“>”“<”或“=”)pH=4盐酸中水电离的氢离子浓度。该氯化铵溶液中c水(H+)与pH=4盐酸中c水(H+)比值为___。
NH4+、NH3·H2O
相关课件
这是一份高中化学人教版 (2019)选择性必修1第三节 盐类的水解课前预习ppt课件,共35页。
这是一份化学选择性必修1第三节 盐类的水解精品课件ppt,共15页。PPT课件主要包含了CH3COOH,溶液显碱性,离子方程式,理论分析,NH3·H2O,溶液显酸性,盐类的水解,促进水的电离,生成弱电解质,NH4Cl等内容,欢迎下载使用。
这是一份人教版 (2019)选择性必修1第三节 盐类的水解多媒体教学课件ppt













