
高中化学人教版 (2019)选择性必修1第三节 金属的腐蚀与防护当堂检测题
展开A.金属被腐蚀的本质是M+nH2O=M(OH)n+n/2H2↑
B.马口铁(镀锡铁)镀层破损后被腐蚀时,首先是镀层被氧化
C.金属在一般情况下发生的电化学腐蚀主要是吸氧腐蚀
D.常温下,置于空气中的金属主要发生化学腐蚀
2.下列事实与电化学腐蚀无关的是( )
A.光亮的自行车钢圈不易生锈 B.黄铜(Cu-Zn合金)制的铜锣不易生锈
C.铜、铝电线一般不连接起来作导线 D.生铁比熟铁(几乎是纯铁)容易生锈
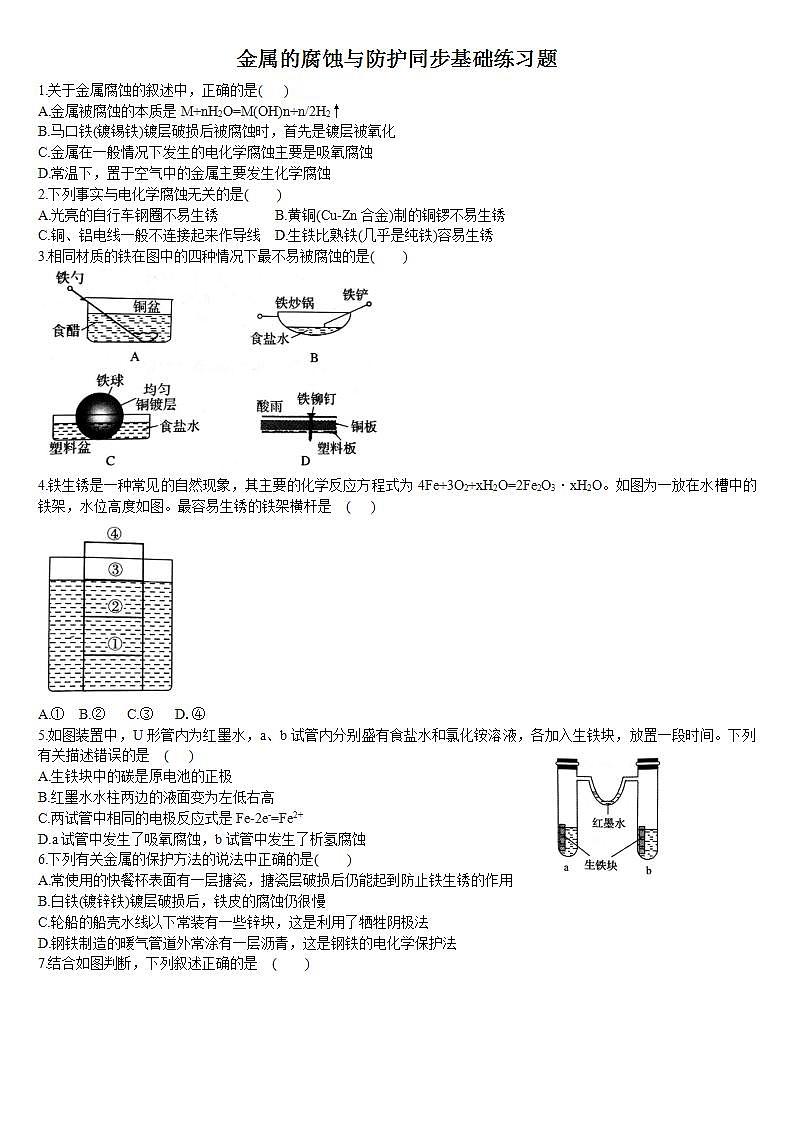
3.相同材质的铁在图中的四种情况下最不易被腐蚀的是( )
4.铁生锈是一种常见的自然现象,其主要的化学反应方程式为4Fe+3O2+xH2O=2Fe2O3·xH2O。如图为一放在水槽中的铁架,水位高度如图。最容易生锈的铁架横杆是 ( )
A.① B.② C.③ D.④
5.如图装置中,U形管内为红墨水,a、b试管内分别盛有食盐水和氯化铵溶液,各加入生铁块,放置一段时间。下列有关描述错误的是 ( )
A.生铁块中的碳是原电池的正极
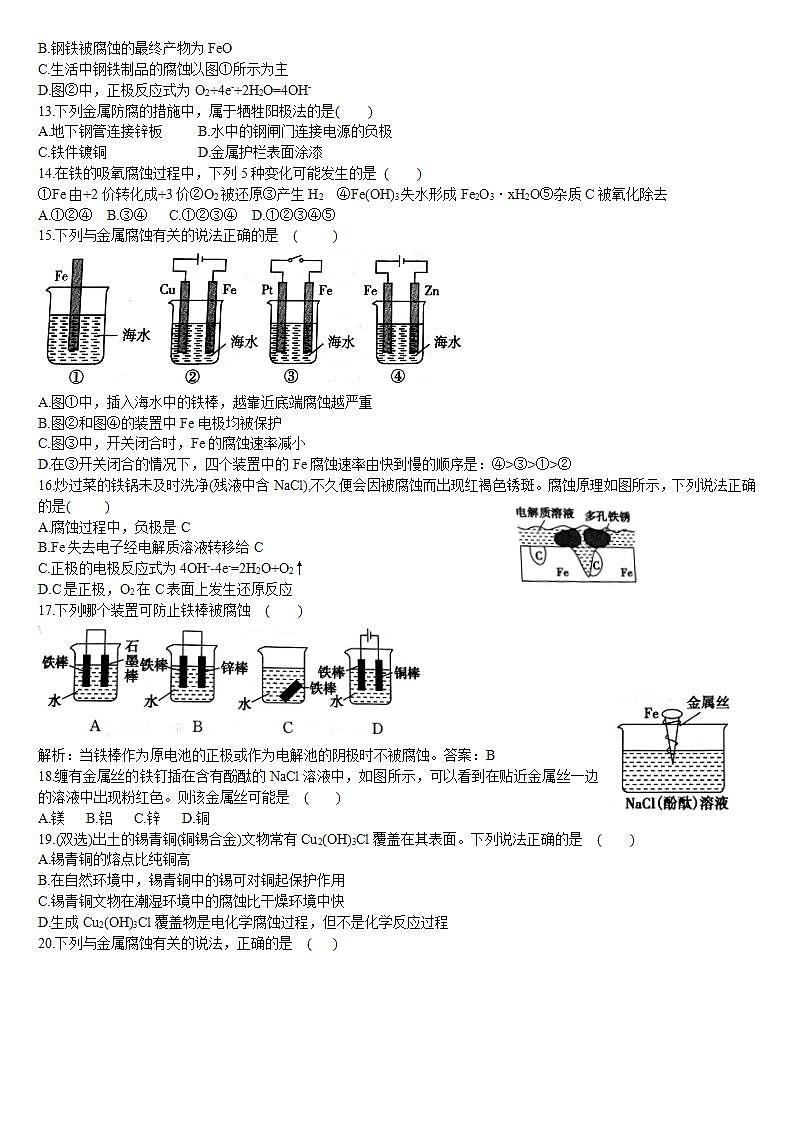
B.红墨水水柱两边的液面变为左低右高
C.两试管中相同的电极反应式是Fe-2e-=Fe2+
D.a试管中发生了吸氧腐蚀,b试管中发生了析氢腐蚀
6.下列有关金属的保护方法的说法中正确的是( )
A.常使用的快餐杯表面有一层搪瓷,搪瓷层破损后仍能起到防止铁生锈的作用
B.白铁(镀锌铁)镀层破损后,铁皮的腐蚀仍很慢
C.轮船的船壳水线以下常装有一些锌块,这是利用了牺牲阴极法
D.钢铁制造的暖气管道外常涂有一层沥青,这是钢铁的电化学保护法
7.结合如图判断,下列叙述正确的是 ( )
A.I和Ⅱ中正极均被保护 B.I和Ⅱ中负极反应均是Fe-2e-=Fe2+
C.I和Ⅱ中正极反应均是O2+2H2O+4e-=4OH- D.I和Ⅱ中分别加入少量K3[Fe(CN)6]溶液,均有蓝色沉淀
8.如图装置中,小试管内为红墨水,具支试管内盛有pH=4的雨水和生铁片。观察到:开始导管内液面下降,一段时间后导管内液面回升,略高于小试管液面。以下有关解释合理的是 ( )
A.生铁片中的碳是原电池的负极,发生还原反应
B.雨水酸性较强,生铁片仅发生析氢腐蚀
C.墨水回升时,碳极反应式为O2+2H2O+4e-=4OH-
D.具支试管中溶液pH逐渐减小
9.为了防止钢铁锈蚀,下列防护方法中正确的是( )
A.在精密机床的铁床上安装铜螺钉 B.在排放海水的钢铁闸门上用导线连接一块石墨,一同浸入海水中
C.在海轮舷上用铁丝系住锌板浸在海水里 D.在地下输油的铸铁管上接直流电源的正极
10.下列与金属腐蚀有关的说法正确的是( )
A.图a中,插入海水中的铁棒,越靠近底端腐蚀越严重
B.图b中,开关由M改置于N时,Cu-Zn合金的腐蚀速率减小
C.图c中,接通开关时Zn腐蚀速率增大,Zn上放出气体的速率也增大
D.图d中,Zn-MnO2干电池自放电腐蚀主要是由MnO2的氧化作用引起的
11.下列有关金属腐蚀的说法中正确的是 ( )
A.金属腐蚀指不纯金属与接触到的电解质溶液进行化学反应而损耗的过程
B.电化学腐蚀指在外加电流的作用下,不纯金属发生化学反应而损耗的过程
C.钢铁腐蚀最普遍的是吸氧腐蚀,负极吸收氧气,产物最终转化为铁锈
D.金属的电化学腐蚀和化学腐蚀本质相同,但电化学腐蚀伴有电流产生
12.如图所示的钢铁腐蚀中,下列说法正确的是 ( )
A.碳表面发生氧化反应
B.钢铁被腐蚀的最终产物为FeO
C.生活中钢铁制品的腐蚀以图①所示为主
D.图②中,正极反应式为O2+4e-+2H2O=4OH-
13.下列金属防腐的措施中,属于牺牲阳极法的是( )
A.地下钢管连接锌板 B.水中的钢闸门连接电源的负极
C.铁件镀铜 D.金属护栏表面涂漆
14.在铁的吸氧腐蚀过程中,下列5种变化可能发生的是 ( )
①Fe由+2价转化成+3价②O2被还原③产生H2 ④Fe(OH)3失水形成Fe2O3·xH2O⑤杂质C被氧化除去
A.①②④ B.③④ C.①②③④ D.①②③④⑤
15.下列与金属腐蚀有关的说法正确的是 ( )
A.图①中,插入海水中的铁棒,越靠近底端腐蚀越严重
B.图②和图④的装置中Fe电极均被保护
C.图③中,开关闭合时,Fe的腐蚀速率减小
D.在③开关闭合的情况下,四个装置中的Fe腐蚀速率由快到慢的顺序是:④>③>①>②
16.炒过菜的铁锅未及时洗净(残液中含NaCl),不久便会因被腐蚀而出现红褐色锈斑。腐蚀原理如图所示,下列说法正确的是( )
A.腐蚀过程中,负极是C
B.Fe失去电子经电解质溶液转移给C
C.正极的电极反应式为4OH--4e-=2H2O+O2↑
D.C是正极,O2在C表面上发生还原反应
17.下列哪个装置可防止铁棒被腐蚀 ( )
解析:当铁棒作为原电池的正极或作为电解池的阴极时不被腐蚀。答案:B
18.缠有金属丝的铁钉插在含有酚酞的NaCl溶液中,如图所示,可以看到在贴近金属丝一边的溶液中出现粉红色。则该金属丝可能是 ( )
A.镁 B.铝 C.锌 D.铜
19.(双选)出土的锡青铜(铜锡合金)文物常有Cu2(OH)3Cl覆盖在其表面。下列说法正确的是 ( )
A.锡青铜的熔点比纯铜高
B.在自然环境中,锡青铜中的锡可对铜起保护作用
C.锡青铜文物在潮湿环境中的腐蚀比干燥环境中快
D.生成Cu2(OH)3Cl覆盖物是电化学腐蚀过程,但不是化学反应过程
20.下列与金属腐蚀有关的说法,正确的是 ( )
A.图1中,铁钉易被腐蚀
B.图2中,滴加少量K3[Fe(CN)6]溶液,没有蓝色沉淀出现
C.图3中,燃气灶的中心部位容易生锈,主要是由于高温下铁发生化学腐蚀
D.图4中,用牺牲镁块的方法来防止地下钢铁管道的腐蚀,镁块相当于原电池的正极
21.一定条件下,碳钢腐蚀与溶液pH的关系如下,下列说法不正确的是 ( )
A.在pH>14溶液中,碳钢腐蚀的正极反应为O2+4H++4e-=2H2O
B.在pH<4溶液中,碳钢主要发生析氢腐蚀
C.在pH>6溶液中,碳钢主要发生吸氧腐蚀
D.在煮沸除氧气的碱性溶液中,碳钢腐蚀速率会加快
22.钢铁很容易生锈而被腐蚀,每年因腐蚀而损失的钢材占世界钢铁年产量的四分之一。
(1)钢铁腐蚀主要是吸氧腐蚀,该腐蚀过程中的电极反应,
负极:
正极:
(2)为了减小某水库的铁闸门被腐蚀的速率,可以采用图甲所示的方案,其中焊接在铁闸门上的固体材料R可以采用
(填字母)。
A.铜 B.钠 C.锌 D.石墨
(3)图乙所示的方案也可以减小铁闸门的腐蚀速率,其中铁闸门应该连接在直流电源的 极。
23.A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸,如图所示:
(1)A中反应的离子方程式是
(2)B中Sn极的电极反应式为 ,Sn极附近溶液的pH (填“增大”“减小”或“不变”)。
(3)C中被腐蚀的金属是 总反应离子方程式是
比较A、B、C中铁被腐蚀的速率由快到慢的顺序是
金属的腐蚀与防护同步基础练习题解析版
1.关于金属腐蚀的叙述中,正确的是( )
A.金属被腐蚀的本质是M+nH2O=M(OH)n+n/2H2↑
B.马口铁(镀锡铁)镀层破损后被腐蚀时,首先是镀层被氧化
C.金属在一般情况下发生的电化学腐蚀主要是吸氧腐蚀
D.常温下,置于空气中的金属主要发生化学腐蚀
解析:A中金属腐蚀的本质应为M-ne-=Mn+;B选项中Sn、Fe构成电化学腐蚀,铁比锡活泼,主要是Fe-2e-=Fe2+,铁先被腐蚀;常温下,空气中的金属主要发生电化学腐蚀中的吸氧腐蚀,难以和非金属氧化剂(Cl2、S)等反应发生化学腐蚀。答案:C
2.下列事实与电化学腐蚀无关的是( )
A.光亮的自行车钢圈不易生锈 B.黄铜(Cu-Zn合金)制的铜锣不易生锈
C.铜、铝电线一般不连接起来作导线 D.生铁比熟铁(几乎是纯铁)容易生锈
解析:B、C、D项均与原电池有关,能用电化学知识来解释,故选A。答案:A
3.相同材质的铁在图中的四种情况下最不易被腐蚀的是( )
解析:A中,食醋提供电解质溶液环境,勺和铜盆是相互接触的两个金属板,形成原电池,铁是活泼金属作负极;B中,食盐水提供电解质溶液环境,铁炒锅和铁铲都是铁碳合金,符合原电池形成的条件,铁是活泼金属作负极,碳作正极;D中,酸雨提供电解质溶液环境,铁铆钉和铜板分别作负、正极,形成原电池;在上述三种情况中,都是铁作负极,铁容易被腐蚀;C中,铜镀层将铁球覆盖,使铁被保护,所以铁不易被腐蚀。答案:C
4.铁生锈是一种常见的自然现象,其主要的化学反应方程式为4Fe+3O2+xH2O=2Fe2O3·xH2O。如图为一放在水槽中的铁架,水位高度如图。最容易生锈的铁架横杆是 ( )
A.① B.② C.③ D.④
解析:④处没有和电解质溶解接触,不能构成原电池,锈蚀较慢;①②③处虽都与电解质溶液接触,但①②处含O2较少,所以③处腐蚀最快。答案:C
5.如图装置中,U形管内为红墨水,a、b试管内分别盛有食盐水和氯化铵溶液,各加入生铁块,放置一段时间。下列有关描述错误的是 ( )
A.生铁块中的碳是原电池的正极
B.红墨水水柱两边的液面变为左低右高
C.两试管中相同的电极反应式是Fe-2e-=Fe2+
D.a试管中发生了吸氧腐蚀,b试管中发生了析氢腐蚀
答案:B
6.下列有关金属的保护方法的说法中正确的是( )
A.常使用的快餐杯表面有一层搪瓷,搪瓷层破损后仍能起到防止铁生锈的作用
B.白铁(镀锌铁)镀层破损后,铁皮的腐蚀仍很慢
C.轮船的船壳水线以下常装有一些锌块,这是利用了牺牲阴极法
D.钢铁制造的暖气管道外常涂有一层沥青,这是钢铁的电化学保护法
解析:A项中涂层破损后,铁直接暴露在空气中,因而搪瓷层不能对破损部分进行保护;B项中镀层破损后由于锌的金属性比铁强,与铁构成原电池,锌作负极,保护铁不被腐蚀;C选项应是牺牲阳极法;D项中是用沥青作涂层的涂层保护法。答案:B
7.结合如图判断,下列叙述正确的是 ( )
A.I和Ⅱ中正极均被保护 B.I和Ⅱ中负极反应均是Fe-2e-=Fe2+
C.I和Ⅱ中正极反应均是O2+2H2O+4e-=4OH- D.I和Ⅱ中分别加入少量K3[Fe(CN)6]溶液,均有蓝色沉淀
解析:两个装置均为原电池,负极都是活泼金属,根据原电池原理可知,原电池的正极金属受到保护,A项正确;I中负极为活泼金属Zn,B项错误;Ⅱ中是酸性溶液,电极反应中不能有OH-生成,C项错误;I中无Fe2+生成,不能生成铁氰化亚铁沉淀,D项错误。答案:A
8.如图装置中,小试管内为红墨水,具支试管内盛有pH=4的雨水和生铁片。观察到:开始导管内液面下降,一段时间后导管内液面回升,略高于小试管液面。以下有关解释合理的是 ( )
A.生铁片中的碳是原电池的负极,发生还原反应
B.雨水酸性较强,生铁片仅发生析氢腐蚀
C.墨水回升时,碳极反应式为O2+2H2O+4e-=4OH-
D.具支试管中溶液pH逐渐减小
解析:生铁片中的碳是原电池的正极,A错误;雨水酸性较强,开始时铁片发生析氢腐蚀,产生氢气,导管内液面下降,一段时间后铁片发生吸氧腐蚀,吸收氧气,导管内液面回升,B错误;墨水回升时,铁片发生吸氧腐蚀,碳极为正极,电极反应式为O2+2H2O+4e-=4OH-,C正确;铁片无论是发生析氢腐蚀还是吸氧腐蚀,具支试管内溶液pH均增大,D错误。答案:C
9.为了防止钢铁锈蚀,下列防护方法中正确的是( )
A.在精密机床的铁床上安装铜螺钉 B.在排放海水的钢铁闸门上用导线连接一块石墨,一同浸入海水中
C.在海轮舷上用铁丝系住锌板浸在海水里 D.在地下输油的铸铁管上接直流电源的正极
解析:A、B中形成的原电池都是铁作负极,加速钢铁腐蚀;D中铸铁管作阳极,加速腐蚀;C中锌比铁活泼,铁作正极。答案:C
10.下列与金属腐蚀有关的说法正确的是( )
A.图a中,插入海水中的铁棒,越靠近底端腐蚀越严重
B.图b中,开关由M改置于N时,Cu-Zn合金的腐蚀速率减小
C.图c中,接通开关时Zn腐蚀速率增大,Zn上放出气体的速率也增大
D.图d中,Zn-MnO2干电池自放电腐蚀主要是由MnO2的氧化作用引起的
解析:图a中,铁棒发生电化学腐蚀,靠近底端的部分与氧气接触少,腐蚀程度较轻,A项错误;图b中开关由M置于N,Cu-Zn作正极,腐蚀速率减小,B项正确;图c中接通开关时Zn作负极,腐蚀速率增大,但氢气在Pt上放出,C项错误;图d中干电池自放电腐蚀主要是Zn被氧化发生氧化反应引起的,D项错误。答案:B
11.下列有关金属腐蚀的说法中正确的是 ( )
A.金属腐蚀指不纯金属与接触到的电解质溶液进行化学反应而损耗的过程
B.电化学腐蚀指在外加电流的作用下,不纯金属发生化学反应而损耗的过程
C.钢铁腐蚀最普遍的是吸氧腐蚀,负极吸收氧气,产物最终转化为铁锈
D.金属的电化学腐蚀和化学腐蚀本质相同,但电化学腐蚀伴有电流产生
解析:化学腐蚀是金属直接发生化学反应而引起的损耗,电化学腐蚀是指不纯金属与接触到的电解质溶液形成原电池,发生氧化还原反应而损耗的过程,A项、B项均错误;钢铁发生吸氧腐蚀时,Fe作负极,O2在正极发生还原反应,C项错误;金属的化学腐蚀和电化学腐蚀均是金属失电子被氧化形成金属离子,而电化学腐蚀中有电流产生,D项正确。答案:D
12.如图所示的钢铁腐蚀中,下列说法正确的是 ( )
A.碳表面发生氧化反应
B.钢铁被腐蚀的最终产物为FeO
C.生活中钢铁制品的腐蚀以图①所示为主
D.图②中,正极反应式为O2+4e-+2H2O=4OH-
解析:结合图示可知①为析氢腐蚀,②吸氧腐蚀,两种腐蚀中Fe均为负极发生氧化反应,碳均作正极发生还原反应,A项错误;钢铁被腐蚀后最终转化为铁锈,其主要成分是为Fe2O3·xH2O,B项错误;生活中钢铁制品主要以图②的吸氧腐蚀为主,C项错误;图②中正极反应中O2被还原,转化为OH-,D项正确。答案:D
13.下列金属防腐的措施中,属于牺牲阳极法的是( )
A.地下钢管连接锌板 B.水中的钢闸门连接电源的负极
C.铁件镀铜 D.金属护栏表面涂漆
解析: A项中Fe、Zn、电解质溶液构成原电池,其中Zn和Fe分别作负极和正极,即Fe被保护起来,属于牺牲阳极法,符合题意;B项Fe作电解池的阴极,属于外加电流法,不符合题意;C项阻止Fe与空气、水接触,属于金属表面覆盖保护层防护,不符合题意;D项通过涂油漆,是在金属表面覆盖保护层的防护,不符合题意。答案:A
14.在铁的吸氧腐蚀过程中,下列5种变化可能发生的是 ( )
①Fe由+2价转化成+3价②O2被还原③产生H2 ④Fe(OH)3失水形成Fe2O3·xH2O⑤杂质C被氧化除去
A.①②④ B.③④ C.①②③④ D.①②③④⑤
解析:钢铁的吸氧腐蚀中,负极和正极反应式分别为Fe-2e-=Fe2+和O2+2H2O+4e-=4OH-,总反应为2Fe+O2+2H2O=2Fe(OH)2,Fe(OH)2还能被空气继续氧化,发生4Fe(OH)2+2H2O+O2=4Fe(OH)3,Fe(OH)3可失水生成Fe2O3·xH2O。结合上述分析,A项正确。答案:A
15.下列与金属腐蚀有关的说法正确的是 ( )
A.图①中,插入海水中的铁棒,越靠近底端腐蚀越严重
B.图②和图④的装置中Fe电极均被保护
C.图③中,开关闭合时,Fe的腐蚀速率减小
D.在③开关闭合的情况下,四个装置中的Fe腐蚀速率由快到慢的顺序是:④>③>①>②
解析:图①中,插入海水中的铁棒,在水和空气的交界处腐蚀最严重,A项错误;图②中铁作阴极,受到保护,图④中Fe电极是阳极,未受到保护,B项错误;图③中,开关闭合时Fe作负极,腐蚀速度加快,C项错误;在③开关闭合的情况下,①装置铁是一般的腐蚀,②装置铁为阴极,受到保护,③装置铁作负极,腐蚀加快,④装置是铁为阳极,加快腐蚀,根据腐蚀速率:电解池的阳极腐蚀>原电池负极的腐蚀>一般的腐蚀>原电池正极>电解池阴极,则四个装置中Fe腐蚀速率快慢顺序是:④>③>①>②,D项正确。答案:D
16.炒过菜的铁锅未及时洗净(残液中含NaCl),不久便会因被腐蚀而出现红褐色锈斑。腐蚀原理如图所示,下列说法正确的是( )
A.腐蚀过程中,负极是C
B.Fe失去电子经电解质溶液转移给C
C.正极的电极反应式为4OH--4e-=2H2O+O2↑
D.C是正极,O2在C表面上发生还原反应
解析:A项,铁锅中含有的Fe、C和电解质溶液构成原电池,活泼金属作负极,Fe易失电子,故腐蚀过程中,负极是Fe,错误;B项,原电池中电子由负极Fe经外电路向正极C流动,在电解质溶液中依靠离子的移动导电,错误;C项,该原电池中C作正极,正极上氧气得电子发生还原反应,电极反应式为O2+2H2O+4e-=4OH-,错误;D项,C是正极,O2在C表面上发生还原反应,正确。答案:D
17.下列哪个装置可防止铁棒被腐蚀 ( )
解析:当铁棒作为原电池的正极或作为电解池的阴极时不被腐蚀。答案:B
18.缠有金属丝的铁钉插在含有酚酞的NaCl溶液中,如图所示,可以看到在贴近金属丝一边的溶液中出现粉红色。则该金属丝可能是 ( )
A.镁 B.铝 C.锌 D.铜
解析:金属丝一边溶液出现粉红色,说明金属丝附近产生OH-,即正极反应式:2H2O+O2+4e-=4OH-,因此金属丝的活泼性比Fe差,铜符合题目要求。答案:D
19.(双选)出土的锡青铜(铜锡合金)文物常有Cu2(OH)3Cl覆盖在其表面。下列说法正确的是 ( )
A.锡青铜的熔点比纯铜高
B.在自然环境中,锡青铜中的锡可对铜起保护作用
C.锡青铜文物在潮湿环境中的腐蚀比干燥环境中快
D.生成Cu2(OH)3Cl覆盖物是电化学腐蚀过程,但不是化学反应过程
解析:A项,锡青铜为合金,合金的熔点低于它的各成分金属的熔点,错误;B项,由于锡比铜活泼,在发生电化学腐蚀时,锡失电子保护铜,正确;C项,潮湿环境更易发生电化学腐蚀,加快金属的腐蚀,正确;D项,电化学腐蚀过程的实质是氧化还原反应,为化学过程,错误。答案:BC
20.下列与金属腐蚀有关的说法,正确的是 ( )
A.图1中,铁钉易被腐蚀
B.图2中,滴加少量K3[Fe(CN)6]溶液,没有蓝色沉淀出现
C.图3中,燃气灶的中心部位容易生锈,主要是由于高温下铁发生化学腐蚀
D.图4中,用牺牲镁块的方法来防止地下钢铁管道的腐蚀,镁块相当于原电池的正极
解析:A项,图1中,铁钉处于干燥环境,不易被腐蚀;B项,负极反应式为Fe-2e-=Fe2+,Fe2+与K3[Fe(CN)6反应生成Fe3[Fe(CN)6]2蓝色沉淀;D项为牺牲阳极的阴极保护法,镁块相当于原电池的负极。答案:C
21.一定条件下,碳钢腐蚀与溶液pH的关系如下,下列说法不正确的是 ( )
A.在pH>14溶液中,碳钢腐蚀的正极反应为O2+4H++4e-=2H2O
B.在pH<4溶液中,碳钢主要发生析氢腐蚀
C.在pH>6溶液中,碳钢主要发生吸氧腐蚀
D.在煮沸除氧气的碱性溶液中,碳钢腐蚀速率会加快
解析:A项,pH>14的溶液为碱性,正极反应式为O2+2H2O+4e-=4OH-,故A符合题意;B项,pH<4溶液为酸性溶液,碳钢主要发生析氢腐蚀,正极反应式为2H++2e-=H2↑,故B不符合题意;C项,pH>6溶液中,碳钢主要发生吸氧腐蚀,正极反应式为O2+2H2O+4e-=4OH-,故C不符合题意;D项在碱性溶液中碳钢发生吸氧腐蚀,煮沸除氧气后,腐蚀速率会减慢,故D不符合题意。答案:A
22.钢铁很容易生锈而被腐蚀,每年因腐蚀而损失的钢材占世界钢铁年产量的四分之一。
(1)钢铁腐蚀主要是吸氧腐蚀,该腐蚀过程中的电极反应,
负极:
正极:
(2)为了减小某水库的铁闸门被腐蚀的速率,可以采用图甲所示的方案,其中焊接在铁闸门上的固体材料R可以采用
(填字母)。
A.铜 B.钠 C.锌 D.石墨
(3)图乙所示的方案也可以减小铁闸门的腐蚀速率,其中铁闸门应该连接在直流电源的 极。
参考答案:(1) Fe-2e-=Fe2+ O2+2H2O+4e-=4OH- (2)C (3)负
解析:(1)钢铁吸氧腐蚀中,Fe作负极被氧化为Fe2+,O2在正极被还原为OH-。(2)图甲为牺牲阳极法则R为比Fe活泼的金属,即C项符合。(3)图乙为外接电流法为减小铁闸门的腐蚀、则铁闸门应和直流电源负极相连。
23.A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸,如图所示:
(1)A中反应的离子方程式是
(2)B中Sn极的电极反应式为 ,Sn极附近溶液的pH (填“增大”“减小”或“不变”)。
(3)C中被腐蚀的金属是 总反应离子方程式是
比较A、B、C中铁被腐蚀的速率由快到慢的顺序是
参考答案:(1)Fe+2H+=Fe2++H2↑(2)2H++2e-=H2↑ 增大 (3)Zn Zn+2H+=Zn2++H2↑ B>A>C
解析:(1)A中发生Fe与稀硫酸间的置换反应。(2)B中Sn为正极,H+放电生成H2:2H++2e-=H2↑,导致Sn附近溶液
中c(H+)减小,pH增大。(3)C中Zn为负极被腐蚀。
pH
2
4
6
6.5
8
13.5
14
腐蚀快慢
较快
慢
较快
主要产物
Fe2+
Fe3O4
Fe2O3
FeO2-
pH
2
4
6
6.5
8
13.5
14
腐蚀快慢
较快
慢
较快
主要产物
Fe2+
Fe3O4
Fe2O3
FeO2-
人教版 (2019)选择性必修1第三节 金属的腐蚀与防护优秀复习练习题: 这是一份人教版 (2019)选择性必修1<a href="/hx/tb_c4002436_t7/?tag_id=28" target="_blank">第三节 金属的腐蚀与防护优秀复习练习题</a>,共11页。试卷主要包含了关于金属腐蚀的叙述中,正确的是,下列事实与电化学腐蚀无关的是,结合如图判断,下列叙述正确的是等内容,欢迎下载使用。
高中化学人教版 (2019)选择性必修1第三节 金属的腐蚀与防护复习练习题: 这是一份高中化学人教版 (2019)选择性必修1第三节 金属的腐蚀与防护复习练习题,共13页。试卷主要包含了3金属的腐蚀与防护同步练习题等内容,欢迎下载使用。
化学选择性必修1第三节 金属的腐蚀与防护课时训练: 这是一份化学选择性必修1第三节 金属的腐蚀与防护课时训练,共7页。试卷主要包含了3金属的腐蚀与防护同步练习题等内容,欢迎下载使用。














