

高中化学必修一 1.1.2 物质的转化学案
展开1.2 物质的转化(学案)
1、深入理解对化学物质进行分类的意义,能够区分常见的酸、碱、盐等化合物
2、了解酸、碱、盐的通性,能够判断常见酸、碱、盐的反应
3、了解不同类别物质之间的转化,能够分析简单物质的转化途径
1、酸、碱、盐的通性;
2、简单物质的转化
复习初中化学的基本知识,分析回答下列问题:
1、初中学习的常见酸有
2、初中学习的常见碱有
3、初中学习的常见盐有
4、初中学习的常见酸性氧化物有
5、初中学习的常见碱性氧化物有
同时请同学们思考这些类物质之间是否能发生转化。
二、物质的转化
按照氧化物的性质可以将氧化物分为 ,酸性氧化物应该具有的化学性质是 。已知SO3是一种酸性氧化物,其与氢氧化钠溶液反应的化学反应方程式为
1、酸碱盐的化学性质:
酸的通性(以盐酸为例):
酸的通性 | 生成物 | 实例 |
|
|
|
|
|
|
|
|
|
|
|
|
碱的通性:
碱的通性 | 生成物 | 实例 |
|
|
|
|
|
|
|
|
|
盐的通性:
盐的通性 | 生成物 | 实例 |
|
|
|
|
|
|
|
|
|
【想一想】那么为什么酸、碱或者盐具有相似的化学性质?
【想一想】上述的酸碱盐之间的转化涉及的都是什么反应类型?
2、物质的转化:
【想一想】将金属单质钙转化为盐(硫酸钙),应该经过怎样的流程呢?
如上的流程,如果抽象为不同类别物质之间的转化,则表示的转化过程为:
仿照上面的流程,将非金属单质(碳)转化为盐(碳酸钠)的流程为:
如上的流程表示的类别转化过程为:
【练习】根据上面的转化过程,写出非金属单质S到对应盐Na2SO3的转化过程。
【练习】以下表示的是碳及其化合物的转化关系,其中涉及的基本反应类型依次是( )
CCO2H2CO3CaCO3CO2
A.化合、置换、分解、复分解 B.置换、复分解、化合、分解
C.置换、化合、分解、复分解 D.置换、化合、复分解、分解
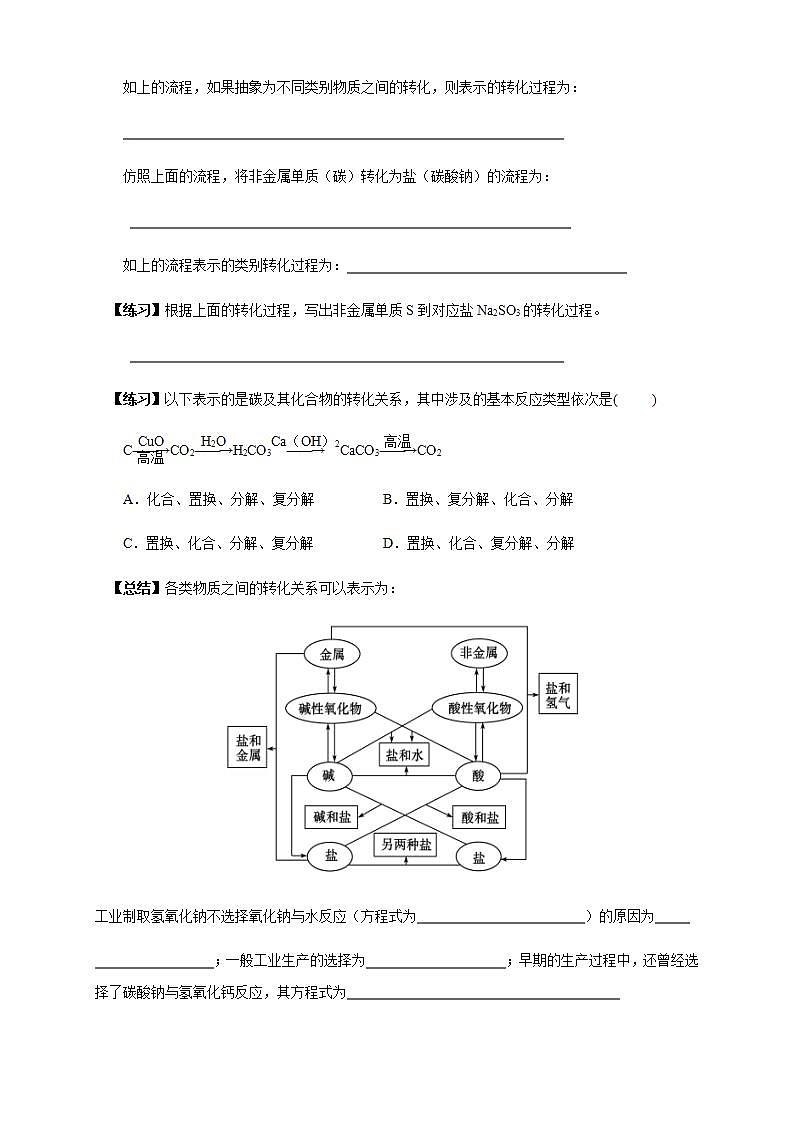
【总结】各类物质之间的转化关系可以表示为:
工业制取氢氧化钠不选择氧化钠与水反应(方程式为 )的原因为
;一般工业生产的选择为 ;早期的生产过程中,还曾经选择了碳酸钠与氢氧化钙反应,其方程式为
1.盐是一类常见的物质,下列物质通过一定反应可直接形成盐的是( )
①金属单质 ②碱性氧化物 ③碱 ④非金属单质 ⑤酸性氧化物 ⑥酸
A.①②③ B.①④⑥ C.②⑤⑥ D.全部
2.给如图中①~⑤选择适当的物质,使有连线的两物质能发生反应。供选择的试剂有稀硫酸、二氧化碳、铜片、食盐、生石灰、一氧化碳、纯碱、铁片和木炭粉。下列说法正确的是( )
A.单质①为铜 B.氧化物④为CO2
C.①与②反应为置换反应 D.③与④反应为复分解反应
3.现有碳、二氧化碳、氧化铁、石灰水、稀硫酸和纯碱溶液等6种物质。
①除稀硫酸外,试分别将其他物质的化学式填入如图相应的5个圆圈内,使每个圆圈内的物质都能与相邻物质发生反应。
②用化学方程式将它们与相邻物质间发生的反应表示出来:
________________________________________________________________________、
________________________________________________________________________、
________________________________________________________________________、
________________________________________________________________________、
________________________________________________________________________、
________________________________________________________________________。
4.在稀硫酸、二氧化碳、铜片、食盐、生石灰、一氧化碳、纯碱、铁片和木炭粉9种物质间存在下面的相互关系,选择①~⑤中适当的物质,使有连线的两物质能发生反应。
(1)请推断它们的化学式分别为:
①________;②________;③________;④________;⑤________。
(2)写出下列序号之间的化学方程式:
①和②:________________________________________________________________;
②和④:________________________________________________________________;
②和⑤:________________________________________________________________;
③和④:________________________________________________________________。
【知识点填空答案】
酸性氧化物和碱性氧化物;与碱反应只生成盐和水;SO3+ 2NaOH = Na2SO4+ H2O;
酸的通性:
酸的通性 | 生成物 | 实例 |
与碱反应 | 盐和水 | NaOH + HCl = NaCl + H2O |
与活泼金属单质反应 | 盐和氢气 | Fe + 2HCl = FeCl2 + H2↑ |
与碱性氧化物反应 | 盐和水 | CaO + 2HCl = CaCl2 + H2O |
与某些盐反应 | 盐和酸 | Na2CO3 + 2HCl = 2NaCl + CO2↑ + H2O |
碱的通性:
碱的通性 | 生成物 | 实例 |
与酸反应 | 盐和水 | NaOH + HCl = NaCl + H2O |
与酸性氧化物反应 | 盐和水 | 2NaOH + CO2 = Na2CO3 + H2O |
与某些盐反应 | 盐和碱 | 2NaOH + MgCl2 = Mg(OH)2↓ + 2NaCl |
盐的通性:
碱的通性 | 生成物 | 实例 |
某些盐与酸反应 | 盐和酸 | Na2CO3 + 2HCl = 2NaCl + CO2↑ + H2O |
某些盐与碱反应 | 盐和碱 | MgCl2 + 2NaOH = Mg(OH)2↓ + 2NaCl |
某些盐与某些盐反应 | 盐和盐 | Na2CO3 + CaCl2 = 2NaCl + CaCO3↓ |
因为具有相似的化学组成,例如:酸溶液中都有氢离子,碱溶液中都有氢氧根离子,碳酸盐溶液中都有碳酸根离子等;复分解反应;;金属单质→碱性氧化物→碱→盐;;非金属单质→酸性氧化物→酸→盐;;D;Na2O + H2O = 2NaOH ;电解饱和食盐水;Na2CO3 + 2Ca(OH)2 = 2NaOH + CaCO3↓;
【检测反馈答案】
1.D 2.C
3.①
②H2SO4+Na2CO3===Na2SO4+CO2↑+H2O
Na2CO3+Ca(OH)2===CaCO3↓+2NaOH
Ca(OH)2+CO2===CaCO3↓+H2O
CO2+C2CO
2Fe2O3+3C4Fe+3CO2↑
Fe2O3+3H2SO4===Fe2(SO4)3+3H2O(其他答案合理也可)
4.(1)Fe H2SO4 CO2 CaO Na2CO3
(2)Fe+H2SO4===FeSO4+H2↑
CaO+H2SO4===CaSO4+H2O
Na2CO3+H2SO4===Na2SO4+CO2↑+H2O
CO2+CaO===CaCO3
高中化学必修一 专题1.1.2 物质的转化原卷版): 这是一份高中化学必修一 专题1.1.2 物质的转化原卷版),共3页。
高中化学必修一 专题1.1.2 物质的转化解析版): 这是一份高中化学必修一 专题1.1.2 物质的转化解析版),共6页。
高中化学必修一 专题1.1.2 物质的转化备作业))原卷版): 这是一份高中化学必修一 专题1.1.2 物质的转化备作业))原卷版),共4页。













