






高中化学苏教版 (2019)必修 第一册第二单元 溶液组成的定量研究教学课件ppt
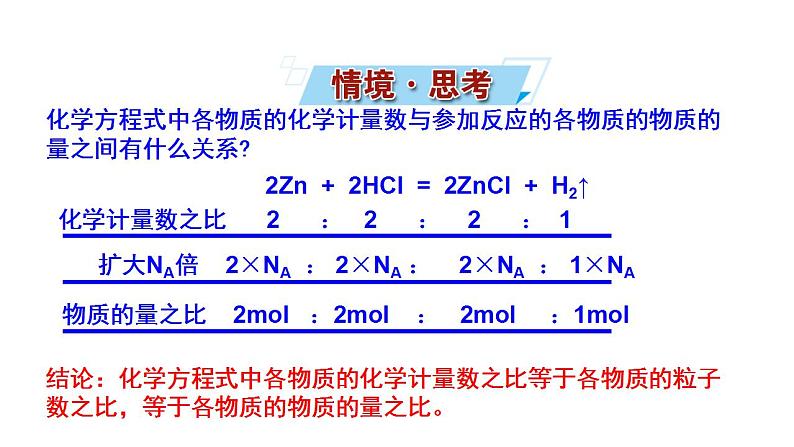
展开化学计量数之比 2 : 2 : 2 : 1
物质的量之比 2ml :2ml : 2ml :1ml
扩大NA倍 2×NA : 2×NA : 2×NA : 1×NA
2Zn + 2HCl = 2ZnCl + H2↑
结论:化学方程式中各物质的化学计量数之比等于各物质的粒子数之比,等于各物质的物质的量之比。
化学方程式中各物质的化学计量数与参加反应的各物质的物质的量之间有什么关系?
1.掌握物质的量、物质的量浓度、气体摩尔体积应用于化学方程式的计算方法和格式。 2.加深对物质的量、物质的量浓度、气体摩尔体积等概念的理解,以及对化学反应规律的认识。
1.认识物质的量在微观粒子数与宏观物理量计算的作用,能够以物质的量为中心进行化学计量的计算。(宏观辨识与微观探析)2.建立溶液组成的简单模型,通过对溶质的质量分数与物质的量浓度的对比和换算,提高运用比较、归纳、推理的能力。(证据推理与模型认知)
3.从物质的量的角度认识化学反应中的定量关系,建立化学反应中物质质量与物质的量的联系,能够以物质的量为中心进行化学反应的相关计算。(变化观念与平衡思想)4.能基于物质的量在化学反应中的计算,建立化学反应计算的思维模型,形成化学反应计算的基本规则。(证据推理与模型认知)
①2 ml NaOH配成200mL溶液,其物质的量浓度为____ml·L-1。②标准状况下,22.4L HCl溶于水配成0.5L盐酸,其物质的量浓度为__ml·L-1。③物质的量浓度为2ml·L-1的硫酸溶液500mL,含硫酸的物质的量为___ml。
2、溶液中溶质微粒的浓度关系的计算
所以: cH2SO4: cH+: cSO42- =1:2:1溶液中微粒物质的量浓度之比等于角标之比
求微粒物质的量浓度应是物质的量浓度乘角标
0.5 ml·L-1 H2SO4 溶液, H+的物质的量浓度为_______ml·L-1, SO42-的物质的量浓度为_______ ml·L-1。
1、上述中与50mL 3ml·L-1 KCl溶液n(Cl-)相同的是
2、上述中与50mL 3ml·L-1 KCl溶液C(Cl-)相同的是
A、 50mL 1ml·L-1 KCl溶液 B、 150mL 1ml·L-1 KCl溶液C、 10mL 3ml·L-1 NaCl溶液 D、 50mL 1ml·L-1 AlCl3溶液
98%的硫酸,已知其密度为1.84 g·cm-3,求其物质的量浓度?
3、溶液中溶质的质量分数与物质的量浓度的换算
溶质(其摩尔质量为M)的质量分数为ω ,密度为ρ的某溶液中,其溶质的物质的量浓度的表达式:
结论:溶液稀释前后溶质的物质的量不变 nB=c浓V浓= c稀V稀
②将4gNaOH溶解在10mL水中,再稀释成1L,从中取出10mL,则取出的10mL溶液中NaOH的物质的量浓度是( ) A.1ml·L-1 ·L-1 ·L-1 D.10ml·L-1
4、有关溶液稀释和浓缩的计算
①现欲用12ml·L-1的浓HNO3配制3ml·L-1的HNO3 100mL,则需取用多少毫升的浓HNO3 ?
5.有关化学反应的计算-确定量的关系
结论:各物质反应的n之比=系数之比
实验室为确定一瓶稀盐酸的浓度,用0.1ml·L-1NaOH溶液中和25mL该盐酸,当酸与碱恰好完全反应时,消耗NaOH溶液24.5mL,试求该盐酸的物质的量浓度。
解析: n(NaOH)=cv=2.45 · 10-3ml NaOH + HCl═NaCl + H2O 1 1 2.45 · 10-3ml n(HCl)所以n(HCl)=2.45 · 10-3ml c(HCl)=n/V=0.098ml·L-1
6、气体溶于水CB的计算
标准状况下,aLHCl溶于1000g水中,得溶液密度为bg·cm-3,求cHCl?
m(aq)=m(溶质)+m(溶剂)
7.溶液电中性:电荷守恒的计算
溶液呈电中性,即:阳离子所带正电荷总数(n/c)=阴离子所带负电荷总数(n/c)
在NaCl、MgCl2、MgSO4 形成的混合溶液中,c(Na+)=0.1ml·L-1,c(Mg2+)=0.25ml·L-1,c(Cl-)=0.2ml·L-1,则c(SO42-)为 。
1、1ml·L-1的Na2SO4溶液是( )A、溶液中含有1ml Na2SO4B、2L溶液中含有142g Na2SO4C、1ml Na2SO4溶于1L水中D、将322gNa2SO4·10H2O溶于少量水后再稀释成1000mL
2、配制480mL 1ml·L-1 CuSO4 溶液,下列方法正确的是( )
A. 称取80g 无水CuSO4 溶于500mL水B. 称取125g CuSO4·5H2O 溶于500mL水C. 称取80g CuSO4·5H2O配成500mL溶液D. 称取80g 无水CuSO4配成500mL溶液
高中化学鲁科版 (2019)必修 第一册第2章 元素与物质世界第2节 电解质的电离 离子反应评课ppt课件: 这是一份高中化学鲁科版 (2019)必修 第一册<a href="/hx/tb_c4002542_t3/?tag_id=26" target="_blank">第2章 元素与物质世界第2节 电解质的电离 离子反应评课ppt课件</a>,共29页。PPT课件主要包含了由红色变浅至无色,白色沉淀,离子方程式的书写方法,硫酸的电离方程式为等内容,欢迎下载使用。
高中苏教版 (2019)第二单元 溶液组成的定量研究图片课件ppt: 这是一份高中苏教版 (2019)第二单元 溶液组成的定量研究图片课件ppt,共12页。PPT课件主要包含了化学反应的计量关系,有关浓度的计算,解题思路等内容,欢迎下载使用。
苏教版 (2019)必修 第一册第二单元 溶液组成的定量研究精品ppt课件: 这是一份苏教版 (2019)必修 第一册第二单元 溶液组成的定量研究精品ppt课件,共19页。PPT课件主要包含了学习目标,答案378体积,答案A,答案C,答案B等内容,欢迎下载使用。













