












高中苏教版 (2019)第二单元 溶液组成的定量研究优秀ppt课件
展开2.2.1 物质的量浓度
教材从实际生产中的量应用引入新课:物质的量浓度,介绍了“物质的量浓度”的概念,同时把“配制一定物质的量浓度的溶液“做为溶液定量分析的基础实验,让学生知道在定量分析中要从配制一定浓度的溶液入手。通过“化学反应的计算”让学生学会按照化学反应的量的关系进行定量计算,提高学生解决实际化学问题的能力。
1、宏观辨识与微观探析 :学会配制一定物质的量浓度的溶液的实验方法和容量瓶的使用方法。
2、证据推理与模型认知:通过与一定质量分数溶液的配制的比较,提高知识迁移、比较、归纳、推理的能力。
3、科学探究与创新意识:通过精度较高定容仪器的使用,增强实验创新能力。
4、科学精神与社会责任:感知从实际出发解决问题的科学态度,培养学生科学严谨的实验态度。
1、物质的量浓度的含义,计算公式及在化学反应中有关计算
2、学会容量瓶的使用,掌握一定物质的量浓度溶液配制的实验操作和误差分析
多媒体课件、容量瓶、”配制一定物质的量浓度碳酸钠溶液“视频
知识回顾
初中我们已经学习了溶液的质量百分比。请思考:
1、计算溶液质量百分比的表达式为__________________________
2、怎样配制100克质量分数为10%的NaOH溶液?
引入新课:
定量研究是化学研究的常用方法,溶液的质量分数就是定量研究溶液组成的一种方法。化学反应中反应物之间物质的量的比是一定的。当反应在溶液中进行制要确定反应物的物质的量,就必须知道溶液的组成。例如:酸和碱恰好完全中和时,酸溶液提供的H+和碱溶液提供的0H-的物质的量之比是1:1。在实验室中,我们需要知道一定体积的酸碱溶液中所含的酸和碱的物质的量,才能了解反应能否恰好完全进行。
今天我们就来学习一种新的表示溶液组成的物理量-----物质的量浓度
板书:一、物质的量浓度
1、定义:单位体积溶液中所含溶质B的物质的量。
2、符号:cB 单位:mol▪L-1
3、表达式:cB = nB/V
讲解:物质的量浓度是表示溶液组成的一种方法,指的是一定体积溶液中所含溶质的物质的量。
课堂练习:
例1:将53.0gNa2CO3溶解在水中,配成500mL溶液,所得溶液中溶质的物质的量浓度是多少?
学以致用:
现要配制250mL0.200mol/LNaCl溶液,需要NaCl多少克?
学生练习,教师巡视,指导指正.
思考:实验室怎样配制一定物质的量浓度的溶液呢?怎样控制溶液的体积呢?
讲解:实验室使用容量瓶来配制一定体积、一定物质的量浓度的溶液。
板书:二、一定物质的量溶液的配制
1、仪器:容量瓶(PPT展示)
2、规格:50mL、100mL、250mL、500mL、1000mL
讲解:容量瓶使用注意事项
(1)使用温度一般为20℃,容量瓶要在容量瓶所标记的温度下使用。
(2)不能溶解固体;不能稀释浓溶液;不能加热;不能作反应容器;不能长期贮存溶液。
(3)瓶颈上有一刻度线以标示体积。当溶液的凹液面正好与刻度线相切时,容量瓶中溶液的体积正好等于容量瓶的规格。
(4)容量瓶使用前要检验是否漏液。
PPT播放:容量瓶的检漏
小结:加水→塞瓶塞→倒立→查漏→正立→瓶塞旋转180°→倒立→查漏。
提问1:用某固体物质配制一定质量分数的溶液有哪些步骤?
学生回答:计算→称量→溶解(玻璃棒搅拌)→装瓶(贴好标签)
提问2:怎样配制500mL0.1mol/L的Na2CO3溶液?
PPT播放视频:配制500mL0.1mol/L的Na2CO3溶液
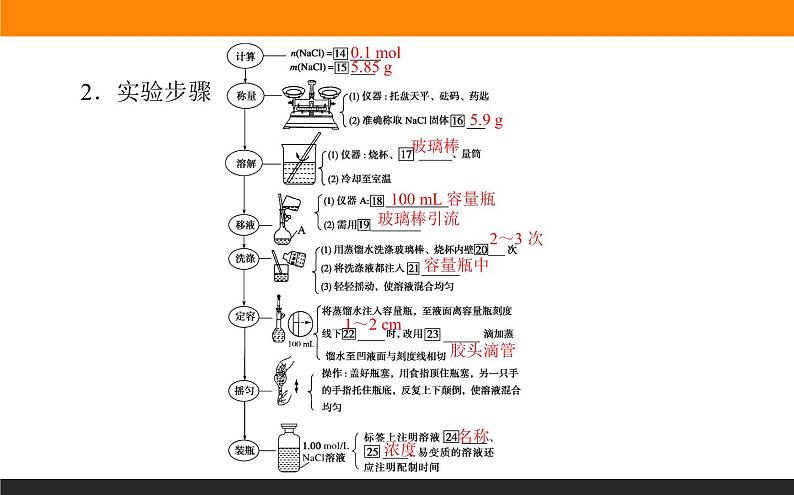
板书:3、实验步骤:
PPT展示:
过度:化学反应中参加反应的各物质的物质的量之比等于化学方程式中对应物质的化学计量数之比,因此可以根据该比例来代入已知物质的物理量,从而求出未知物质的物理量。在化学实验中,我们常常会面对未知浓度的溶液,为简便地确定其物质的量浓度,可以借助某个特定化学反应中消耗的溶质的物质的量来进行计算。
课堂检测:
某学生计划用12 mol·L-1的浓盐酸配制0.10 mol·L-1的稀盐酸450 mL,回答下列问题:
(1)实验过程中,不必使用的是________(填字母)。
A.托盘天平 B.量筒
C.容量瓶 D.250 mL烧杯
E.胶头滴管 F.500 mL试剂瓶
(2)除上述仪器可使用外,还缺少的仪器是________。
(3)量取浓盐酸的体积为______ mL,应选用的量筒规格为________。
(4)配制时应选用的容量瓶规格为______________。
实验教学是化学学科实施科学教育重要途径。 本节课从学生已知问题出发,对定量实验仪器设计、定量实验操作规范和严谨科学态度的培养三方面开展教学,通过学生知识迁移、实验探究、自主创新、合作学习,达成教学目标。
高中化学苏教版 (2019)必修 第一册第二单元 溶液组成的定量研究优秀ppt课件: 这是一份高中化学苏教版 (2019)必修 第一册第二单元 溶液组成的定量研究优秀ppt课件,共39页。
高中化学苏教版 (2019)必修 第一册专题2 研究物质的基本方法第二单元 溶液组成的定量研究示范课ppt课件: 这是一份高中化学苏教版 (2019)必修 第一册专题2 研究物质的基本方法第二单元 溶液组成的定量研究示范课ppt课件,共38页。
2020-2021学年第二单元 溶液组成的定量研究多媒体教学课件ppt: 这是一份2020-2021学年第二单元 溶液组成的定量研究多媒体教学课件ppt,共60页。PPT课件主要包含了物质的量,mol·L-1,刻度线,06g,玻璃棒,容量瓶,烧杯内壁,洗涤的溶液,蒸馏水,~2cm等内容,欢迎下载使用。













