






高中化学鲁科版 (2019)必修 第一册第2章 元素与物质世界第2节 电解质的电离 离子反应评课ppt课件
展开电解质在溶于水时会发生电离产生自由移动的离子,因此它们在水溶液中所发生的反应一定与这些离子有关。
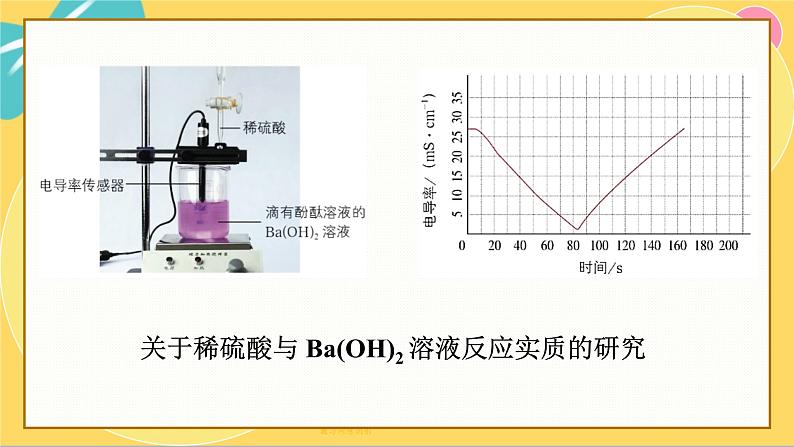
稀硫酸与Ba(OH)2溶液反应的实质你已经知道,硫酸和氢氧化钡都是电解质。那么,它们在溶于水时分别能电离出哪些离子?这些离子之间能发生怎样的反应?利用图所示装置进行实验:向0.01ml·L-l Ba(OH)2溶液中滴入几滴酚献溶液,然后向 Ba(OH)2溶液中匀速逐滴加入0.2 ml·L-l H2SO4溶液,注意观察溶液中的现象和溶液电导率的变化。
关于稀硫酸与 Ba(OH)2 溶液反应实质的研究
像上述反应这样,在溶液中有离子参加的化学反应称为离子反应。 溶液中的某种或某些离子的浓度发生改变时,离子反应才能发生。酸、碱和盐在溶液中发生复分解反应时会生成难溶的物质 (沉淀)、难电离的物质(如 H2O)或挥发性的物质(气体),导致溶液中某些离子的浓度降低。因此,复分解反应都属于离子反应。
离子反应可以用离子方程式表示。例如,NaOH 溶液与稀盐酸发生的反应属于离子反应,其离子方程式为:
OH-+ H+ === H2O
现以稀硫酸与 Ba(OH)2 溶液的反应为例说明离子方程式的书写方法
稀硫酸与 Ba(OH)2溶液的反应
1.明确反应物在溶液中的主要存在形式及微粒间的数量关系,分别用离子符号或化学式表示。分析反应物在水溶液中的主要存在形式。对于易溶于水且易电离的反应物(如强酸、强碱、可溶性盐),根据其电离方程式明确溶液中存在的离子,写出它们的离子符号;对于其他反应物,则用它们的化学式来表示。
溶液中存在 Ba2+ 和 OH-,两种离子的物质的量之比为 1:2。
2.确定发生化学反应的微粒、产物及其数量关系判断哪些微粒能够相互作用,使溶液中某种或某些离子的浓度改变。推测反应后的产物,用离子符号或化学式表达产物在水溶液中的存在形式,并标注发生反应的微粒间的数量关系。复分解反应中生成的难溶、难电离或具有挥发性的物质用化学式表示。
稀硫酸与 Ba(OH)2 溶液发生复分解反应:
3.写出离子方程式并配平将相互作用的微粒的符号写在等号左边,把微粒之间作用结果的符号写在等号右边,并根据电荷守恒以及原子种类和数量守恒配平离子方程式。稀硫酸与 Ba(OH)2 溶液反应的离子方程式为:
离子方程式和化学方程式都可以用来表示化学反应,但离子方程式所表示的不仅仅是一个反应,而是一类反应,并且揭示了这类反应的实质。
离子方程式的另一种书写方法
1.写出化学方程式例如,盐酸与氢氧化钠在溶液中所发生反应的化学方程式为:
HCl + NaOH === NaCl + H2O
2.改写化学方程式将化学方程式中易溶于水且易电离的物质改用离子符号(即该物质电离产物的符号)表示,而难溶于水的物质、挥发性物质和水等仍用化学式表示,则上述化学方程式被改写为
H+ + Cl- + Na+ + OH- === H2O+Na+ + Cl-
3.删去未参与反应的离子的符号,得到离子方程式将上式中没有参与反应的 Cl-、Na+ 删去,便可得到该反应的离子方程式:
H++OH- === H2O
4.检查离子方程式是否配平根据电荷守恒以及原子种类和数量守恒的原则,检查所写的离子方程式是否配平。
又如,向某溶液中先滴加 AgNO3 溶液有白色沉淀产生,再滴加稀硝酸时白色沉淀不溶解,则可推断该溶液含有Cl-。这是实验室中检验Cl-的常用方法。
食盐的精制氯碱工业通过电解饱和食盐水制得烧碱、氢气和氯气,并以它们为原料生产一系列化工产品。氯碱工业的主要原料是粗食盐。粗食盐中除了含有难溶性杂质外,还含有钙盐、镁盐等可溶性杂质。在氯碱工业中,这些可溶性杂质不但会增加生产能耗,还会带来安全隐患。因此,氯碱工业的一道重要工序是除去粗食盐水中的杂质。
利用离子反应除去杂质的思路和方法1.分析物质组成,确定要保留的物质和需要除去的杂质。2.明确要保留的物质和杂质之间的性质差异。3.选择能使杂质离子转化为气体或沉淀的物质作为除杂试剂。除杂试剂不能影响要保留的离子,且应适当过量。
4.分析因除杂试剂过量而引入的新杂质如何除去。5.综合考虑原有杂质离子和可能新引入的杂质离子,确定试剂添加顺序和实验操作步骤。
食盐的精制粗食盐中含有Ca2+、Mg2+、SO等杂质离子,除去它们发生反应的离子方程式分别是:(1)__________________________________。(2)__________________________________。(3)__________________________________。
1.所有的化学反应都能写成离子方程式吗?为什么?
提示:不能。因为不是在溶液中进行的反应、不是自由移动的离子之间的反应都不能写成离子方程式,如碳酸钙煅烧制氧化钙等。
2.大多数盐类物质是强电解质,书写离子方程式时,盐类物质都可拆写成离子形式吗?
提示:不是。只有可溶性盐可拆写成离子形式。
3.难电离的物质包括哪些类别?
提示:弱酸(如CH3COOH、HClO等)、弱碱(如NH3·H2O等)、水等。
4.离子方程式:H++OH- === H2O能表示所有强酸与强碱之间发生的中和反应吗?为什么?
提示:不能。因为H++OH-===H2O只表示酸中酸根离子与碱中阳离子之间不发生反应的强酸与强碱之间的反应,如NaOH与强酸之间的反应等;Ba(OH)2与H2SO4之间的反应就不能用该离子方程式表示。
鲁科版 (2019)必修 第一册第2节 电解质的电离 离子反应课文配套课件ppt: 这是一份鲁科版 (2019)必修 第一册第2节 电解质的电离 离子反应课文配套课件ppt,共60页。PPT课件主要包含了知识网络,学业基础,2生成气体,实验方案设计,实验步骤,核心素养,④检验方法,学考评价等内容,欢迎下载使用。
高中化学第4节 离子反应优质ppt课件: 这是一份高中化学第4节 离子反应优质ppt课件,共33页。PPT课件主要包含了学习目标,特征反应,氧化还原反应,消耗标准液的体积,物质的量浓度等内容,欢迎下载使用。
高中化学鲁科版 (2019)选择性必修1第3章 物质在水溶液中的行为第4节 离子反应公开课课件ppt: 这是一份高中化学鲁科版 (2019)选择性必修1第3章 物质在水溶液中的行为第4节 离子反应公开课课件ppt,共23页。PPT课件主要包含了学习目标,离子与原子或分子,浓度降低等内容,欢迎下载使用。














