


还剩11页未读,
继续阅读
所属成套资源:人教版(2019)高中化学必修一PPT课件(共38份)
成套系列资料,整套一键下载
人教版化学必修一 第二章 基础知识复习 课件
展开
这是一份人教版化学必修一 第二章 基础知识复习 课件,共19页。
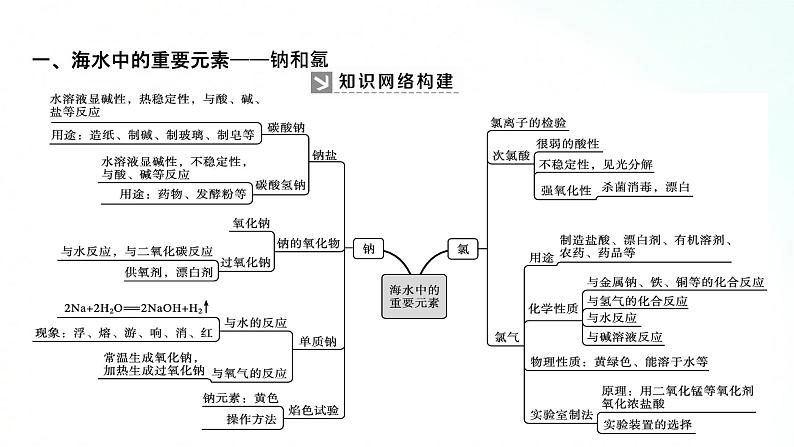
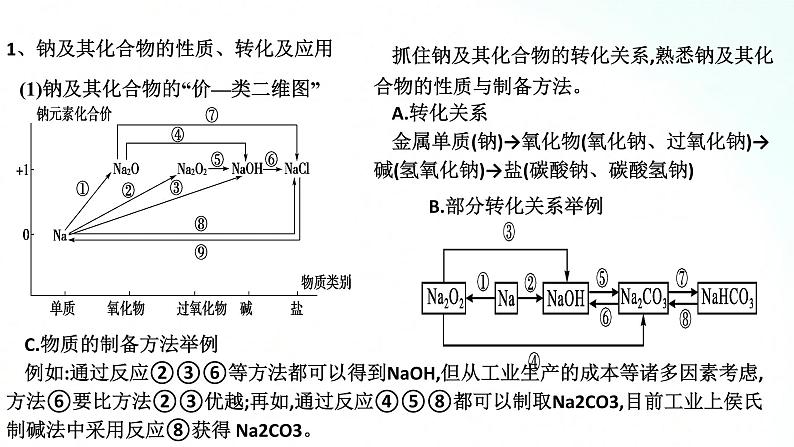
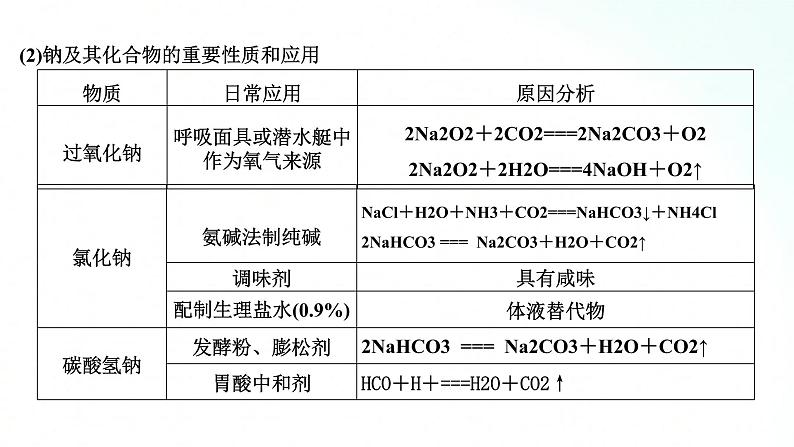
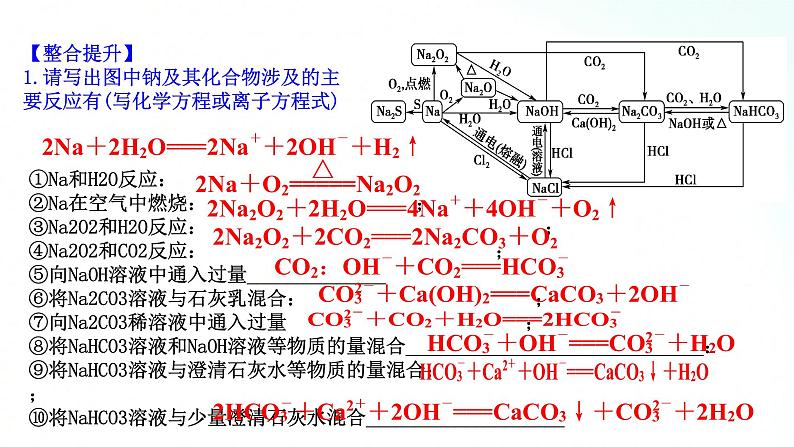
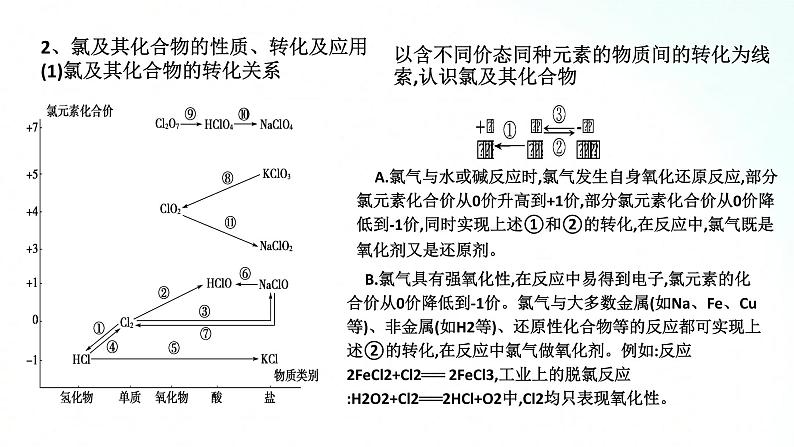
人教版化学必修一海水中的重要元素钠和氯基础知识复习课一、海水中的重要元素——钠和氯 1、钠及其化合物的性质、转化及应用(1)钠及其化合物的“价—类二维图”抓住钠及其化合物的转化关系,熟悉钠及其化合物的性质与制备方法。A.转化关系金属单质(钠)→氧化物(氧化钠、过氧化钠)→碱(氢氧化钠)→盐(碳酸钠、碳酸氢钠)B.部分转化关系举例 C.物质的制备方法举例例如:通过反应②③⑥等方法都可以得到NaOH,但从工业生产的成本等诸多因素考虑,方法⑥要比方法②③优越;再如,通过反应④⑤⑧都可以制取Na2CO3,目前工业上侯氏制碱法中采用反应⑧获得 Na2CO3。(2)钠及其化合物的重要性质和应用 【例题1】 已知淡黄色固体X与气体A存在如下转化关系:请回答下列问题:(1)固体X的名称为 ,气体A的化学式为 。 (2)写出反应①的化学方程式,并指出氧化剂: 。 (3)写出反应②④的离子方程式。反应②: ; 反应④ 。 (4)在反应①中,若转移1 mol电子,生成气体B的体积(标准状况下)为 。 解析:(1)推断题重点是找突破口。本题突破口为淡黄色固体X是由金属单质与气体反应生成,则X应为Na2O2,该气体为O2,与Na2O2反应生成O2的气体A为CO2,则固体Y为Na2CO3,Na2CO3与石灰水反应生成白色沉淀CaCO3,进而根据物质的性质写出化学方程式或离子方程式。(2)Na2O2与CO2反应生成Na2CO3和O2,该反应中,Na2O2自身发生氧化还原反应,Na2O2既是氧化剂,又是还原剂。过氧化钠 CO2 2Na2O2+2CO2==2Na2CO3+O2,氧化剂是Na2O2Ca2++CO32-==CaCO3↓ CaCO3+2H+==Ca2++H2O+CO2↑11.2 L 【整合提升】1.请写出图中钠及其化合物涉及的主要反应有(写化学方程或离子方程式)①Na和H2O反应: ;②Na在空气中燃烧: ;③Na2O2和H2O反应: ;④Na2O2和CO2反应: ;⑤向NaOH溶液中通入过量______________⑥将Na2CO3溶液与石灰乳混合: ;⑦向Na2CO3稀溶液中通入过量 ;⑧将NaHCO3溶液和NaOH溶液等物质的量混合______________________________:⑨将NaHCO3溶液与澄清石灰水等物质的量混合: ;⑩将NaHCO3溶液与少量澄清石灰水混合____________________ 2.过氧化钠能与二氧化碳反应。在“探月工程”的航天舱中、在宇航员太空漫步时穿的航天服中、在潜艇中均使用过氧化钠作制氧剂,供人呼吸之用。(1)Na2O2能与酸反应生成盐和水,Na2O2是否属于碱性氧化物?(2)Na2O2投入酚酞溶液中,溶液有什么变化?(3)当Na2O2与CO2反应时, 1 mol Na2O2完全反应转移电子的物质的量是多少(用双线桥表示)。(4)下列反应与Na2O2+SO2====Na2SO4相比较,Na2O2的作用相同的是哪一个?①2Na2O2+2CO2====2Na2CO3+O2 ②2Na2O2+2SO3====2Na2SO4+O2③Na2O2+H2SO4====Na2SO4+H2O2 ④3Na2O2+Cr2O3====2Na2CrO4+Na2ONa2O2不属于碱性氧化物而属于过氧化物。Na2O2投入酚酞溶液中,溶液先变红后褪色。1 mol Na2O2完全反应转移电子1 mol。④2、氯及其化合物的性质、转化及应用(1)氯及其化合物的转化关系以含不同价态同种元素的物质间的转化为线索,认识氯及其化合物A.氯气与水或碱反应时,氯气发生自身氧化还原反应,部分氯元素化合价从0价升高到+1价,部分氯元素化合价从0价降低到-1价,同时实现上述①和②的转化,在反应中,氯气既是氧化剂又是还原剂。B.氯气具有强氧化性,在反应中易得到电子,氯元素的化合价从0价降低到-1价。氯气与大多数金属(如Na、Fe、Cu等)、非金属(如H2等)、还原性化合物等的反应都可实现上述②的转化,在反应中氯气做氧化剂。例如:反应2FeCl2+Cl2══ 2FeCl3,工业上的脱氯反应:H2O2+Cl2══2HCl+O2中,Cl2均只表现氧化性。3.实验室里利用氧化剂氧化浓盐酸中的-1价氯制取氯气可实现上述③的转化,在反应中HCl做还原剂。可用作氧化剂的常见物质有MnO2、KMnO4、KClO3、O2等。2.氯及其化合物的重要性质和应用【例题2】 下图中,A、B、C、D是氯气或含氯的化合物。(1)推断A、B、C、D各是什么物质(写化学式):A ,B ,C ,D 。 (2)写出①~⑤各步反应的化学方程式:① , ② , ③ , ④ , ⑤ 。 Cl2 Ca(ClO)2 HCl HClO 【整合提升】1.请写出图中氯及其化合物相互转化的化学方程式。2.2019年3月,莫桑比克、津巴布韦、马拉维等国遭受强热带气旋“伊代”袭击,造成重大人员伤亡和巨大财产损失。中国政府向受灾国家政府提供紧急人道主义援助,帮助开展抗灾救灾,并愿根据受灾国家需要,为灾后重建工作提供力所能及的帮助。洪灾过后,饮用水的消毒杀菌成为抑制大规模传染性疾病暴发的有效方法之一。漂白粉是常用的消毒剂。(1)工业上将氯气通入石灰乳[Ca(OH)2]制取漂白粉,写出反应的化学方程式。氯气在反应中作氧化剂还是还原剂?(2)漂白粉的有效成分是什么?(3)漂白粉溶于水后,受空气中的CO2作用,即产生有漂白、杀菌作用的次氯酸,写出反应的化学反应方程式。(4)漂白粉属于纯净物还是混合物?(5)漂白粉应如何保存?2Cl2+2Ca(OH)2====CaCl2+Ca(ClO)2+2H2O,氯气在此反应中既是氧化剂又是还原剂。Ca(ClO)2Ca(ClO)2+CO2+H2O====CaCO3+2HClO漂白粉的主要成分是氯化钙和次氯酸钙,是混合物漂白粉应保存于阴凉、干燥处二、气体制备实验的基本思路1.气体制备装置的一般连接顺序及选择2.重要气体的发生装置三、宏观物质与微观粒子间的计量关系 1.以物质的量为中心的各个化学计量之间的关系3.注意事项(1)突出物质的量这一核心,它是其他物理量之间转换的桥梁和纽带,一般模式:一种物理量求算,物质的量求算,另一种物理量。(2)换算过程中要注意单位的对应。(3)在使用气体的摩尔体积时要注意外界的条件,如不是标准状况,则不能直接将22.4 L·mol-1代入运算。(4)不同状况下,同种物质的状态有可能不同。(5)进行物质的量浓度的有关计算时,各种情况下最终落脚点是物质的量浓度的定义式c=n/V,充分利用有关物质的量的计算公式,发挥物质的量的桥梁作用。【整合提升】鲜花是美丽的,但是美丽的鲜花的保鲜期却很短,在花瓶中加入“鲜花保鲜剂”可以延长鲜花的寿命。下表是1 L“鲜花保鲜剂”的成分,阅读后回答下列问题:(1)“鲜花保鲜剂”中物质的量浓度最大的成分是______(填写名称)。(2)“鲜花保鲜剂”中K+的物质的量浓度为(阿司匹林中不含K+)________(只要求写表达式,不需计算)mol·L-1。 (3)如图所示的仪器中,在配制“鲜花保鲜剂”溶液时肯定不需要的是________(填字母),还缺少的仪器有________________________(填仪器名称)。 【解析】(1)通过n= 可以计算1 L“鲜花保鲜剂”中含有的各种成分的物质的量,会得到其中含有的蔗糖的物质的量最大,故其浓度最大。(2)“鲜花保鲜剂”中K+的物质的量为n(K+)=2n(K2SO4)+n(KMnO4)=(2× )mol,所以c(K+)=( )mol·L-1。(3)配制一定浓度的溶液必需的玻璃仪器有:烧杯、玻璃棒、胶头滴管、容量瓶,故答案为a、c,还缺少的仪器有托盘天平、烧杯、玻璃棒。蔗糖ac托盘天平、玻璃棒、烧杯(4)配制过程中,下列操作对配制结果没有影响的是________(填字母)。 A.容量瓶在使用前未干燥,里面有少量蒸馏水B.定容时仰视液面C.容量瓶在使用前刚刚配制完一定物质的量浓度的NaCl溶液而未洗净D.定容摇匀后发现液面低于容量瓶的刻度线,但未做任何处理(5)欲确定“鲜花保鲜剂”中硝酸银的浓度,则加入的试剂中需含有________(填化学符号)。 【解析】A.容量瓶在使用前未干燥,里面有少量蒸馏水,对溶液的浓度不产生任何影响,正确;B.定容时仰视液面,溶液的体积偏大,使溶液的浓度偏低,错误;C.容量瓶在使用前刚刚配制完一定物质的量浓度的NaCl溶液而未洗净,NaCl与AgNO3反应,会使溶液的浓度偏小,错误;D.定容摇匀后发现液面低于容量瓶的刻度线,但未做任何处理,对配制的溶液的浓度不产生任何影响,正确。(5)欲确定“鲜花保鲜剂”中硝酸银的浓度,可利用反应:Ag++Cl- ====AgCl↓,加入的试剂中需含有Cl-。ADCl-谢谢观看
人教版化学必修一海水中的重要元素钠和氯基础知识复习课一、海水中的重要元素——钠和氯 1、钠及其化合物的性质、转化及应用(1)钠及其化合物的“价—类二维图”抓住钠及其化合物的转化关系,熟悉钠及其化合物的性质与制备方法。A.转化关系金属单质(钠)→氧化物(氧化钠、过氧化钠)→碱(氢氧化钠)→盐(碳酸钠、碳酸氢钠)B.部分转化关系举例 C.物质的制备方法举例例如:通过反应②③⑥等方法都可以得到NaOH,但从工业生产的成本等诸多因素考虑,方法⑥要比方法②③优越;再如,通过反应④⑤⑧都可以制取Na2CO3,目前工业上侯氏制碱法中采用反应⑧获得 Na2CO3。(2)钠及其化合物的重要性质和应用 【例题1】 已知淡黄色固体X与气体A存在如下转化关系:请回答下列问题:(1)固体X的名称为 ,气体A的化学式为 。 (2)写出反应①的化学方程式,并指出氧化剂: 。 (3)写出反应②④的离子方程式。反应②: ; 反应④ 。 (4)在反应①中,若转移1 mol电子,生成气体B的体积(标准状况下)为 。 解析:(1)推断题重点是找突破口。本题突破口为淡黄色固体X是由金属单质与气体反应生成,则X应为Na2O2,该气体为O2,与Na2O2反应生成O2的气体A为CO2,则固体Y为Na2CO3,Na2CO3与石灰水反应生成白色沉淀CaCO3,进而根据物质的性质写出化学方程式或离子方程式。(2)Na2O2与CO2反应生成Na2CO3和O2,该反应中,Na2O2自身发生氧化还原反应,Na2O2既是氧化剂,又是还原剂。过氧化钠 CO2 2Na2O2+2CO2==2Na2CO3+O2,氧化剂是Na2O2Ca2++CO32-==CaCO3↓ CaCO3+2H+==Ca2++H2O+CO2↑11.2 L 【整合提升】1.请写出图中钠及其化合物涉及的主要反应有(写化学方程或离子方程式)①Na和H2O反应: ;②Na在空气中燃烧: ;③Na2O2和H2O反应: ;④Na2O2和CO2反应: ;⑤向NaOH溶液中通入过量______________⑥将Na2CO3溶液与石灰乳混合: ;⑦向Na2CO3稀溶液中通入过量 ;⑧将NaHCO3溶液和NaOH溶液等物质的量混合______________________________:⑨将NaHCO3溶液与澄清石灰水等物质的量混合: ;⑩将NaHCO3溶液与少量澄清石灰水混合____________________ 2.过氧化钠能与二氧化碳反应。在“探月工程”的航天舱中、在宇航员太空漫步时穿的航天服中、在潜艇中均使用过氧化钠作制氧剂,供人呼吸之用。(1)Na2O2能与酸反应生成盐和水,Na2O2是否属于碱性氧化物?(2)Na2O2投入酚酞溶液中,溶液有什么变化?(3)当Na2O2与CO2反应时, 1 mol Na2O2完全反应转移电子的物质的量是多少(用双线桥表示)。(4)下列反应与Na2O2+SO2====Na2SO4相比较,Na2O2的作用相同的是哪一个?①2Na2O2+2CO2====2Na2CO3+O2 ②2Na2O2+2SO3====2Na2SO4+O2③Na2O2+H2SO4====Na2SO4+H2O2 ④3Na2O2+Cr2O3====2Na2CrO4+Na2ONa2O2不属于碱性氧化物而属于过氧化物。Na2O2投入酚酞溶液中,溶液先变红后褪色。1 mol Na2O2完全反应转移电子1 mol。④2、氯及其化合物的性质、转化及应用(1)氯及其化合物的转化关系以含不同价态同种元素的物质间的转化为线索,认识氯及其化合物A.氯气与水或碱反应时,氯气发生自身氧化还原反应,部分氯元素化合价从0价升高到+1价,部分氯元素化合价从0价降低到-1价,同时实现上述①和②的转化,在反应中,氯气既是氧化剂又是还原剂。B.氯气具有强氧化性,在反应中易得到电子,氯元素的化合价从0价降低到-1价。氯气与大多数金属(如Na、Fe、Cu等)、非金属(如H2等)、还原性化合物等的反应都可实现上述②的转化,在反应中氯气做氧化剂。例如:反应2FeCl2+Cl2══ 2FeCl3,工业上的脱氯反应:H2O2+Cl2══2HCl+O2中,Cl2均只表现氧化性。3.实验室里利用氧化剂氧化浓盐酸中的-1价氯制取氯气可实现上述③的转化,在反应中HCl做还原剂。可用作氧化剂的常见物质有MnO2、KMnO4、KClO3、O2等。2.氯及其化合物的重要性质和应用【例题2】 下图中,A、B、C、D是氯气或含氯的化合物。(1)推断A、B、C、D各是什么物质(写化学式):A ,B ,C ,D 。 (2)写出①~⑤各步反应的化学方程式:① , ② , ③ , ④ , ⑤ 。 Cl2 Ca(ClO)2 HCl HClO 【整合提升】1.请写出图中氯及其化合物相互转化的化学方程式。2.2019年3月,莫桑比克、津巴布韦、马拉维等国遭受强热带气旋“伊代”袭击,造成重大人员伤亡和巨大财产损失。中国政府向受灾国家政府提供紧急人道主义援助,帮助开展抗灾救灾,并愿根据受灾国家需要,为灾后重建工作提供力所能及的帮助。洪灾过后,饮用水的消毒杀菌成为抑制大规模传染性疾病暴发的有效方法之一。漂白粉是常用的消毒剂。(1)工业上将氯气通入石灰乳[Ca(OH)2]制取漂白粉,写出反应的化学方程式。氯气在反应中作氧化剂还是还原剂?(2)漂白粉的有效成分是什么?(3)漂白粉溶于水后,受空气中的CO2作用,即产生有漂白、杀菌作用的次氯酸,写出反应的化学反应方程式。(4)漂白粉属于纯净物还是混合物?(5)漂白粉应如何保存?2Cl2+2Ca(OH)2====CaCl2+Ca(ClO)2+2H2O,氯气在此反应中既是氧化剂又是还原剂。Ca(ClO)2Ca(ClO)2+CO2+H2O====CaCO3+2HClO漂白粉的主要成分是氯化钙和次氯酸钙,是混合物漂白粉应保存于阴凉、干燥处二、气体制备实验的基本思路1.气体制备装置的一般连接顺序及选择2.重要气体的发生装置三、宏观物质与微观粒子间的计量关系 1.以物质的量为中心的各个化学计量之间的关系3.注意事项(1)突出物质的量这一核心,它是其他物理量之间转换的桥梁和纽带,一般模式:一种物理量求算,物质的量求算,另一种物理量。(2)换算过程中要注意单位的对应。(3)在使用气体的摩尔体积时要注意外界的条件,如不是标准状况,则不能直接将22.4 L·mol-1代入运算。(4)不同状况下,同种物质的状态有可能不同。(5)进行物质的量浓度的有关计算时,各种情况下最终落脚点是物质的量浓度的定义式c=n/V,充分利用有关物质的量的计算公式,发挥物质的量的桥梁作用。【整合提升】鲜花是美丽的,但是美丽的鲜花的保鲜期却很短,在花瓶中加入“鲜花保鲜剂”可以延长鲜花的寿命。下表是1 L“鲜花保鲜剂”的成分,阅读后回答下列问题:(1)“鲜花保鲜剂”中物质的量浓度最大的成分是______(填写名称)。(2)“鲜花保鲜剂”中K+的物质的量浓度为(阿司匹林中不含K+)________(只要求写表达式,不需计算)mol·L-1。 (3)如图所示的仪器中,在配制“鲜花保鲜剂”溶液时肯定不需要的是________(填字母),还缺少的仪器有________________________(填仪器名称)。 【解析】(1)通过n= 可以计算1 L“鲜花保鲜剂”中含有的各种成分的物质的量,会得到其中含有的蔗糖的物质的量最大,故其浓度最大。(2)“鲜花保鲜剂”中K+的物质的量为n(K+)=2n(K2SO4)+n(KMnO4)=(2× )mol,所以c(K+)=( )mol·L-1。(3)配制一定浓度的溶液必需的玻璃仪器有:烧杯、玻璃棒、胶头滴管、容量瓶,故答案为a、c,还缺少的仪器有托盘天平、烧杯、玻璃棒。蔗糖ac托盘天平、玻璃棒、烧杯(4)配制过程中,下列操作对配制结果没有影响的是________(填字母)。 A.容量瓶在使用前未干燥,里面有少量蒸馏水B.定容时仰视液面C.容量瓶在使用前刚刚配制完一定物质的量浓度的NaCl溶液而未洗净D.定容摇匀后发现液面低于容量瓶的刻度线,但未做任何处理(5)欲确定“鲜花保鲜剂”中硝酸银的浓度,则加入的试剂中需含有________(填化学符号)。 【解析】A.容量瓶在使用前未干燥,里面有少量蒸馏水,对溶液的浓度不产生任何影响,正确;B.定容时仰视液面,溶液的体积偏大,使溶液的浓度偏低,错误;C.容量瓶在使用前刚刚配制完一定物质的量浓度的NaCl溶液而未洗净,NaCl与AgNO3反应,会使溶液的浓度偏小,错误;D.定容摇匀后发现液面低于容量瓶的刻度线,但未做任何处理,对配制的溶液的浓度不产生任何影响,正确。(5)欲确定“鲜花保鲜剂”中硝酸银的浓度,可利用反应:Ag++Cl- ====AgCl↓,加入的试剂中需含有Cl-。ADCl-谢谢观看
相关资料
更多









