




人教版 (2019)必修 第一册第一节 铁及其化合物图文课件ppt
展开铁盐和亚铁盐1.Fe2+和Fe3+的检验
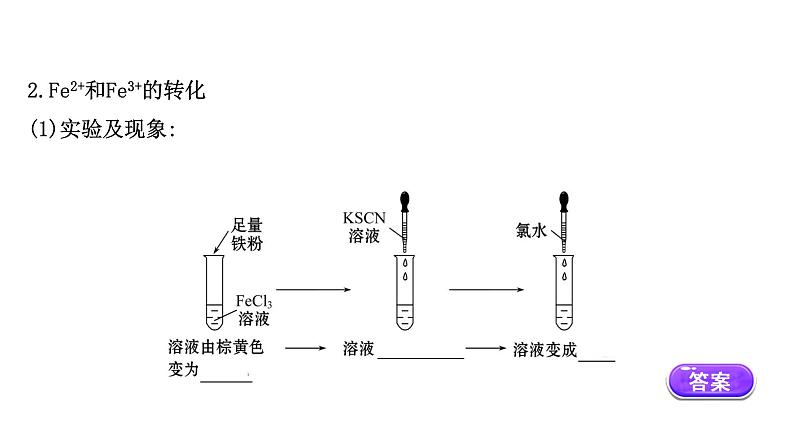
2.Fe2+和Fe3+的转化(1)实验及现象:
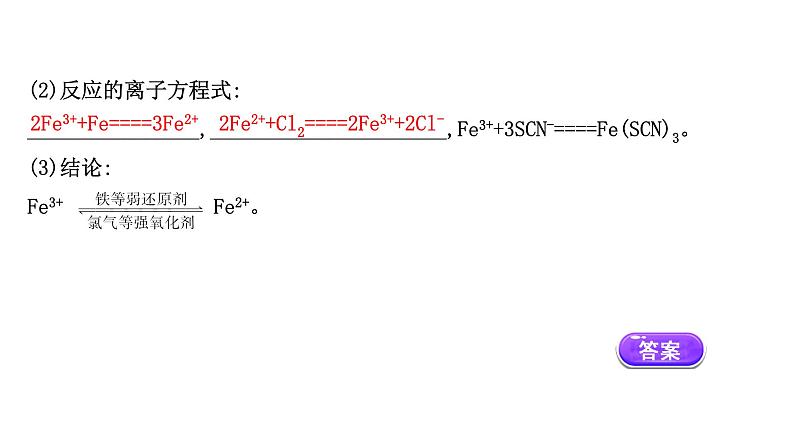
(2)反应的离子方程式:________________,______________________,Fe3++3SCN-====Fe(SCN)3。(3)结论:Fe3+ Fe2+。
2Fe3++Fe====3Fe2+
2Fe2++Cl2====2Fe3++2Cl-
【自主探索】(1)如何证明Fe3O4中既有+2价铁又有+3价铁?提示:取一定量Fe3O4溶于稀硫酸,形成溶液,分别取该溶液于两支试管中,一支试管中加入KSCN溶液,溶液变红,说明含有Fe3+,证明Fe3O4中有+3价铁;另一支试管中加入酸性KMnO4溶液,紫红色褪去,说明含有Fe2+,证明Fe3O4中有+2价铁。
(2) (情境思考)化学老师在课堂上演示了一个“血手印”魔术。预先在手上喷KSCN溶液,然后印在白纸上晾干。用FeCl3溶液喷洒白纸,白纸立刻出现红色手印。这个现象与FeCl3的性质有什么关系? 有什么用途?提示:该魔术利用Fe3+与SCN-结合生成红色的Fe(SCN)3,该现象可用于Fe3+的检验。
知识点 Fe2+、Fe3+检验及Fe2+、Fe3+、Fe的转化 1.Fe2+的检验
【易错提醒】Fe3+、Fe2+的检验注意事项(1)Fe3+与SCN-作用后的“溶液”显红色,注意并不是“沉淀”。(2)若检验某溶液中既有Fe3+又有Fe2+,则需要分别检验。注意检验Fe2+往往利用高锰酸钾溶液。(3)因为酸性高锰酸钾溶液可以氧化氯离子,所以检验氯化亚铁中的亚铁离子,一般不用酸性高锰酸钾溶液,可以用铁氰化钾(K3[Fe(CN)6])溶液检验(后续课程会学习),即试剂中加入铁氰化钾溶液,显蓝色,则说明存在亚铁离子。
3.Fe2+、Fe3+、Fe之间的相互转化关系
(1)Fe只具有还原性,可被弱氧化剂(H+、S、Fe3+等)氧化成Fe2+,被强氧化剂(Cl2等)氧化成Fe3+。如Fe+2H+====Fe2++H2↑、Fe+S FeS 、2Fe3++Fe====3Fe2+、3Cl2+2Fe 2FeCl3等。(2)Fe2+既有氧化性又有还原性,可被强氧化剂[Cl2、KMnO4(H+)等]氧化为Fe3+,可被还原剂(Zn、CO等)还原为Fe。如Zn+Fe2+====Fe+Zn2+。(3)Fe3+具有氧化性,可被还原剂(Fe、Cu等)还原为Fe2+,被强还原剂(CO等)还原为Fe。如2Fe3++Cu====2Fe2++Cu2+ 、3CO+Fe2O3 2Fe+3CO2
【合作探究】(1)检验Fe2+时先加入氯水后加入KSCN溶液,这种操作正确吗?为什么?(科学探究与创新意识)
提示:不正确。检验Fe2+时,要注意加入试剂的顺序,即先加入KSCN溶液,再加入氯水,以免发生误检。
(2)已知HNO3具有强氧化性,某同学检验某工业矿渣FeO中是否含Fe2O3时的步骤:取矿渣样品 取上层清液于试管中 溶液变为红色 结论:该矿渣中含Fe2O3,另一同学认为该检验方法不正确。你认为对吗?为什么?(科学探究与创新意识)提示:该同学的检验方法不正确。因为HNO3能与FeO反应生成Fe(NO3)3,故该同学检验方法不正确。
(3)(情境应用)人体易吸收二价铁盐,难吸收三价铁盐。通过学习了解到Fe2+和Fe3+可以互相转化,现提供的物质有FeCl2溶液、FeCl3溶液、Fe粉、KSCN溶液、3%H2O2,请你完成实验报告证明Fe2+和Fe3+的互相转化。(已知:H2O2可氧化Fe2+)(科学探究与创新意识)
【解析】①能使KSCN显示红色的是铁离子,将KSCN溶液滴入盛有FeCl2溶液的试管中,无明显现象,再加入双氧水,亚铁离子被氧化剂双氧水氧化为铁离子,会变红色,此时可以证明亚铁离子被氧化为铁离子;②在盛有足量Fe粉的试管中滴入FeCl3溶液,此时金属铁和三价铁之间可以反应生成亚铁离子,溶液由棕黄色变为浅绿色,再加入KSCN溶液,充分振荡无现象,此时Fe3+被Fe粉还原成Fe2+。
【典例示范】(2020·武汉高一检测)为了“探究铁及其化合物的氧化性或还原性”,某同学甲设计了如下的实验方案。(1)实验前甲同学预测:Fe2+肯定既有还原性又有氧化性。你认为甲同学预测的依据是________________。 (2)甲同学欲用实验证明他的预测。实验室提供了下列试剂:3%的H2O2溶液、锌粒、铜片、0.1 ml·L-1 FeCl2溶液、KSCN溶液、新制氯水。①若甲同学计划在0.1 ml·L-1 FeCl2溶液中滴入新制氯水,探究Fe2+的还原性,你预计可能发生的反应及现象是_____________________________。
②实验中,甲同学发现现象不太明显,老师分析可能是产物的含量太低,建议可以通过检验Fe2+被氧化的产物Fe3+的存在以获取证据。你认为如何证明甲同学的观点和实验方案都是正确的:________________。 ③对于证明Fe2+具有氧化性,甲同学认为金属单质都具有还原性,并分别将铜片、锌粒投入FeCl2溶液中,结果铜片没变化,锌粒逐渐变小。三种金属的还原性由强到弱的顺序是________________。
【解析】Fe2+中铁元素化合价处于中间价态,可以升高也可以降低,既可被氧化又可被还原;新制氯水可将Fe2+氧化成棕黄色的Fe3+;检验Fe3+用KSCN溶液;在氧化还原反应中还原剂的还原性强于还原产物。答案:(1)Fe2+中铁元素化合价处于中间价态,可以升高也可以降低(2)①Cl2+2Fe2+====2Cl-+2Fe3+;溶液变为棕黄色②向溶液中滴入KSCN溶液,溶液呈红色 ③Zn>Fe>Cu
【素养训练】(情境应用)工业印刷电路板的制作流程如图所示,其中“蚀刻”所用的就是溶液FeCl3。(科学探究与创新意识)
①FeCl3溶液蚀刻印刷铜板的原理是怎样的?表现了FeCl3的什么性质?提示:原理:2Fe3++Cu====2Fe2++Cu2+;表现了FeCl3的氧化性。②由FeCl2生成Fe或FeCl3,你能写出其化学方程式吗?提示:FeCl2+Zn====ZnCl2+Fe,2FeCl2+Cl2====2FeCl3。③反应后的“蚀刻液”中含有哪些离子?如果要回收得到Cu和FeCl3,需要怎样设计回收方案?提示:反应后的“蚀刻液”中含有Fe3+、Fe2+、Cu2+等离子。为从溶液中提取Cu,应向溶液中加入过量铁粉:Fe+Cu2+====Fe2++Cu、Fe+2Fe3+====3Fe2+;然后用盐酸溶解过量的铁粉:Fe+2HCl====FeCl2+H2↑;过滤后,得到Cu,再向滤液中加入新制氯水即可得到FeCl3:2FeCl2+Cl2====2FeCl3。
④如何证明最后的腐蚀液是否还含有Fe3+?提示:用洁净的试管取少量的样品溶液,向其中滴入KSCN溶液1~2滴,若溶液立即显红色证明含有Fe3+。
【加固训练】 (2020·潍坊高一检测)久置的FeSO4溶液变黄,一般认为是被氧化为Fe3+的缘故。回答下列问题:(1)久置的FeSO4溶液中Fe3+的检验:向久置的FeSO4溶液中加入KSCN的现象为___________________________,向含有Fe3+的久置的FeSO4溶液中加入少量淀粉KI溶液,发现溶液变蓝,反应的离子方程式为__________________________。 (2)除去久置FeSO4溶液中的Fe3+:在溶液中加入少量铁粉,可以观察到的现象为________;反应的离子方程式为___________,不能用铜粉作为除去FeSO4溶液中Fe3+试剂的原因:____________。
(3)查阅资料:溶液中Fe2+的氧化过程分为两步,首先是Fe2+先生成Fe(OH)2,接着被O2氧化。写出Fe(OH)2在空气中被氧化的化学方程式: ________________________, 其现象为__________________________。 (4)某研究小组研究常温下不同pH对Fe2+被O2氧化的影响,如图。结合图分析不同pH对Fe2+被O2氧化的速率产生了怎样的影响: ________________。
【解析】(1) 久置的FeSO4溶液中部分Fe2+被空气中的氧气氧化为Fe3+,向久置的FeSO4溶液中加入KSCN的现象为溶液变成红色,向含有Fe3+的久置的FeSO4溶液中加入少量淀粉KI溶液,发现溶液变蓝,Fe3+将I-氧化为I2,发生反应的离子方程式为2I-+2Fe3+====2Fe2++I2。(2)在溶液中加入少量铁粉,溶液中的Fe3+被铁粉还原为Fe2+,可以观察到的现象为溶液从黄色变为浅绿色;反应的离子方程式为Fe+2Fe3+====3Fe2+,不能用铜粉作为除去FeSO4溶液中Fe3+试剂的原因是会引入新的杂质Cu2+。(3)Fe(OH)2在空气中被氧化生成Fe(OH)3,反应的化学方程式为4Fe(OH)2+O2+2H2O====4Fe(OH)3,其现象为白色沉淀迅速变为灰绿色,最终变为红褐色。(4)根据不同pH对Fe2+被O2氧化的关系图,可知pH越大,氧化速率越快。
答案:(1)溶液变成红色 2I-+2Fe3+====2Fe2++I2 (2)溶液从黄色变为浅绿色 Fe+2Fe3+====3Fe2+ 会引入新的杂质Cu2+(3)4Fe(OH)2+O2+2H2O====4Fe(OH)3白色沉淀迅速变为灰绿色,最终变为红褐色(4)在pH小于7的情况下,pH越大,反应速率越快
【备选要点】 Fe2+、Fe3+的性质及应用1.Fe2+既有氧化性又有还原性
如2Fe2++Cl2====2Fe3++2Cl-Zn+Fe2+====Fe+Zn2+。
2.Fe3+具有较强的氧化性,可被还原为+2价或0价的铁
如2Fe3++Cu====2Fe2++Cu2+,3CO+Fe2O3 2Fe+3CO2。
3.含铁物质的分离与除杂
【易错提醒】(1)虽然Fe2+既有氧化性又有还原性,但以还原性为主。(2)不同价态铁元素间的转化属于氧化还原反应,在选择氧化剂时可以根据如下规律判断: 需要失去2个电子,而 只需失去1个电子,但前者比后者要容易得多,因此 需弱的氧化剂即可,而 则需要强氧化剂才能实现。
【合作探究】(思维升华)如何判断三价铁离子和铜离子的氧化性强弱?(宏观辨识与微观探析)
提示:在2Fe3++Cu====2Fe2++Cu2+反应中三价铁离子是氧化剂,铜离子是氧化产物,氧化剂的氧化性大于氧化产物,因此三价铁离子的氧化性比铜离子更强。
【典例示范】【典例】(2020·南宁高一检测)已知下列四个实验均能发生化学反应:
下列判断正确的是( )A.实验①中铁只作氧化剂B.实验②中Fe2+既显氧化性又显还原性C.实验③中发生的是置换反应D.上述实验证明:氧化性:Fe3+>Cu2+>Fe2+,Fe2+遇KSCN溶液无红色物质生成
【解题指南】解答本题注意以下两点:(1)根据氧化还原反应中元素化合价的变化判断元素的性质;(2)根据氧化还原反应中物质充当的角色判断氧化性、还原性的强弱。
【解析】选D。①中发生反应Fe+Cu2+====Fe2++Cu,其中铁作还原剂,A错;②中发生反应2Fe2++Cl2====2Fe3++2Cl-,其中Fe2+作还原剂,表现还原性,B错;③中反应为Cu+2Fe3+====2Fe2++Cu2+,不属于置换反应,C错;氧化性:由①知Cu2+>Fe2+,由③知Fe3+>Cu2+,即Fe3+>Cu2+>Fe2+,由④可知,Fe2+遇KSCN溶液不生成红色物质,D对。
【规律方法】氧化性、还原性强弱的比较在浓度相差不大的溶液中,同时含几种还原剂(如某溶液中含有Fe2+、Br-、I-)时,若加入一种氧化剂(如通入Cl2),则它首先与溶液中还原性最强的(I-)反应,然后与还原性较强的反应(即当I-反应完全后,再与Fe2+反应);同理含几种氧化剂时,所加还原剂先与氧化性最强的氧化剂反应。几种常见微粒的氧化性和还原性强弱顺序:氧化性:Mn (H+)>Cl2>Br2>Fe3+>I2还原性:I->Fe2+>Br->Cl->Mn2+
【素养训练】铁是人体必需的微量元素之一,在人体内有非常重要的生理作用,正常成人每日需要摄入的铁量约为1~2毫克。
一个体重50 kg的健康人,体内约含2 g铁,这2 g铁在人体内以Fe2+和Fe3+的形式存在。Fe2+易被吸收,补充铁时,应给予含Fe2+的亚铁盐,如硫酸亚铁。服用维生素C,可使食物中的Fe3+被还原成Fe2+,有利于人体吸收。(1)Fe2+ Fe3+的转化时,①需要加_______(填“氧化”或“还原”)剂;若加入少量锌粒,能否实现②的转化_______(填“能”或“否”),原因是__ __。 (2)“服用维生素C,可使食物中的Fe3+被还原成Fe2+”这句话指出,维生素C在这一反应中具有________(填“氧化”或“还原”)性。
(3)市面出售的某种麦片中含有微量颗粒细小的铁粉,这些铁粉在人体胃酸的作用下转成亚铁盐,此反应的离子方程式为 __ __ __ __ __ __。
【解析】(1)Fe2+的化合价为+2,Fe3+的化合价为+3,①中Fe的化合价升高,需加化合价容易降低的物质,即氧化剂;②中Fe3+ Fe2+,要加入弱还原剂如Fe、Cu等,加入少量锌粒也能将Fe3+转化成Fe2+,若Zn过量则进一步把Fe2+还原为Fe。(2)维生素C可使Fe3+变成Fe2+,则维生素C作还原剂,表现出还原性。(3)人体胃酸为盐酸,铁与稀盐酸反应生成氯化亚铁和氢气。答案:(1)氧化 能 实现Fe3+→Fe2+要加入还原剂,Zn具有还原性,能实现②的转化(2)还原 (3)Fe+2H+====Fe2++H2↑
【三言两语话重点】 1.Fe3+和Fe2+的三种检验方法(1)观察法;(2)利用颜色变化;(3)利用氧化性和还原性。2.铁的化合物之间的转化
人教版 (2019)必修 第一册第一节 铁及其化合物课堂教学ppt课件: 这是一份人教版 (2019)必修 第一册第一节 铁及其化合物课堂教学ppt课件,共41页。PPT课件主要包含了第一节铁及其化合物,新课情境呈现,课前素能奠基,课堂素能探究,知识点一,典例1,知识点二,典例2,补铁药没有变质,补铁药完全变质等内容,欢迎下载使用。
高中化学人教版 (2019)必修 第一册第一节 铁及其化合物备课ppt课件: 这是一份高中化学人教版 (2019)必修 第一册第一节 铁及其化合物备课ppt课件,共46页。PPT课件主要包含了第一节铁及其化合物,新课情境呈现,课前素能奠基,氢氧化铁胶体,Fe2O3,延展性,导热性,磁性氧化铁,红褐色,难溶于水等内容,欢迎下载使用。
人教版 (2019)必修 第一册第一节 铁及其化合物课前预习ppt课件: 这是一份人教版 (2019)必修 第一册第一节 铁及其化合物课前预习ppt课件,共60页。PPT课件主要包含了课前自主学习,无明显现象,氧化性,还原性,氢氧化铁胶体,课堂合作探究,KSCN,探究总结,用NaOH溶液,检验方法等内容,欢迎下载使用。














