

初中化学科粤版九年级下册8.2 常见的酸和碱教案
展开常见的酸和碱
一、教学目标
1、知识与技能
(1)知道酸和碱溶液与指示剂反应,能用指示剂来区分常见的酸和碱。
(2)进一步熟悉常见的酸——盐酸和硫酸的物理性质和用途。增强对浓硫酸腐蚀性的认识。
(3)掌握酸的化学性质。
2、过程与方法
(1)通过盐酸和硫酸的鉴别,熟悉二者的物理性质和用途。
(2)通过活动与探究掌握酸的化学性质。
3、情感态度价值观
(1)树立科学的物质观,学会用辩证的观点看待事物,能透过表面现象挖掘事物具有共性的本质原因。
(2)强化实验及生活中的安全意识。
二、教学重难点
通过探究活动掌握酸的化学性质。
三、教学方法
实验探究、问题驱动。
四、实验仪器
浓盐酸、稀盐酸、浓硫酸、稀硫酸、紫色石蕊、无色酚酞、生锈的铁钉、氧化铜粉末、氯化钡溶液、硝酸银溶液;
试管、酒精灯、试管夹、镊子、药匙、火柴、滤纸。
五、教学思路
首先展示浓盐酸和浓硫酸,通过二者的鉴别,进一步回忆和增强对其物理性质和用途的认识。继而由《基础训练》上一篇短文,引领学生进入探究酸化学性质的学习情境中来。趁热打铁,以实验探究为主导,探究酸的化学性质。最后由学生小结、教师补充,全面总结酸的化学性质。
六、教学过程
(一)复习旧课,导入新课
【教师】同学们,上节课我们学习了浓盐酸和浓硫酸的物理性质和用途,现在老师手中拿的就是这两种酸,它们的标签都被遮挡住了。那么,在不看标签的情况下,你能够用哪些方法来区分二者?请同学们思考。
【学生】积极思考,回忆所学知识,回答问题。
【教师】同学们刚刚都回答的很好。浓硫酸的性质也是我们上节课的一个学习重点,请大家看几个视频,一起来回忆一下浓硫酸的性质。
【教师】那么,酸都具有哪些通性呢?各自又有哪些“脾气”和“性质”呢?这就是我们今天主要的学习内容。
(二)新课教学,解读探究
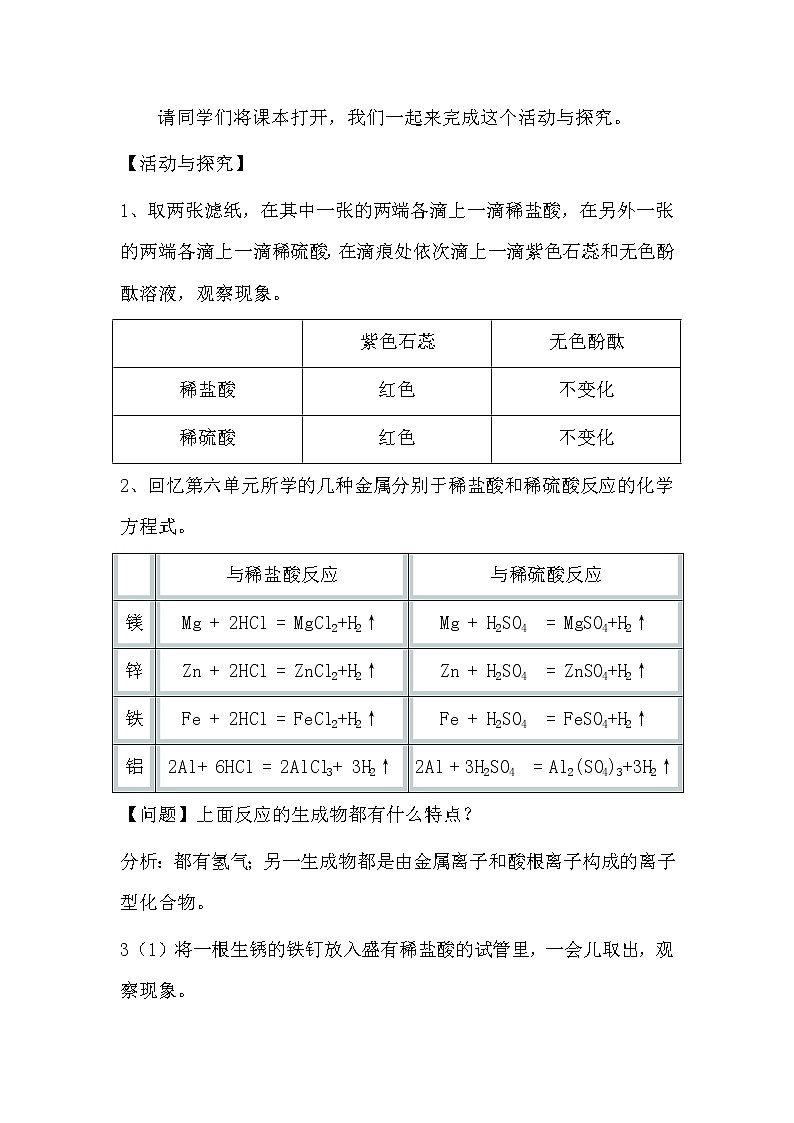
请同学们将课本打开,我们一起来完成这个活动与探究。
【活动与探究】
1、取两张滤纸,在其中一张的两端各滴上一滴稀盐酸,在另外一张的两端各滴上一滴稀硫酸,在滴痕处依次滴上一滴紫色石蕊和无色酚酞溶液,观察现象。
| 紫色石蕊 | 无色酚酞 |
稀盐酸 | 红色 | 不变化 |
稀硫酸 | 红色 | 不变化 |
2、回忆第六单元所学的几种金属分别于稀盐酸和稀硫酸反应的化学方程式。
| 与稀盐酸反应 | 与稀硫酸反应 |
镁 | Mg + 2HCl = MgCl2+H2↑ | Mg + H2SO4 = MgSO4+H2↑ |
锌 | Zn + 2HCl = ZnCl2+H2↑ | Zn + H2SO4 = ZnSO4+H2↑ |
铁 | Fe + 2HCl = FeCl2+H2↑ | Fe + H2SO4 = FeSO4+H2↑ |
铝 | 2Al+ 6HCl = 2AlCl3+ 3H2↑ | 2Al + 3H2SO4 = Al2(SO4)3+3H2↑ |
【问题】上面反应的生成物都有什么特点?
分析:都有氢气;另一生成物都是由金属离子和酸根离子构成的离子型化合物。
3(1)将一根生锈的铁钉放入盛有稀盐酸的试管里,一会儿取出,观察现象。
现象 | 化学方程式 |
铁锈消失,无色溶液变成黄色 | Fe2O3 + 6HCl = 2FeCl3 +3H2O |
(2)取一支试管,加入少量氧化铜粉末,再倒入少量稀盐酸,振荡试管,观察现象。
现象 | 化学方程式 |
黑色粉末逐渐消失,无色溶液变成蓝色 | CuO + 2HCl =CuCl2 + H2O |
【问题】上面反应的生成物有什么共同之处?
分析:都有水生成;另一生成物都是由金属离子和酸根离子构成的离子型化合物。
【小结】通过上述的探究,请总结酸的化学性质。
1、和指示剂作用,酸溶液使紫色石蕊变红,使无色酚酞不变色
2、和活泼金属反应,生成氢气和另一种金属的化合物
3、和金属氧化物反应,生成水和另一种金属的化合物
【问题】请同学们回忆,酸如盐酸、硫酸等,除上述反应外,还能和什么物质反应?
【分析并小结】酸的化学性质
4、和金属的化合物反应。如:
Na2CO3+2HCl=2NaCl+CO2↑+H2O
Na2CO3+H2SO4=Na2SO4+CO2↑+H2O
CaCO3+2HCl=CaCl2+CO2↑+H2O
BaCl2+H2SO4=BaSO4↓+2HCl
AgNO3+HCl=AgCl↓+HNO3
【教师】通过上面的学习,我们就可以解决这样的一个问题:
现有两支试管,分别盛有稀盐酸和稀硫酸,请设计实验鉴别二者。
分析:方法一,分别加入少量氯化钡溶液,有白色沉淀产生的是稀硫酸,无变化的则是稀盐酸;方法二,分别加入少量的硝酸银溶液,有白色沉淀产生的则是稀盐酸,无变化的则是稀硫酸。
【课堂小结】本节课重点学习了酸的化学性质,知道了酸溶液可以与指示剂作用,酸能和活泼金属反应,也能和金属氧化物反应。同时也认识到盐酸和硫酸与一些金属化合物的反应。这部分的内容很重要,请同学们在课后一定要好好复习复习。
今天虽然学习了酸的不少化学性质,但是还有一点非常重要的化学性质我们没有讲到,那就是和碱的反应,这部分太重要了,以至于我们本节课没有时间来讨论它,而在课题2,花一个课题的时间重点讨论它。
(三)课堂练习,巩固提高
有关酸的化学性质的练习。
七、板书设计
一、酸的化学性质
1、和指示剂作用,酸溶液使紫色石蕊变红,使无色酚酞不变色
2、和活泼金属反应,生成氢气和另一种金属的化合物
3、和金属氧化物反应,生成水和另一种金属的化合物
4、和金属的化合物反应
科粤版8.2 常见的酸和碱教案: 这是一份科粤版8.2 常见的酸和碱教案,共3页。
初中化学科粤版九年级下册8.2 常见的酸和碱优质教案设计: 这是一份初中化学科粤版九年级下册8.2 常见的酸和碱优质教案设计,共8页。教案主要包含了知识与技能,过程与方法,情感等内容,欢迎下载使用。
科粤版九年级下册第八章 常见的酸、碱、盐8.2 常见的酸和碱优秀教学设计及反思: 这是一份科粤版九年级下册第八章 常见的酸、碱、盐8.2 常见的酸和碱优秀教学设计及反思,共4页。













