











化学九年级下册8.2 常见的酸和碱教课课件ppt
展开1、知识与技能:(1)掌握稀酸的化学性质;(2)知道常见的酸的用途;(3)掌握氯离子的鉴别知识.2、过程与方法:通过实验学习稀酸的化学性质,使学生学会运用归纳的方法总结物质的性质.情感、态度和价值观:通过对常见酸的化学性质的学习,使学生认识到化学在人类生产、生活中的重要作用.
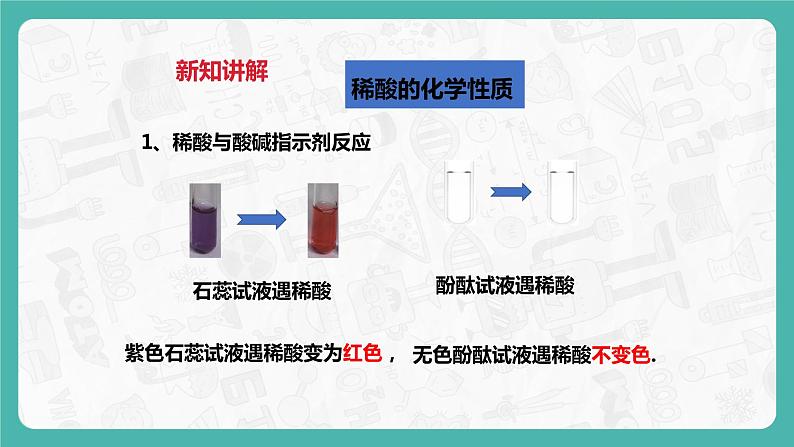
紫色石蕊试液遇稀盐酸、稀硫酸颜色有什么改变?无色酚酞试液遇稀盐酸、稀硫酸颜色有改变吗?
酸碱指示剂与酸的反应属于酸的化学性质还是物理性质?
1、稀酸与酸碱指示剂反应
无色酚酞试液遇稀酸不变色.
紫色石蕊试液遇稀酸变为红色,
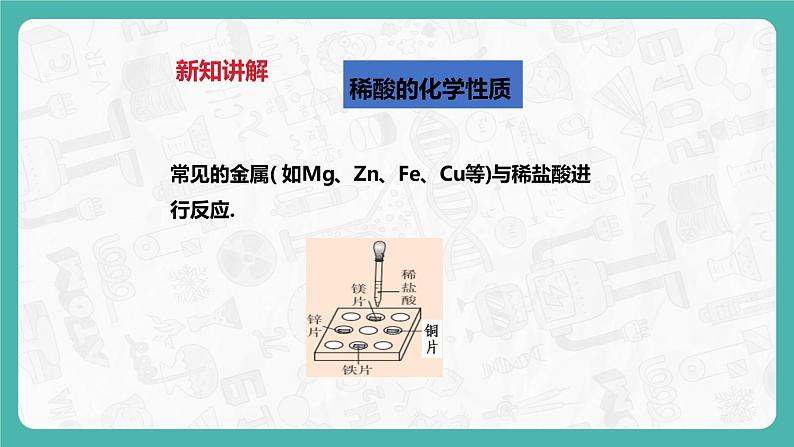
2、稀酸与较活泼金属反应
写出铁和稀硫酸反应的化学方程式,判断反应中各物质的类别.
Fe+H2SO4=FeSO4+H2↑
硫酸亚铁是怎样构成的?
由亚铁离子和硫酸根离子组成
由金属离子和酸根离子组成的化合物通常称为盐.
常见的金属( 如Mg、Zn、Fe、Cu等)与稀盐酸进行反应.
酸 + 较活泼金属 → 盐 + 氢气
镁、锌、铁表面有气泡产生,反应速率:镁>锌>铁,铜表面无明显变化.
①Zn + 2HCl = ZnCl2 + H2↑ ②Mg + 2HCl = MgCl2 + H2↑③Fe + 2HCl = FeCl2 + H2↑
1、金属活动顺序表中氢后面的金属不能与稀酸反应生成氢气.
2、单质铁与稀酸反应后生成亚铁盐.
3、硝酸的性质较特殊,它与较活泼金属发生反应时,一般不生成氢气,而是生成氮氧化物等.
3、稀酸与金属氧化物反应
稀盐酸滴进氧化铜中,必要时加热振荡,生成蓝色的溶液.写出其反应的化学方程式,判断反应前后各物质的类别.
2HCl + CuO = CuCl2 + H2O
在试管中放入一支生满铁锈(主要成分是Fe2O3)的铁钉,滴入稀硫酸,加热并振荡.
酸 + 金属氧化物 → 盐 + 水
铁锈逐渐溶解,溶液由无色变为黄色.
Fe2O3+3H2SO4 = Fe2(SO4)3 + 3H2O
1、盐酸能除去铁锈吗?如能,写出反应的化学方程式.
2、生锈的铁器在用稀盐酸或稀硫酸除锈时,能否长时间浸泡?为什么?
Fe2O3 + 6HCl = 2FeCl3 + 3H2O
不能,因为除完铁锈后,稀盐酸或稀硫酸会与里面的铁反应,使铁器损坏.
写出实验室用稀盐酸与石灰石反应制取二氧化碳的化学方程式,判断反应前后各物质的类别.
2HCl + CaCO3 = CaCl2 + H2O + CO2↑
[新酸(碳酸)分解所得]
采用微型化学实验技术,将稀盐酸滴入硝酸银溶液中.
酸 + 盐 → 新酸 + 新盐
AgNO3+HCl == AgCl ↓ + HNO3
取样品于试管中,滴加硝酸银溶液,有白色沉淀生成,滴加足量稀硝酸,沉淀不溶解,证明该溶液中含有氯离子.
5、稀酸与碱反应(第三节学习)
酸为什么有这些相似的化学性质?
HCl = H+ + Cl- H2SO4 = 2H+ + SO42- HNO3 = H+ + NO3-
小结:酸在水溶液中都能电离出相同的阳离子——H+,所以它们具有一些共同的化学性质,即酸的通性.
4. 酸+盐 → 新盐+新酸如:AgNO3+HCl=AgCl↓+HNO3
1.酸能使紫色石蕊溶液变红,不能使无色酚酞溶液变色.
2.酸+金属 → 盐+氢气注:金属的活动性必须排在氢前面如: Zn+H2SO4=ZnSO4+H2↑
3.酸+金属氧化物 → 盐+水如: Fe2O3+3H2SO4=Fe2(SO4)3+3H2O
人教版九年级下册课题1 常见的酸和碱公开课ppt课件: 这是一份人教版九年级下册课题1 常见的酸和碱公开课ppt课件,文件包含第2课时酸的化学性质pptx、第2课时酸的化学性质docx、第2课时酸的化学性质学用docx、第2课时酸的化学性质docx、铁锈与稀硫酸反应mp4等5份课件配套教学资源,其中PPT共18页, 欢迎下载使用。
初中化学科粤版九年级下册第八章 常见的酸、碱、盐8.2 常见的酸和碱课文内容课件ppt: 这是一份初中化学科粤版九年级下册第八章 常见的酸、碱、盐8.2 常见的酸和碱课文内容课件ppt,文件包含82常见的酸和碱第1课时练习docx、82常见的酸和碱第1课时课件pptx、82常见的酸和碱第1课时教案wps、82常见的酸和碱第1课时学案doc等4份课件配套教学资源,其中PPT共19页, 欢迎下载使用。
初中化学沪教版九年级下册第7章 应用广泛的酸、碱、盐第2节 常见的酸和碱课文配套课件ppt: 这是一份初中化学沪教版九年级下册第7章 应用广泛的酸、碱、盐第2节 常见的酸和碱课文配套课件ppt,文件包含72常见的酸和碱第3课时课件pptx、72常见的酸和碱第3课时练习doc、72常见的酸和碱第3课时学案doc、72常见的酸和碱第3课时教案doc、碳酸氢钠受热分解wmv、酸碱与指示剂的作用wmv、酸与金属的反应wmv、稀盐酸和铜银不反应mp4、稀盐酸稀硫酸跟生锈铁钉的反应MP4、碳酸钠碳酸氢钠与稀盐酸的反应mp4、硝酸钾的溶解度与温度的关系flv、硝酸钾的溶解度与温度的关系wmv、浓硫酸的吸水性mp4、氯化钠溶解wmv、氢氧化钠和氢氧化钙溶液与指示剂作用mpg、把水加入浓硫酸mp4、中和反应1mp4、酸碱中和反应的应用mp4等18份课件配套教学资源,其中PPT共16页, 欢迎下载使用。













