


















人教版 (2019)选择性必修2第一节 原子结构教学课件ppt
展开秦始皇幻想帝位永在,龙体长存,日思长生药,夜作金银梦。于是各路仙家大炼金丹,他们深居简出于山野之中,过着超脱尘世的神仙般生活。炼丹家以丹砂(硫化汞)、雄黄(硫化砷)等为原料,开炉熔炼。企图制得仙丹,再点石成金,服用仙丹或以金银为皿,均使人永不老死。西洋文人也仿效于暗室或洞穴,单身寡居致力于炼金术。一两千年过去了,死于仙丹不乏其人,点石成金终成泡影。金丹大多徒劳无功而销声匿迹。中外古代炼金术士毕生从事化学实验,为何一事无成?乃因其违背科学规律。他们梦想用升华等简单方法改变金属的性质,把铅、铜、铁、汞变成贵重的金银。
殊不知用一般化学方法是不能改变元素的性质的。化学元素是具有相同核电荷数的同种原子的总称,而原子是化学变化中的最小微粒。在化学反应里分子可以分成原子,原子却不能再分。随着科学的发展,今天“点石成金”已经实现。1919年英国卢瑟福用α粒子轰击氮元素使氮变成了氧。1941年科学家用原子加速器把汞变成了黄金——人造黄金镄(一百号元素)。1980年美国科学家又用氖和碳原子高速轰击铋金属靶,得到了针尖大的微量金。这一切都离不开科学家对原子的研究。
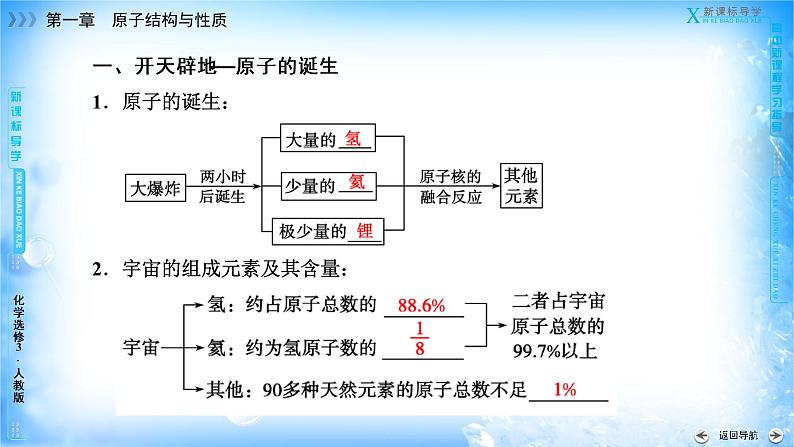
一、开天辟地——原子的诞生1.原子的诞生:2.宇宙的组成元素及其含量:
二、能量与能级1.能层:意义:根据多电子原子的核外电子的____________,将核外电子分成不同的能层符号:能层序数1、2、3、4、5、6、7分别用K、L、M、N、O、P、Q表示2.能级:意义:根据多电子原子中同一能层电子能量不同,将它们分成不同的能级符号:在每一能层中,能级符号分别为ns、np、nd、nf……,其中n代表能层
3.能层、能级中所容纳的电子数:
三、构造原理1.构造原理:(1)含义:在多电子原子中,电子在能级上的排列顺序是电子先排在能量________的能级上,然后依次排在能量________的能级上。(2)构造原理示意图。
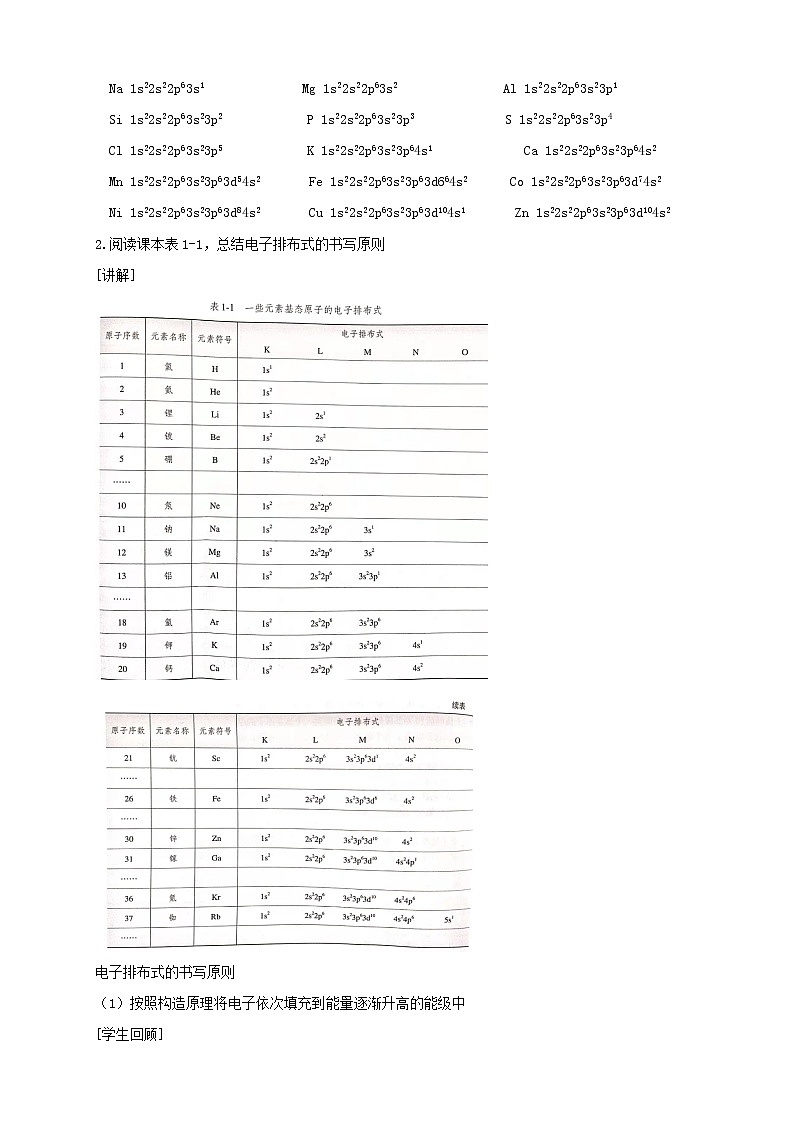
2.电子排布式:(1)概念:将________上所排布的电子数标注在该能级符号__________,并按照能层从左到右的顺序排列的式子。(2)表示方法。钠原子的电子排布式可表示为1s22s22p63s1,也可简化为[Ne]3s1。
1.思考辨析:(1)在原子中第n能层容纳的电子数一定是2n2。( )(2)最外层电子排布式为4s1的元素一定为K。( )(3)能层序数大,能级的能量一定大。( )(4)K的电子排布式为1s22s22p63s23p63d1。( )
2.在M能层中,最多能容纳的电子数为( )A.2 B.8 C.18 D.32解析:原子核外电子的每一能层最多可容纳的电子数为2n2(n为能层序数)。M能层的序数为3,故最多能容纳18个电子。
3.下列各能层不包含d能级的是( )A.O能层B.P能层C.M能层D.K能层解析:多电子原子中,同一能层的电子可分占不同的能级,K能层只有s能级,L能层有s、p能级,从M能层开始有d能级。
4.以下能级符号表述正确的是( )①5s ②1d ③2f ④1p ⑤2d ⑥3f ⑦4f ⑧5d ⑨3p ⑩6sA.③⑤⑦⑧⑨⑩B.①⑦⑧⑨⑩C.①③⑤⑦⑨D.②④⑥⑧⑩解析:每一个能层都有s能级,从第二能层开始出现p能级,从第三能层开始出现d能级,从第四能层开始出现f能级。综上所述,B项正确。
5.下列叙述正确的是( )A.M电子层只有s、p 2个能级,该电子层最多能容纳8个电子B.d能级最多能容纳5个电子,f能级最多能容纳7个电子C.无论哪一电子层的s能级,最多容纳的电子数均为2D.任一电子层都有s、p能级,但不一定有d能级解析:A项,M电子层有s、p、d 3个能级,该电子层最多能容纳18个电子;B项,d能级最多能容纳10个电子,f能级最多能容纳14个电子;C项,每个电子层都从s能级开始,且s能级最多能容纳2个电子;D项,K电子层只有s能级,不含有p能级。
6.按要求书写原子或离子的电子排布式。(1)K______________________。(2)Cl-___________________。(3)Fe_________________________。(4)Fe3+______________________。解析:因E(3d)>E(4s),故19号K先排4s能级,电子排布式为1s22s22p63s23p64s1;氯离子是由氯原子得到一个电子填充在最外层,使原来未充满的3p能级达到8电子稳定结构;铁是26号元素,其价电子与次外层的d能级有关,当铁失去电子时,是从最外层开始失去电子,所以先失去的是4s能级上的两个电子,再失去次外层3d能级上的一个电子。
1s22s22p63s23p64s1
1s22s22p63s23p6
1s22s22p63s23p63d64s2
1s22s22p63s23p63d5
1.不同能层分别有多少个能级?与能层序数(n)间存在什么关系?2.原子核外电子的每一个能层最多可容纳的电子数与能层序数(n)间存在什么关系?3.以s能级为例,不同能层的s能级间能量有何关系?同一能层,不同能级间能量有何关系?
知识点一 能层和能级的组成与能量关系
1.提示 任一能层的能级数等于该能层序数。相等。2.提示 各层最多容纳的电子数为2n2。3.提示 1s<2s<3s<4s……ns
3.不同能层中各能级之间能量大小关系(1)不同能层中同一能级,能层序数越大能量越高。例如,1s<2s<3s……2p<3p<4p……(2)同一能层中,各能级之间的能量大小关系是s
解析:A项,各能层最多容纳的电子数为2n2,错误;B项,各能层的能级都是从s能级开始,每个能层上能级数与能层序数相等,并不是所有能层的能级都到f能级结束,如第1、2、3能层,错误;C项,各能层含有的能级数与其能层序数相等,错误;D项,各能级的原子轨道数按s、p、d、f的顺序依次为1、3、5、7,正确。规律方法指导:熟记能层、能级中的“4”个数量:(1)任一能层,能级数=能层序数,且总是从s能级开始。(2)以s、p、d、f……排序的各能级最多容纳的电子数依次为1、3、5、7……的二倍。(3)每个能层最多可容纳的电子数是能层序数平方的二倍,即2n2。(4)能级符号相同的不同能层中所容纳的最多电子数相同。
1.下列能级表示正确(实际存在的)且最多容纳的电子数按照从少到多的顺序排列的是( )A.1s、2p、3d B.1s、2s、3sC.2s、2p、2dD.3p、3d、3f解析:不同能层中英文字母相同的能级,最多容纳的电子数相同,故B项错;从M层开始有d能级,即3d,不存在2d,故C项错;同理从N层开始有f能级,即4f,不存在3f,故D项错。
知识点二 构造原理与电子排布式
1.提示 ①—能层、②—能级、③—能级上的电子数。2.提示 18Ar:1s22s22p63s23p6,19K:1s22s22p63s23p64s1,最外层电子数分别为8和1。
1.构造原理(1)原理随着原子序数的递增,绝大多数元素的原子核外电子排布遵循下列顺序:图中每个小圆圈表示一个能级,每一行对应一个能层,各圆圈间连接线的方向表示随核电荷数递增而增加的电子填入能级的顺序。
(2)实质:构造原理中的电子排布顺序,其实质是各能级的能量高低顺序。(3)“能级交错”现象:由构造原理可知,核外电子排布的能级顺序为1s2s2p3s3p4s3d4p5s4d5p6s4f5d6p7s……从中可以看出,从第三能层开始,各能级不完全遵循能层顺序,产生了能级交错排列,即产生“能级交错”现象。如E(3d)>E(4s)、E(4d)>E(5s)、E(5d)>E(6s)、E(6d)>E(7s)、E(4f)>E(5p)、E(4f)>E(6s)等。
2.电子排布式的书写电子排布式是指用来表示原子核外电子排布情况的表达式,如钠原子的电子排布式为ls22s22p63s1。它能直接地反映核外电子的能层、能级和各能级上的电子数。(1)简单原子的核外电子排布式: 按照构造原理将电子依次填充到能量逐渐升高的能级中。如6C:1s22s22p2,10Ne:1s22s22p6,17Cl:1s22s22p63s23p5,19K:1s22s22p63s23p64s1。
(2)复杂原子的核外电子排布式:注意:在书写电子排布式时,能层低的能级要写在左边,不一定完全按填充顺序写。
(3)利用构造原理书写简易电子排布式为了方便,常把内层已达到稀有气体电子层结构的部分写成“原子实”,用稀有气体符号外加方括号来表示。如K:1s22s22p63s23p64s1,其中1s22s22p63s23p6看作[Ar]“原子实”,故K的电子层结构可表示为:[Ar]4s1,其中[Ar]代表Ar的核外电子排布结构,即1s22s22p63s23p6。再如Fe的简化电子排布式为:[Ar]3d64s2。
写出下列原子的电子排布式。(1)Cl基态原子的电子排布式是_________________________________。(2)基态Ge原子的核外电子排布式为_______________________________________________。(3)写出基态As原子的电子排布式_______________________________________________。(4)P原子的核外电子排布式是_________________________________。
1s22s22p63s23p5或[Ne]3s23p5
1s22s22p63s23p63d104s24p2或[Ar]3d104s24p2
1s22s22p63s23p63d104s24p3或[Ar]3d104s24p3
1s22s22p63s23p3或[Ne]3s23p3
解析:根据原子核外电子排布所遵循的原理书写原子的电子排布式,同时应注意从3d能级开始出现“能级交错”现象。规律方法指导:电子排布式的书写顺序与电子排布顺序有所不同,电子进入能级的顺序是按构造原理中能级能量递增的顺序,而电子排布式的书写则按能层的顺序,能层中的能级按s、p、d、f能量递增的顺序排列。
2.下列基态原子或离子的电子排布式错误的是( )A.Ca 1s22s22p63s23p64s2B.Mg2+ 1s22s22p6C.F- 1s22s22p5D.Br 1s22s22p63s23p63d104s24p5
解析:A项,Ca原子核外有20个电子,根据构造原理可得其核外电子排布式为1s22s22p63s23p64s2,正确;B项,Mg2+核外有10个电子,根据构造原理可得其核外电子排布式为1s22s22p6,正确;C项,F-核外有10个电子,根据构造原理可得其核外电子排布式为1s22s22p6,错误;D项,Br原子核外有35个电子,根据构造原理可得其核外电子排布式为1s22s22p63s23p63d104s24p5,正确。
原子结构模型的演变过程古代原子学说→道尔顿原子模型→汤姆生原子模型→卢瑟福原子模型→玻尔原子模型→电子云模型。1.德谟克利特的古代原子学说:物质由原子构成,且原子是不可分的微粒;原子的结合和分离是万物变化的根本。2.道尔顿原子模型:物质由原子组成,且原子为实心球体,不能用物理方法分割;同种原子的质量和性质相同。
3.汤姆生原子模型:原子是一个平均分布着正电荷的粒子,电子镶嵌其中并中和正电荷,使原子呈电中性;原子是可以再分的。4.卢瑟福原子模型:原子由原子核和核外电子组成。原子核带正电荷,位于原子的中心并几乎集中了原子的全部质量,电子带负电荷,在原子核周围空间作高速运动。5.玻尔原子模型:电子在原子核外一定轨道上绕核作高速运动。6.电子云模型(现代原子结构学说):现代科学家用量子力学的方法描述核外电子运动,即运用电子云模型描述核外电子的运动。
构造原理揭示的电子排布能级顺序,实质是各能级能量高低。若以E表示其能级的能量,以下各式中正确的是( )A.E(5s)>E(4f)>E(4s)>E(3d)B.E(3d)>E(4s)>E(3p)>E(3s)C.E(4s)<E(3s)<E(2s)<E(1s)D.E(5s)>E(4s)>E(4f)>E(3d)
高中化学人教版 (2019)选择性必修2第一节 原子结构教案配套ppt课件: 这是一份高中化学人教版 (2019)选择性必修2第一节 原子结构教案配套ppt课件,共25页。PPT课件主要包含了构造原理,电子排布式,能级交错现象,ns2np6,s22s22p1,s22p3,s23p63d10,s22s22p6等内容,欢迎下载使用。
人教版 (2019)选择性必修2第一节 原子结构多媒体教学课件ppt: 这是一份人教版 (2019)选择性必修2第一节 原子结构多媒体教学课件ppt,共13页。PPT课件主要包含了PART01,PART02,·电子云与原子轨道·等内容,欢迎下载使用。
化学选择性必修2第一节 原子结构教课内容ppt课件: 这是一份化学选择性必修2第一节 原子结构教课内容ppt课件,共33页。PPT课件主要包含了HClO4,PH3,HNO3,NaOH,N的非金属性比P强等内容,欢迎下载使用。













