




高中化学人教版 (2019)选择性必修2第一节 原子结构教案配套ppt课件
展开1、理解原子核外电子排布的构造原理,记住能级顺序图2、能应用构造原理写出1~36号元素基态原子核外电子排布3、能根据电子排布的轨道表示式、结构示意图等推导出对应的原子或离子。
上节课,我们研究了原子核外电子的排布,核外电子分层排布,同一能层有不同的能级,同时研究基态与激发态、原子光谱,这节课研究以原子光谱事实为依据的构造原理。
核外电子在能级中依据什么规律排布?核外电子在能级中的排布又可以如何表示?
(2)根据核外电子在能层中的排布规律,画出K的原子结构示意图。分析K中电子填人的能量最高的能级,并说明判断的依据。
(1)请画出1~18 号元素的原子结构示意图。结合已有的能级知识,分析核外电子在能级中的排布规律。
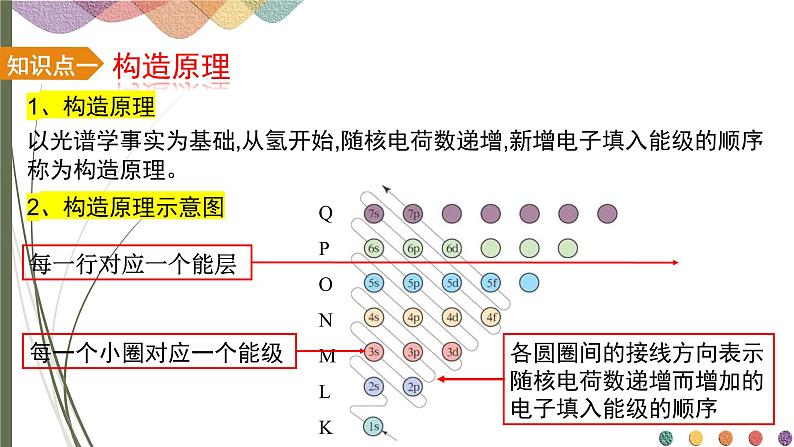
以光谱学事实为基础,从氢开始,随核电荷数递增,新增电子填入能级的顺序称为构造原理。
各圆圈间的接线方向表示随核电荷数递增而增加的电子填入能级的顺序
每一个小圈对应一个能级
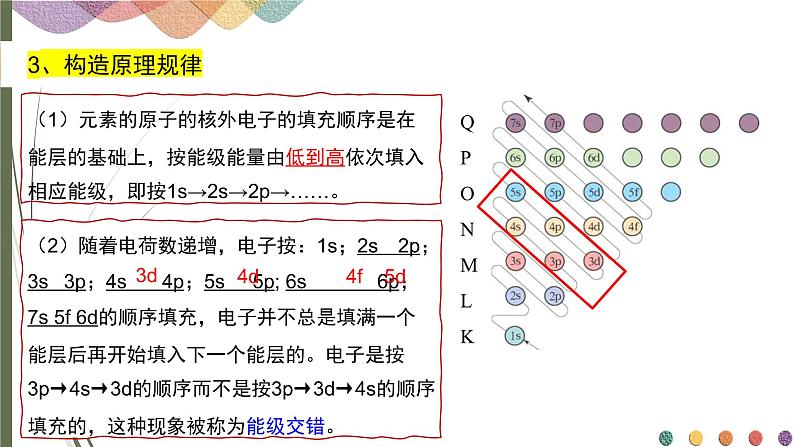
(2)随着电荷数递增,电子按:1s;2s 2p;3s 3p;4s 4p;5s 5p; 6s 6p;7s 5f 6d的顺序填充,电子并不总是填满一个能层后再开始填入下一个能层的。电子是按3p→4s→3d的顺序而不是按3p→3d→4s的顺序填充的,这种现象被称为能级交错。
(1)元素的原子的核外电子的填充顺序是在能层的基础上,按能级能量由低到高依次填入相应能级,即按1s→2s→2p→……。
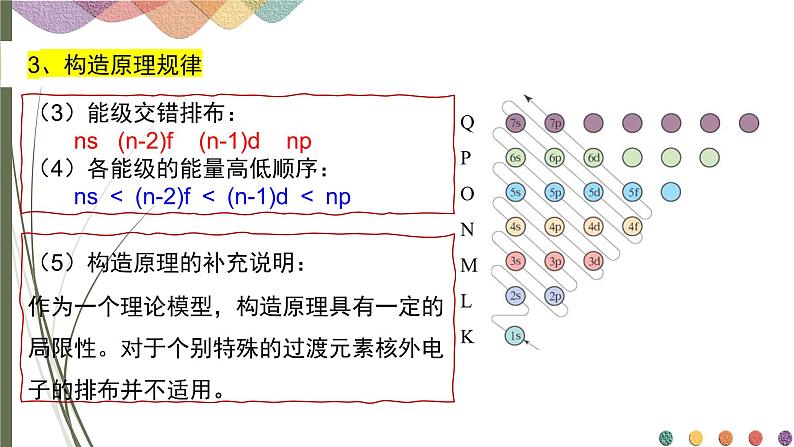
(5)构造原理的补充说明:作为一个理论模型,构造原理具有一定的局限性。对于个别特殊的过渡元素核外电子的排布并不适用。
(3)能级交错排布: ns (n-2)f (n-1)d np(4)各能级的能量高低顺序: ns < (n-2)f < (n-1)d < np
按照构造原理,元素的核电荷数每递增一个,同时增加一个核电荷和一个核外电子,就得到一个基态原子的电子排布。
电子填满了一个能级,就开始填入下一个能级,由此构建了元素周期表中各元素的基态原子的电子排布。
1s1→1s2→1s22s1→1s22s2→1s22s22p1→1s22s22p2
氢 氦 锂 铍 硼 碳
例如,从氢到碳的基态原子电子排布式为:
用数字在能级符号 角标明该能级上排布的电子数,并按照 从左到右的顺序排列的式子,称为电子排布式。
Mg元素基态原子的电子排布式中意义为:
S元素基态原子的电子排布式为__________________________。
23V元素基态原子的电子排布式为__________________________。
32Ge元素基态原子的电子排布式为__________________________。
2、下列基态原子的电子排布式,书写正确的是( )A. 9F:1s22s22p6 B. 15P:1s22s22p63s33p2C. 21Sc:1s22s22p63s23p64s23d1 D. 35Br:1s22s22p63s23p63d104s24p5
1、基态原子电子排布式书写
1s22s22p63s23p4
1s22s22p63s23p63d34s2
1s22s22p63s23p63d104s24p2
根据构造原理书写1-36号元素基态原子的电子排布式
1s2 2s22p6 3s23p5
1s2 2s22p6 3s23p6
构造理论呈现的能级交错源于光谱学事实
构造理论是一个思维模型,是个假想过程
3d10 4s2
(1)请写出稀有气体氦、氖、氩、氪、氙、氡的原子的最外层电子排布式,并写出除氦外其他元素原子的排布通式。
2He 1s2
10Ne 2s22p6
18Ar 3s23p6
36Kr 4s24p6
54Xe 5s25p6
86Rn 6s26p6
(2)电子排布式可以简化,如Na的电子排布式可以写成[Ne]3s1。请你分析[Ne]表达的含义,并仿照该式,写出8O、14Si和22Ti的简化电子排布式。分析该表示方法的优点。
[Ne]表示的是Ne的核外电子排布,也称为原子实。
Na 1s22s22p63s1
Na [Ne]3s1
这种原子的核外电子排布的表示方法叫做简化电子排布式。
原子实外的电子称为价层电子,决定元素的化学性质。
1s22s22p63s23p63d6 4s2
Fe:[Ar] 3d64s2
(1)方括号里的符号的意义是:
表示内层电子已达到稀有气体结构的部分
(2)方括号后的电子层称为价电子层
将电子排布式中的内层电子排布用相应的稀有气体元素符号加方括号来表示,而得到的式子称为简化电子排布式
Fe: 3d64s2
(1)“价层”定义:为突出化合价与电子排布的关系,将在化学反应中可能发生电子变动的能级称为价电子层(简称价层) 。
(2)价电子的位置:
①对于主族元素和零族元素来说,价电子即最外层电子
表示方法:nsx或nsxnpy
②对于副族和第VIII族元素来说,价电子除最外层电子外,还可能包括次外层电子
表示方法:(n-1)dxnsy 或 ndx (钯4d10) 或 (n-2)fx(n-1)dynsz或(n-2)fxnsy
(3)电子排布式也可以用于表示离子的核外电子排布,试写出Na+、Cl-和Fe2+的电子排布式。
Na+ 1s22s22p6
Cl- 1s22s22p63s23p6
Na 1s22s22p63s1
Cl 1s22s22p63s23p5
Fe 1s22s22p63s23p63d64s2
Fe2+ 1s22s22p63s23p63d6
Fe2+ [Ar]3d6
基态原子转化为相应离子时的一般规律:原子失去电子时总是先失去最外层电子,然后失去次外层电子,之后是倒数第三层电子……对于主族元素的原子来说,一般只失去最外层电子,而过渡元素的原子可能还会进一步失去内层电子;原子得到电子时,一般总是填充到最外能层未填满的能级上。
1、某原子的核外电子排布式为1s22s22p63s23p4,则下列说法错误的是 ( )A.该原子的简化电子排布式为[Ne]3s23p4B.该原子的价层电子排布式为3p4C.该原子核外电子共占据三个能层D.该原子核外电子共占据五个能级
解析:某原子的核外电子排布式为1s22s22p63s23p4,该元素为16号的硫元素。该原子的简化电子排布式为[Ne]3s23p4,A正确;该原子的价层电子排布式为3s23p4,B错误;该原子核外电子共占据三个能层,C正确;该原子核外电子共占据1s、2s、2p、3s、3p五个能级,D正确。
(1)B原子的电子排布式为 。 (2)N原子的最外层电子排布式为 。 (3)Se的原子序数为 ,其核外M层电子排布式为 。 (4)Li3N晶体中氮以N3-形式存在,N3-的电子排布式为 。 (5) 镓(Ga)原子的电子排式: 。
1s22s22p63s23p63d104s24p1(或[Ar]3d104s24p1)
A为 (写出元素符号,下同),电子排布式是 ; B为 ,简化电子排布式是 ; C为 ,最外层电子排布式是 ; D为 ,电子排布式是 ; E为 ,原子结构示意图是 。
1s22s22p63s23p2
人教版 (2019)选择性必修2第一节 原子结构公开课ppt课件: 这是一份人教版 (2019)选择性必修2第一节 原子结构公开课ppt课件,共24页。PPT课件主要包含了情境导入,目标一构造原理,构造原理,能级交错,电子排布式,电子数,能级符号,s22s22p3,s22s22p4,4s1等内容,欢迎下载使用。
人教版 (2019)选择性必修2第一节 原子结构多媒体教学课件ppt: 这是一份人教版 (2019)选择性必修2第一节 原子结构多媒体教学课件ppt,共13页。PPT课件主要包含了PART01,PART02,·电子云与原子轨道·等内容,欢迎下载使用。
化学人教版 (2019)第一章 原子结构与性质第一节 原子结构备课ppt课件: 这是一份化学人教版 (2019)第一章 原子结构与性质第一节 原子结构备课ppt课件,文件包含112原子结构第2课时构造原理与电子排布式习题精炼高二化学人教版2019选择性必修2含解析docx、112+原子结构第2课时+构造原理与电子排布式课件精讲高二化学同步课件精讲人教版2019选择性必修2pptx等2份课件配套教学资源,其中PPT共0页, 欢迎下载使用。













